МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
КЛАССИЧЕСКАЯ ФЕНИЛКЕТОНУРИЯ
И ДРУГИЕ ВИДЫ ГИПЕРФЕНИЛАЛАНИНМИИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E70.0, E70.1, E70.9
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 482
Разработчик клинической рекомендации
- Ассоциация медицинских генетиков
- Союз педиатров России
- Ассоциация Здоровье детей
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ГФА - гиперфенилаланинемия
ЗВУР - задержка внутриутробного развития
МГК - медико-генетическая консультация
МРТ - магнитно-резонансная томография
УЗИ - ультразвуковое исследование
ФАГ - фермент фенилаланингидроксилаза
ФКУ - фенилкетонурия
ФА - фенилаланин
ЭЭГ - электроэнцефалография
AdGTPCH (autosomal dominant guanosine triphosphate cyclohydrolase) - аутосомно-доминантный дефицит гуанозинтрифосфат-циклогидролазы I
ArGTPCH (autosomal recessive guanosine triphosphate cyclohydrolase) - аутосомно-рецессивный дефицит гуанозинтрифосфат-циклогидролазы I
BH4 (tetrahydrobiopterin) - кофактор тетрагидробиоптерин
DHPR (dihydropteridine reductase) - фермент дигидроптеридинредуктаза
GTPCH (guanosine triphosphate cyclohydrolase) - фермент гуанозинтрифосфатциклогидролаза
OMIM (online mendelian inheritance of man) - электронная база данных "Менделевское наследование у человека"
PAH (phenylalanine hydroxylase) - ген, кодирующий фермент фенилаланингидроксилазу
PCBD (pterin-4-alpha-carbinolamine dehydratase) - фермент птерин-4-альфа-карбиноламиндегидратаза
PTPS (6-pyruvoyl tetrahydropterin synthase) - фермент 6-пирувоил-тетрагидроптерин синтаза
SR (sepiapterin reductase) - фермент сепиаптеринредуктаза
мкмоль/л - микромоль на литр
мг/дл - миллиграмм на децилитр (1 мг/л равен 60 мкмоль/л)
** - препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 N 2406-р (Распоряжение Правительства РФ от 12.10.2019 N 2406-р (в ред. от 09.06.2023).
Термины и определения
Гиперфенилаланинемия - группа аутосомно-рецессивных заболеваний, обусловленных нарушением обмена незаменимой аминокислоты фенилаланина, поступающей в организм человека с белковой пищей.
"Материнская фенилкетонурия" - эмбриофетопатия, развивающаяся у плода в результате воздействия продуктов аномального метаболизма беременной женщины с фенилкетонурией при отсутствии диетического лечения.
Неонатальный скрининг - медицинская диагностическая технология сплошного безвыборочного лабораторного обследования всех новорожденных на некоторые наследственные заболевания, призванная обеспечить своевременное выявление и начало лечения больных детей с целью предотвращения их инвалидизации.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Гиперфенилаланинемии - группа аутосомно-рецессивных заболеваний, обусловленных нарушением обмена незаменимой аминокислоты фенилаланина (ФА), поступающей в организм человека с белковой пищей. Гиперфенилаланинемии (ГФА) объединяют несколько генетически гетерогенных форм нарушений обмена ФА, сходных по клиническим признакам: фенилкетонурия и нарушения обмена тетрагидробиоптерина [2, 16].
Фенилкетонурия (ФКУ) - гиперфенилаланинемия (ГФА), обусловленная недостаточностью активности фенилаланингидроксилазы (ФАГ) и приводящая к накоплению в организме ФА и продуктов его метаболизма [16, 17, 33].
Нарушения обмена тетрагидробиоптерина (BH4-дефицитная ГФА) - гетерогенная группа ГФА-состояний, вызванных дефицитом одного из ферментов, участвующих в цепи биохимических превращений тетрагидробиоптерина (BH4) [16, 17, 34, 35].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В норме в организме человека основное количество ФА утилизируется путем превращения его в тирозин, который в свою очередь служит субстратом для синтеза биогенных аминов и меланина. Лишь небольшое количество ФА используется для синтеза белка. Превращение L-фенилаланина в L-тирозин осуществляется с помощью фермента ФАГ (рис. 1).
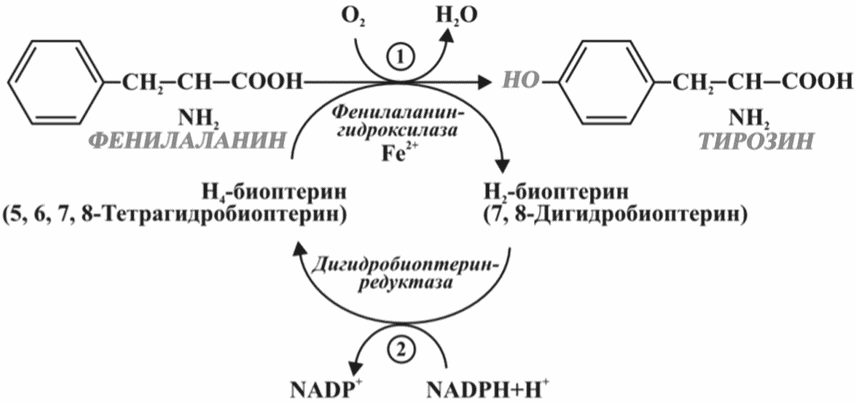
Рис. 1. Реакция (1) - преобразование фенилаланина в тирозин под действием фенилаланингидроксилазы; реакция (2) - тетрагидробиоптерин (в присутствии Fe2+) под действием фермента дигидробиоптеринредуктазы окисляется до образования дигидробиоптерина.
В основе патогенеза ГФА лежит блокирование гидроксилирования ФА и превращения его в тирозин. Прямым следствием этого нарушения являются накопление ФА в организме и снижение образования тирозина. При высоких концентрациях ФА происходит активация альтернативных путей его метаболизма с образованием фенилпирувата, фенилацетата, фениллактата и других производных, оказывающих токсический эффект на различные органы и ткани [16, 17].
В наибольшей степени страдают структуры центральной нервной системы (ЦНС). Повреждение головного мозга связано с эффектами избытка ФА: дисбалансом необходимых для синтеза белка аминокислот в тканях мозга, обусловленным торможением их всасывания в желудочно-кишечном тракте или нарушением реабсорбции из почечных канальцев в условиях избыточного содержания ФА в жидких средах организма, нарушением образования или стабилизации полирибосом, снижением синтеза миелина, норадреналина и серотонина, играющих исключительно важную роль в созревании и функционировании ЦНС [14, 16, 17].
ФА является конкурентным ингибитором тирозиназы - ключевого фермента синтеза меланина. Блокада этого пути, наряду с уменьшением доступности тирозина, предшественника меланина, приводит к гипопигментации волос и кожи [3].
Активность фермента ФАГ зависит от трех основных кофакторов: ФАГ-стимулирующего белка (ФАГС), тетрагидробиоптерина (BH4) и молекулярного кислорода. Функция BH4 заключается в стабилизации четвертичной структуры (фолдинге) ФАГ и других ферментов, участвующих в гидроксилировании тирозина, триптофана, аргинина (Рис. 2).
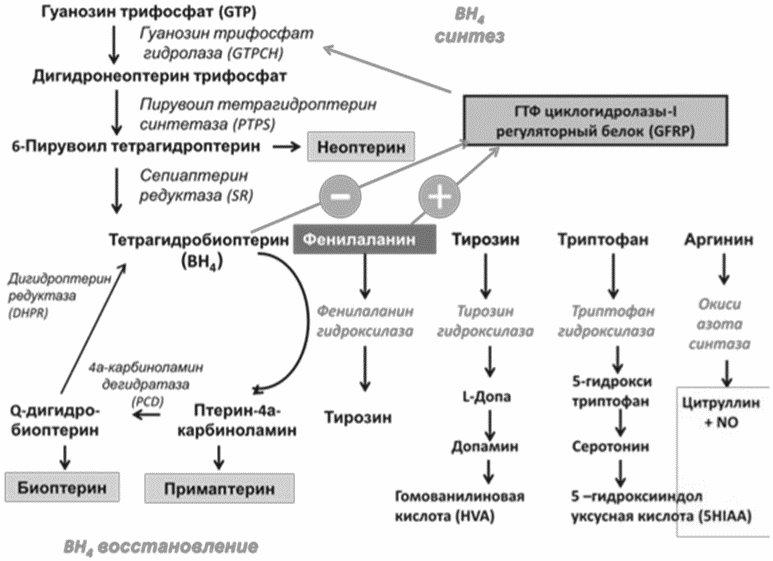
Рис. 2. Роль тетрагидробиоптерина в гидроксилировании ароматических аминокислот.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Частота ГФА среди населения планеты значительно варьирует в зависимости от популяции: от 1:4370 в Турции до 1:80500 в Японии. Наибольшая распространенность заболевание отмечена среди европеоидной расы [3 - 5]. По данным Европейских центров скрининга ГФА, частота заболевания в восточно-европейской популяции выше, чем в популяциях запада и юго-запада Европы. В Ирландии частота ГФА составляет 1:4500 1:7300, в Италии 1:12280, Греции 1:18640 [5]. В Скандинавских популяциях частота ГФА исключительно низка, особенно в Финляндии 1:71000 и Швеции 1:43230 [4, 5].
В России по данным неонатального скрининга частота ГФА составляет 1:7000 и колеблется в различных регионах от 1:4735 в Курской области до 1:18000 в Республике Тыва. В Санкт-Петербурге частота ГФА 1:7600, в Москве 1:5600. ФАГ-дефицитная ГФА выявляется в 97 - 98% случаев. BH4-дефицитные ГФА составляют 1 - 3% случаев, выявленных в ходе неонатального скрининга [8].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E70.0 Классическая фенилкетонурия
E70.1 Другие виды гиперфенилаланинемии
E70.9 Нарушения обмена ароматических аминокислот неуточненные
Комментарии: к классической фенилкетонурии (E70.0) относятся ГФА, обусловленные патогенными вариантами в гене PAH. К другим видам гиперфенилаланинемии (E70.1) - BH4-дефицитные ГФА.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Существует несколько подходов к классификации ГФА. Выделяют ФАГ-зависимую и ФАГ-независимую формы ГФА. В зависимости от тяжести и максимальной концентрации ФА в крови до лечения после установки клинического диагноза или скрининга новорожденного выделяют легкую, умеренную или тяжелую формы ГФА (Приложение Г1).
ФАГ-зависимая ГФА (фенилкетонурия) обусловлена дефектом фермента фенилаланингидроксилазы (ФАГ), преобразующего ФА в тирозин при участии кофактора/шаперона BH4. Нарушение работы ФАГ происходит в результате мутаций в гене PAH, располагающемся в регионе 12q22-q24.2. Данная нозология является наиболее распространенной формой и встречается в 98% всех случаев ГФА [6, 7].
В зависимости от тяжести выделяют следующие формы:
Легкая форма ГФА требует наблюдения и проведения дифференциальной диагностики. Строгого диетического лечения при этой форме ГФА, как правило, не назначают. Пациенты с легкой формой ГФА должны находиться под систематическим наблюдением врача с контролем уровня ФА крови [3, 16, 42].
Умеренная форма ГФА подразумевает сохранение частичной активности фермента ФАГ, требует соблюдения гипофенилаланиновой диеты, а также проведения теста на чувствительность к синтетическому аналогу тетрагидробиоптерина - Сапроптерину** с целью его назначения совместно с гипофенилаланиновой диетой [16, 28].
Тяжелая форма ГФА обусловлена минимальной активностью фермента ФАГ. Она требует соблюдения строгой гипофенилаланиновой диеты, а в некоторых случаях (после определения генотипа) проведения теста на чувствительность к Сапроптерину** (код по АТХ A16AX07) с целью выявления потенциальной чувствительности пациента к кофакторной терапии.
На основе данных молекулярно-генетических исследований была создана современная классификация ГФА, которая отражает этиопатогенез заболевания (Приложение А3.2) [6 - 13].
ФАГ-независимая ГФА включает несколько генетически гетерогенных форм (устаревшее название "атипичная ФКУ"):
1. BH4-дефицитная ГФА (тип A) обусловлена недостаточностью 6-пирувоилтетрагидроптеринсинтазы (PTPS), участвующей в процессе синтеза тетрагидробиоптерина из дигидронеоптерин трифосфата. Заболевание вызвано мутацией структурного гена PTS цитозольной 6-пирувоилтетрагидроптеринсинтазы, сопровождается ферментативной недостаточностью PTPS в печени и эритроцитах. Ген PTS расположен на длинном плече хромосомы 11, в районе q22.3-23.3 [6, 7, 9, 34, 35].
2. BH4-дефицитная ГФА (тип B) обусловлена недостаточностью гуанозинтрифосфатциклогидролазы 1 (GTPCH), которая функционирует на начальных этапах синтеза BH4, преобразуя гуанозин 5'-трифосфат в дигидронеоптеринтрифосфат. Фермент контролируется геном GCHI, локализованным на длинном плече хромосомы 14, в регионе 14q22.2 [6, 7, 9, 34, 35].
3. BH4-дефицитная ГФА (тип C) обусловлена дефицитом дигидроптери-динредуктазы (DHPR), которая контролирует восстановление BH4 из дигидробиоптерина, обеспечивая его реактивацию. Заболевание вызвано мутацией гена QDPR, который расположен на коротком плече хромосомы 4, в регионе 4p15.3 [6, 7, 9, 34, 35].
4. BH4-дефицитная ГФА (тип D) обусловлена дефицитом  (PCD), которая также участвует в восстановлении BH4. Фермент кодируется геном PCBD, локализованном на длинном плече хромосомы 10, в районе 10q22.1 [6, 7, 9, 34, 35].
(PCD), которая также участвует в восстановлении BH4. Фермент кодируется геном PCBD, локализованном на длинном плече хромосомы 10, в районе 10q22.1 [6, 7, 9, 34, 35].
5. ДОФА-зависимая дистония, обусловлена дефицитом сепиаптеринредуктазы (SPR), условно входит в группу ГФА, так при этом заболевании обычно не наблюдается повышения уровня ФА в крови. Тем не менее, уровень ФА повышается в головном мозге пациента, что обуславливает развитие клинической картины, сходной с другими BH4-дефицитными ГФА. Заболевание связано с недостаточностью фермента SPR, который принимает участие в заключительном этапе синтеза BH4. Активность сепиаптеринредуктазы кодирует ген SPR, расположенный на длинном плече хромосомы 2, в регионе 2q13.2 [6 - 8].
6. Гиперфенилаланинемия без дефицита тетрагидробиоптерина обусловлена мутациями в гене DNAJC12, кодирующем белок JDP1. Белок JDP1 выполняет функцию схожую с BH4 - является шапероном для ферментов, участвующих в метаболизме нейротрансмиттеров и фолдинге фермента ФАГ. Таким образом, дефект гена DNAJC12 приводит к развитию фенотипа схожего с BH4-дефицитными ГФА [6 - 8].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические особенности ФАГ-дефицитной ГФА (классической ФКУ).
Клинические проявления заболевания зависят от сроков начала терапии, тяжести повреждения фермента. Без эффективной терапии у большинства пациентов со значительным дефицитом ФАГ, известным как классическая ФКУ, развивается тяжелое поражение нервной системы, при своевременном начале терапии есть возможность избежать выраженных клинических проявлений болезни [21].
Пациенты с тяжелой ГФА (классической ФКУ) без терапии.
В первые недели жизни дети с ГФА выглядят здоровыми. Манифестация болезни происходит в возрасте 2 - 6 месяцев при отсутствии диетотерапии, отмечается вялость, отсутствие/потеря интереса к окружающему, иногда наоборот, повышенная раздражительность, беспокойство, гипертонус мышц, гиперрефлексия, экзематозная сыпь. Характерен "мышиный запах" пота и мочи, который объясняется выделением фенилацетата, фенилпирувата. Во втором полугодии жизни наблюдается регресс в моторном и психоречевом развитии: дети перестают реагировать на обращенную речь, узнавать мать, не фиксируют взгляд и не реагируют на яркие игрушки, не переворачиваются на живот, не сидят. Физическое развитие нарушено в меньшей степени, однако, выявляется некоторое уменьшение окружности головы или даже микроцефалия, более позднее прорезывание зубов. У большинства нелеченых детей светлые волосы, голубые глаза. Кожа почти полностью лишена меланина и имеет повышенную чувствительность к инсоляции и травмам, поэтому нередко наблюдаются тяжелая экзема, дерматит, фолликулярный кератоз, повышенная склонность к гнойничковым инфекциям.
При отсутствии лечения развивается тяжелая умственная отсталость (IQ < 50). Эпилептические приступы по типу "салаамовых" припадков, "кивков", абсансов встречаются у 50% больных, они резистентны к противосудорожной терапии. Эпилептическую активность при проведении электроэнцефалографии регистрируют у 85 - 90% больных. Возможны и другие неврологические расстройства - атаксия, гиперкинезы, тремор рук, парезы по центральному типу, что связано с нарушением процессов миелинизации нейронов и снижением плотности белого вещества головного мозга. Вследствие хронических метаболических нарушений снижается образование нейротрансмиттеров (дофамина, серотонина, норадреналина).
В настоящее время клинические проявления ГФА практически не встречаются в связи с ранней диагностикой болезни и своевременным началом лечения. Однако в редких случаях пациенты могут быть "пропущены" при проведении массового скрининга или родители могут не соблюдать назначенную диету, поэтому следует исключать ГФА при неясных случаях умственной отсталости у детей.
Пациенты с тяжелой ФАГ-дефицитной ГФА, находящиеся на лечении.
Несмотря на раннее начало лечения и соблюдение диеты, у пациентов могут наблюдаться когнитивные нарушения, характеризующиеся особенностями зрительных и исполнительских функций, снижением скорости обработки информации, низким уровнем концентрации внимания, нарушениями динамичности процесса запоминания, речи. Даже при нормальном уровне интеллектуального развития у 96% детей с ГФА определяются различные изменения в эмоциональной сфере, мешающие их полноценной социальной адаптации: снижение познавательных способностей, высокий уровень тревожности, эмоциональная неустойчивость, гиперактивность, агрессивность [57, 59, 66].
Среди пациентов, получавших гипофенилаланиновую диету с включением несбалансированных продуктов лечебного питания, в 4 раза больше детей с избыточной массой тела и ожирением, а также в 12 раз больше - с недостаточностью питания по сравнению с больными, находившимися на лечении современными специализированными продуктами на основе аминокислот без ФА. При позднем начале диетотерапии помимо сохраняющихся неврологических симптомов отмечают увеличение числа низкорослых детей (в 10 раз), с недостаточностью питания (в 6,5 раза), с ожирением (в 7 раз) по сравнению с группой пациентов, которым лечение было начато своевременно [67].
На фоне элиминационной диетотерапии могут отмечаться дефициты микроэлементов (цинка, селена, железа, меди и магния), карнитина, 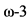 полиненасыщенных жирных кислот, витаминов B6, B12, B9 (фолиевой кислоты) [61 - 63]. Многими исследованиями доказана высокая частота остеопении у больных ГФА по сравнению с общей популяцией. Однако точно не установлены механизмы уменьшения минеральной плотности костной ткани. Выявлена связь процессов резорбции/формирования костной ткани с приверженностью к диетотерапии и достаточным поступлением микроэлементов с продуктами специального питания [68].
полиненасыщенных жирных кислот, витаминов B6, B12, B9 (фолиевой кислоты) [61 - 63]. Многими исследованиями доказана высокая частота остеопении у больных ГФА по сравнению с общей популяцией. Однако точно не установлены механизмы уменьшения минеральной плотности костной ткани. Выявлена связь процессов резорбции/формирования костной ткани с приверженностью к диетотерапии и достаточным поступлением микроэлементов с продуктами специального питания [68].
Оценка качества жизни детей с ГФА показала, что все его параметры - физическое, эмоциональное, социальное функционирование, функционирование в школе/детском саду - ниже по сравнению со здоровыми сверстниками. Максимальные различия установлены у школьников, что, по мнению авторов, связано с увеличением умственной и физической нагрузки, нарастанием напряженности внутренних психоэмоциональных процессов. При этом показано: чем позже начато лечение у больных ГФА, тем ниже показатели социального и ролевого функционирования, а с увеличением возраста обследованных детей - ниже показатели их адаптации в коллективе [69].
Корреляция между повышенными уровнями ФА в раннем возрасте и долгосрочным снижением IQ хорошо изучена. Влияние уровня ФА на IQ в течение жизни также было показано в исследованиях на взрослых. Так, у тех, кто снижает свою приверженность диете с ограниченным содержанием ФА в зрелом возрасте, IQ немного снижается, что еще больше подтверждает концепцию "пожизненной" диеты [4, 57].
Тем не менее, даже при строгом соблюдении диеты с низким содержанием ФА у взрослых могут наблюдаться когнитивные нарушения, такие как снижение языковых навыков, памяти, скорости восприятия и обработки информации, способности к обучению и исполнительной функции [58].
Взрослые, которые не соблюдают диету с ограничением ФА и имеют повышенный уровень ФА в крови, обычно плохо концентрируют внимание и демонстрируют замедленные двигательные реакции [29, 58].
Существует также более высокий уровень тревожности, депрессии, фобий и панических атак у лиц, получавших лечение в детстве, но прекративших терапию во втором десятилетии жизни. Эти данные, по-видимому, связаны как с текущими, так и с анамнестическими данными по содержанию ФА в крови [3, 36, 60, 66, 67].
Пациенты с мягким биохимическим и клиническим фенотипом ФАГ-дефицитной ГФА.
Считается, что при ФАГ-дефицитной ГФА, даже если у пациентов без диетотерапии концентрация ФА в плазме постоянно ниже 600 мкмоль/л (10 мг/дл, единицы измерения ФА: 1 мг/дл соответствует 1 мг%, 60 мкмоль/л) риск развития интеллектуальных, неврологических и нейропсихологических нарушений выше, чем у лиц без дефицита ФАГ. Эксперты рекомендуют ограничение ФА для любого пациента, у которого уровень ФА > 360 мкмоль/л (6 мг/дл) [5, 17].
Описаны случаи ГФА с легким дефицитом ФАГ, у пациентов с нормальным интеллектом, диагноз которым установили во взрослом возрасте при внезапном ухудшения психического состояния [41, 60].
"Материнская фенилкетонурия".
Синдром материнской ФКУ - комплекс симптомов, возникающих у детей женщин, страдающих ГФА и не получавших (или получавших не в полном объеме) специализированное лечение (диета и др.) в прегравидарный период и во время беременности. Синдром развивается в результате воздействия на плод повышенного содержания ФА (более 360 мкмоль/л) и его метаболитов в крови матери. Выделяют следующие проявления синдрома материнской ФКУ [4]:
- задержка внутриутробного развития (ЗВУР). Частота не отличается от общей популяции, если материнские уровни ФА контролируются в течение первых десяти недель беременности и не превышают рекомендуемый уровень 360 мкмоль/л; риск ЗВУР плода увеличивается, если концентрация ФА оптимизируется позднее;
- микроцефалия. Риск составляет 5 - 18% во время беременности, при которой уровень ФА у матери оптимизируется до беременности и в течение первых десяти недель. Риск увеличивается до 67%, если соответствующие уровни ФА не достигнуты в течение 30 недель беременности;
- врожденный порок сердца и другие пороки развития. Повышенные концентрации ФА в материнской крови (> 600 мкмоль/л) во время ранних сроков беременности приводят приблизительно к 8% - 12% риску пороков развития сердца. Фенотипические особенности и другие врожденные дефекты (включая трахеопищеводные свищи и др.) также были зарегистрированы у детей, рожденных от женщин с ГФА;
- интеллектуальный дефицит (> 90%). Критическим значением является концентрация ФА в материнской крови, постоянно превышающая 360 мкмоль/л во время беременности, с обратной зависимостью между когнитивной функцией ребенка и уровнем ФА в материнской крови выше 360 мкмоль/л;
При постоянном лечении и контроле уровня ФА крови риск врожденных пороков развития плода у женщины с ГФА минимален.
Клинические особенности BH4-дефицитных ГФА
Клинически ГФА-BH4 характеризуются гиперфенилаланинемией, дефицитом нейротрансмиттеров дофамина и серотонина, прогрессирующими интеллектуальными и моторными нарушениями [4, 6]. Для этих нозологических форм характерно отсутствие положительной клинической динамики на ограничение поступления ФА с пищей и на фоне адекватного снижения уровня ФА крови. Без лечения BH4-дефицитные ГФА типы A, B, C имеют сходные клинические симптомы и характеризуются ранней манифестацией в первые 3 месяца жизни, а в половине случаев - в неонатальном периоде. Степень тяжести клинических проявлений у детей и взрослых варьирует. При тяжелом течении в клинической картине преобладает быстро прогрессирующая задержка психомоторного развития, тонико-клонические судорожные приступы, повышенная возбудимость, гиперрефлексия, мышечная дистония (гипотония мышц туловища, гипертонус мышц конечностей), спастический тетрапарез, а также экстрапирамидные симптомы (хореиформные гиперкинезы), нарушение походки, тремор, атаксия, расстройства глотания, гиперсаливация, нарушения терморегуляции, псевобульбарные расстройства, окулогирные кризы (эпизодическое содружественное отклонение глаз, обычно направленное вверх и латерально). В некоторых случаях наблюдаются изменения выраженности неврологических симптомов в течение суток: ухудшение во второй половине дня, а утром, после сна - улучшение состояния. При A и C типе BH4-дефицитных ГФА часто встречается микроцефалия. Легкие формы BH4-дефицитных ГФА могут протекать с минимальными клиническими признаками.
Повышение концентрации ФА в плазме крови пациентов с BH4-дефицитными ГФА может сильно варьировать от небольшой (не более 360 - 600 мкмоль/л) до очень высокой (2500 мкмоль/л), сходной с таковой при классической ФКУ.
У части пациентов с дефектами гена GCH1 при рождении содержание ФА в крови может быть нормальным (такие случаи не будут выявлены при неонатальном скрининге), но позднее концентрация ФА периодически может повышаться. В тканях и биологических жидкостях пациентов больного определяется резкое снижение содержания конечных метаболитов биогенных аминов - гомованилиновой и 5-гидроксииндолуксусной кислот.
Недостаточность 6-пирувоилтетрагидроптеринсинтетазы (BH4-дефицитная ГФА тип A).
Этот вариант является наиболее распространенным, он обуславливает около 60% всех случаев ГФА с дефицитом BH4. Проявляется в тяжелой (центральная) и умеренной (периферическая) формах. Первая, наиболее часто встречающаяся (80%), тяжелая форма сопровождается выраженным снижением содержания биогенных аминов серотонина и катехоламинов в цереброспинальной жидкости (ликворе).
При тяжелой форме неспецифические симптомы могут проявляться с первых недель жизни ребенка: мышечная гипотония, вялое сосание, снижение двигательной активности. Некоторые дети рождаются с признаками задержки внутриутробного развития. Нарушения со стороны центральной нервной системы обычно становятся заметными в возрасте около 4 месяцев. Без применения патогенетической терапии у пациентов отмечаются сонливость, раздражительность, мышечная дистония, гиперкинезы, гипертермия, гиперсаливация и трудности с глотанием, далее к указанным симптомам присоединяются судороги (тонико-клонические, миоклонические), развивается умственная отсталость. При этой форме часто наблюдается микроцефалия [70]. Периферическая форма характеризуется незначительным снижением уровня нейромедиаторов, невысокой ГФА, более благоприятным клиническим течением с поздней манифестацией и умеренным поражением ЦНС. Ухудшение состояния больного обычно происходит в подростковом возрасте и проявляется нейровегетативными и болевыми приступами.
Недостаточность гуанозинтрифосфатциклогидролазы 1 (BH4-дефицитная ГФА тип B), приводящая к клинике ГФА-BH4B [6], также вызывают ДОФА-зависимую дистонию, которая может наследоваться по аутосомно-доминантному типу. Пациенты имеют прогрессирующую неврологическую симптоматику, обычно проявляющуюся мягче, чем при классической ФКУ в отсутствии лечения.
Недостаточность дигидроптеридинредуктазы (BH4-дефицитная ГФА тип C). Клинические проявления этой формы схожи с клиникой при других формах ГФА-BH4.
Недостаточность 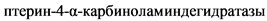 (BH4-дефицитная ГФА тип D) характеризуется доброкачественным, малосимптомным течением заболевания. [6].
(BH4-дефицитная ГФА тип D) характеризуется доброкачественным, малосимптомным течением заболевания. [6].
Недостаточность сепиаптеринредуктазы (ДОФА-зависимая дистония). Описанные случаи дефектов гена SPR не сопровождаются гиперфенилаланинемией. Клинические проявления сходны с ГФА-BH4 [64].
В младенчестве могут отмечаться неспецифические симптомы: задержка моторного развития и низкий мышечный тонус. Заболевание обычно развивается на первом году жизни, проявляясь дистонией, задержкой формирования двигательных и речевых навыков, мышечной слабостью, центральной гипотонией, а также окулогирными кризами; выраженность симптомов колеблется в течение суток (ночью наблюдается ухудшение, утром, после сна - улучшение состояния). Позднее часто развиваются нарушения сна и психологические расстройства (тревожность, раздражительность). Часто возникают интеллектуальные нарушения, но у многих больных наблюдаются только легкие или умеренные трудности при обучении. Реже развиваются такие симптомы, как паркинсонизм (тремор, брадикинезия, мышечная ригидность, застывшее лицо), дизартрия, гиперрефлексия, повышенный тонус мышц конечностей, вегетативные нарушения. Во многих случаях дистония и выраженные колебания симптоматики в течение суток проявляются лишь на более поздней стадии заболевания.
Поскольку при этой форме болезни не наблюдается повышение ФА в крови, а подходы к терапии принципиально отличаются от всех других форм нарушений обмена ФА, более детальное описание недостаточности сепиаптеринредуктазы не приведено в данных клинических рекомендациях.
ГФА без дефицита тетрагидробиоптерина, обусловленная мутациями в гене DNAJC12.
Данная форма обычно выявляется при скрининге новорожденных. Клинические симптомы сходны с ГФА-BH4-дефицитными формами: задержка психомоторного развития, повышенная возбудимость, гиперрефлексия, мышечная дистония, в более старшем возрасте - различная степень нарушения интеллекта. У некоторых пациентов в детстве развивается ДОФА-зависимый паркинсоноподобный синдром. При лабораторном исследовании выявляют дефицит допамина, серотонина в спинномозговой жидкости, и нормальный метаболизм тетрагидробиоптерина [65].
Таким образом, можно выделить шесть форм ГФА, различающихся по подходам к диагностике, лечению и наблюдению: ФАГ-дефицитная ГФА, легкая форма (не требующая терапии до года), ФАГ-дефицитная ГФА умеренная форма, требующая терапии; ФАГ-дефицитная ГФА, тяжелая форма, требующая терапии; ФАГ-дефицитная ГФА, чувствительная к терапии сапроптерином**; BH4-дефицитные ГФА; материнская ФКУ (классическая фенилкетонурия, беременность).
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза.
Главным критерием диагностики ГФА является повышенное содержание фенилаланина в крови выше 2,0 мг/дл (120 мкмоль/л), который определяется, в первую очередь, при неонатальном скрининге.
Диагноз ГФА подтверждается при наличии или отсутствии характерных клинических проявлений заболевания в сочетании с повышенным содержанием фенилаланина в крови. Для верификации диагноза необходимо дополнительное проведение молекулярно-генетического тестирования и определение соотношения фенилаланина/тирозина.
Обращаем внимание, что, согласно требований к разработке клинических рекомендаций, к каждому тезису-рекомендации необходимо указывать силу рекомендаций и доказательную базу в соответствии со шкалами оценки уровня достоверности доказательств (УДД) и уровня убедительности рекомендаций (УУР). Для многих тезисов УУР и УДД будет низким по причине отсутствия посвященных им клинических исследований высокого дизайна. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения.
2.1 Жалобы и анамнез
Большинство пациентов с ГФА диагностируются при проведении массового скрининга новорожденных и при своевременном назначении специализированной диетотерапии заболевание протекает бессимптомно.
Спектр возможных жалоб у пациентов с ГФА, которым диагноз установлен поздно или при отсутствии лечения, может быть весьма широким и зависит от формы заболевания (классической или неклассической), и индивидуальных особенностей течения болезни [6].
Жалобы при ФАГ-дефицитной ГФА (классической ФКУ): общая задержка развития, задержка роста, задержка речевого развития, задержка социального развития, интеллектуальная недостаточность, аномалии поведения, дефицит внимания и гиперактивность, аутоагрессия, депрессивность, аутизм, нарушение памяти, судорожные приступы, мышечная гипотония, гипертонус мышц конечностей, тремор, потеря двигательных навыков, тошнота, рвота, аномальный запах мочи, потеря эластичности кожи, гипопигментация кожи и волос, экзема, катаракта, микроцефалия, гиперфенилаланинемия и снижение активности ФАГ по данным лабораторных исследований, кальцинаты головного мозга, поражение белого вещества головного мозга по результатам МРТ исследования.
Жалобы при BH4-дефицитных ГФА (могут сохраняться на фоне соблюдения диеты с ограничением ФА): затруднения грудного вскармливания, задержка моторного развития, микроцефалия, повышенное слюноотделение, нарушения глотания, сонливость, птоз, лихорадочные эпизоды, экстрапирамидные нарушения (паркинсонизм, хореоатетоз, хорея), эпизоды кратковременного быстрого сокращение мышц.
- Рекомендуется исключить ГФА всем пациентам любого возраста без установленного ранее диагноза ГФА, имеющим характерные клинические проявления, такие как отягощенный семейный анамнез (повторные потери беременности, задержка внутриутробного развития, врожденные пороки развития плода, включая любые комбинации следующих пороков: микроцефалия, порок развития головного мозга, врожденный порок сердца, порок развития конечностей, трахеопищеводный свищ); эпилепсия; различная степень умственной отсталости; проблемы с поведением, включая расстройства аутистического спектра; экстрапирамидные нарушения (в том числе паркинсоноподобные нарушения у взрослых); затхлый ("мышиный", "волчий") запах тела; экзема; снижение пигментации кожи и волос с целью уточнения диагноза [2]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется исключить ГФА у женщин репродуктивного возраста, не имеющих ни одного здорового ребенка и имеющих в анамнезе невынашивание беременности или рождение потомства с пороками развития, включая любую комбинацию задержки развития плода, микроцефалию/пороки развития головного мозга, врожденный порок сердца, пороки развития конечностей, трахеопищеводный свищ и др. с целью профилактики рождения больного ребенка в семье [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется проводить сбор генеалогического анамнеза у пациентов с вышеописанными жалобами с целью выявления случаев внутриутробной гибели плода от неустановленных причин, случаев ранней детской смертности, а также инвалидов детства в семье и уточнения диагноза [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Жалобы и анамнез также описаны в разделе "клиническая картина".
2.2 Физикальное обследование
- Рекомендуется проведение антропометрических исследований всем пациентам с подозрением на ГФА с целью выявления отставания в физическом развитии [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: необходимо проводить оценку соматического и неврологического статуса, основных антропометрических показателей.
2.3 Лабораторные диагностические исследования
- Рекомендовано исследование аминокислот и ацилкарнитинов в сухом пятне крови методом тандемной масс-спектрометрии (03.Е04.01.003.032) в рамках проведения расширенного неонатального скрининга на наследственные заболевания (13.ВУ0.02.002.000) всем новорожденным для исключения классической фенилкетонурии и других видов гиперфенилаланинемии [138, 139].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется исследование уровня фенилаланина в крови в рамках проведения неонатального скрининга всем новорожденным с целью формирования групп риска по ГФА [1].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
Комментарии: схема неонатального скрининга приведена в приложении Б. Скрининговое обследование на ГФА отвечает всем принятым критериям проведения массового скрининга, включая соотношение затрат и выгоды. Для скринингового исследования направляются сухие пятна крови в установленные сроки в специализированную лабораторию неонатального скрининга конкретного региона. Общепринятые референсные значения ФА крови 0 - 120 мкмоль/л (0 - 2 мг/дл).
- Рекомендуется исследование уровня фенилаланина в крови всем пациентам с подозрением на ГФА с целью проведения диагностики ГФА [2].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется повторное исследование уровня фенилаланина в крови новорожденным детям с повышенным уровнем фенилаланина по результатам первичного теста с целью подтверждения ГФА [3, 125].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
- Рекомендуется в процессе комплексного определения концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии определять уровень фенилаланина и тирозина в крови, а также соотношение фенилаланин/тирозин всем пациентам при подозрении на ГФА в любых возрастных группах с целью выявления нарушения соотношения фенилаланин/тирозин [4, 5].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарий: при ГФА концентрация ФА превышает 120 мкмоль/л (2 мг/дл). В норме соотношение фенилаланин/тирозин менее 1, соотношение более 3 указывает на высокую вероятность недостаточности ФАГ [4]. Более тяжелые формы недостаточности ФАГ с полной потерей активности фермента (нередко называемые "классической ФКУ") сопровождаются повышением концентрации ФА более 1200 мкмоль/л (20 мг/дл) [5].
- Рекомендуется молекулярно-генетическое исследование мутаций в гене PAH (фенилкетонурия) в крови всем пациентам с клиническим диагнозом ФКУ или ГФА с целью подтверждения клинического диагноза, дифференциальной диагностики и определения рисков наследственной патологии в семье [8 - 13].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
Комментарий: так же с целью уточнения диагноза и проведения дифференциальной диагностики проводят молекулярно-генетическое исследование генов PTS, QDPR, GCH1, PCBD, SPR, DNAJC12. Комплекс исследований для диагностики фенилкетонурии включен в номенклатуру медицинских услуг.
Алгоритм ДНК-диагностики ГФА представлен в приложении А3.4.
Молекулярно-генетическая диагностика (ДНК-диагностика) может быть проведена следующими методами:
1. Поиск частых мутаций гена PAH [8];
2. Секвенирование по Сенгеру генов PAH, PTS, QDPR, GCH1, PCBD, SPR, DNAJC12;
3. Панельное, полноэкзомное или полногеномное массовое параллельное секвенирование с последующим подтверждением результатов методом секвенирования по Сенгеру [9, 10].
Результаты генотипирования трактуются врачом-генетиком и используются для:
1. Семейного консультирования, определения рисков наследственной патологии для родственников пробанда, планирования беременности;
2. Дифференциальной диагностики ФКУ, BH4-дефицитной ГФА типов A, B, C, D, ДОФА-зависимой дистонии, не-BH4-дефицитной ГФА [8, 9, 10];
3. Определения потенциальной чувствительности или потенциальной нечувствительности пациентов с ФКУ к терапии фармакологическими аналогами тетрагидробиоптерина [11, 12, 13].
Исходя из данных генотипа можно судить о потенциальном ответе пациента на терапию фармакологическими аналогами тетрагидробиоптерина (сапроптерин**, BH4). При условии, что патогенный вариант хотя бы одного из аллелей приводит к формированию белка-фермента, обладающего остаточной активностью, пациенту может быть рекомендовано проведение нагрузочного теста с BH4 (сапроптерином**).
- Рекомендуется в процессе проведения комплекса исследований для диагностики фенилкетонурии проводить молекулярно-генетическое исследование вариантов в генах PAH, PTS, QDPR, GCH1, PCBD, SPR, DNAJC12 в крови всем пациентам с гиперфенилаланинемией, у которых не выявлено частых патогенных вариантов в гене PAH для уточнения формы заболевания [8 - 13].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
- Рекомендуется в процессе проведения комплекса исследований для диагностики фенилкетонурии проводить исследование содержания птеринов в моче пациентам с неоднозначными результатами молекулярно-генетической диагностики и/или несоответствие тяжести клинической картины уровню ФА крови с целью диагностики BH4-дефицитной ГФА [6, 7, 87].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарий: диагностические значения фенилананина и птеринов в крови, моче и спинномозговой жидкости представлены в приложении А3.3 [6, 7]. Поскольку дефицит BH4 объединяет группу заболеваний, которые могут выявляться с помощью неонатального скрининга на ГФА, но не могут быть идентифицированы рутинными скрининговыми методами, селективный скрининг на дефицит BH4 необходим каждому новорожденному с уровнем фенилаланина в плазме выше 120 мкМ/л, а также детям старшего возраста с ГФА и неврологическими симптомами, у которых не выявлены патогенные варианты в гене PAH.
- Рекомендуется в процессе проведения комплекса исследований для диагностики фенилкетонурии проводить нагрузочный тест с сапроптерином** (в течение не менее 48 часов) пациентам старше года с мутациями в гене PAH, которые ассоциированы с чувствительностью к BH4 с целью определения ответа на кофакторную терапию [3, 5, 12, 15].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется использовать максимальную дозировку #сапроптерина** (20 мг/кг) для проведения нагрузочного теста у всех пациентов с целью более объективной оценки ответа [5 - 7].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Не рекомендуется определение активности фермента ФАГ в печени пациентам с ГФА для скрининга или других диагностических тестов с целью исключения проведения без крайней необходимости манипуляций, сопровождающихся высоким риском развития осложнения [4].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: активность фермента ФАГ может быть определена только в тканях печени и почек, полученных в результате биопсии. Ввиду высоких рисков осложнений метод не используется для скрининга или других диагностических тестов [4].
- Рекомендуется проведение общего (клинического) анализа крови, анализа крови биохимического общетерапевтического, общего (клинического) анализа мочи, пациентам с ГФА при проведении нагрузочного теста с сапроптерином** с целью оценки функционального состояния внутренних органов и нутритивного статуса пациента [44, 94, 131].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: при выполнении общего (клинического) анализа крови проводят исследование уровня общего гемоглобина, эритроцитов, лейкоцитов, тромбоцитов в крови, оценку гематокрита, исследование скорости оседания эритроцитов, дифференцированный подсчет лейкоцитов (лейкоцитарная формула).
- Рекомендуется исследование общего (клинического) анализа крови всем пациентам с ГФА для оценки основных параметров кроветворения и наличия воспалительных процессов [90, 95, 119, 120].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется исследование общего (клинического) анализа мочи всем пациентам с ГФА с целью выявления кристаллурии [90, 93, 95].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется проведение анализа крови биохимического общетерапевтического пациентам с ГФА с целью оценки состояния печени, почек и выявления отклонений важных биохимических показателей для дальнейшей коррекции [90, 95, 112, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: при проведении анализа крови биохимического общетерапевтического проводят определение активности аспартатаминотрансферазы, аланинаминотрансферазы, лактатдегидрогеназы, щелочной фосфатазы, гамма-глютамилтрансферазы в крови, исследование уровня холестерина липопротеинов низкой плотности, холестерина липопротеинов высокой плотности в крови, исследование уровня общего билирубина, холестерина, триглицеридов, альбумина, глюкозы, креатинина, мочевины, общего белка, натрия, калия, общего кальция, ионизированного кальция, неорганического фосфора, ферритина в крови, определение соотношения белковых фракций методом электрофореза.
- Рекомендуется исследование уровня 25-OH витамина Д в крови пациентам с ГФА с целью поддержания баланса и своевременной коррекции важнейших нутриентов при диетотерапии, кальциево-фосфорного обмена и выявления отклонений важных биохимических показателей для дальнейшей коррекции [95, 121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Рекомендуется определение уровня витамина B12 (цианокобаламин) в крови, исследование уровня фолиевой кислоты в сыворотке крови с целью своевременной коррекции при выявлении отклонений [95, 112, 121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Рекомендуется исследование уровня гомоцистеина в крови пациентам с ГФА по показаниям с целью оценки риска развития сердечно-сосудистых заболеваний [111, 112].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется определение соотношения фенилаланина/тирозина женщинам с ГФА при наступлении беременности с целью своевременной диагностики/предупреждения явлений, вызванных дефицитом тирозина/избытком фенилаланина [113, 132].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: при применении ограничительной диеты возможно развитие дефицита незаменимых аминокислот, в частности - тирозина. Исследование проводится методом тандемной масс-спектрометрии.
- Рекомендуется исследование уровня глюкозы в крови женщинам с ГФА при наступлении беременности с целью коррекции терапии [72].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
2.4 Инструментальные диагностические исследования
- Рекомендуется проведение магнитно-резонансной томографии головного мозга пациентам со всеми формами ГФА при наличии у них неврологической симптоматики для выявления прогрессирующих изменений белого вещества мозга [14, 45].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
Комментарий: возможно проведение магнитно-резонансной томографии головного мозга с применением комбинированного ингаляционного наркоза. У 90% пациентов с ГФА наблюдается прогрессирующее поражение белого вещества мозга даже при отсутствии неврологических нарушений. С возрастом у нелеченых или ушедших с диеты пациентов изменения на МРТ более выражены. Считается, что высокий уровень ФА у нелеченых пациентов препятствует миелинизации нейронов мозга, в то время как в случае раннего лечения формирование миелина не нарушается. Повреждение миелиновой оболочки может происходить под влиянием повышения ФА на фоне расширения или отказа от диеты, а также в результате низкой комплаентности пациента [14]. Частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется проведение компьютерной томографии головного мозга детям с BH4-дефицитной ГФА при наличии неврологической симптоматики для выявления кальцификатов [108, 133].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 4)
Комментарий: возможно проведение компьютерной томографии головного мозга с применением комбинированного ингаляционного наркоза. При отсутствии лечения в базальных ганглиях головного мозга формируются кальцификаты, которые могут быть обнаружены при компьютерной томографии. Исследование обычно проводится детям старше 3 лет. У пациентов с открытым родничком с ГФА возможно проведение нейросонографии для выявления патологии головного мозга. Частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется проведение электроэнцефалографии (ЭЭГ) пациентам со всеми формами ГФА при наличии неврологической симптоматики для выявления эпилептической активности [91].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
Комментарии: частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется проведение ультразвукового исследования почек в связи с высокой вероятностью развития у пациентов с ГФА поражения почек с целью своевременной диагностики и терапии данных состояний [109].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: обычно в качестве скрининг-диагностики и динамического контроля проводится ультразвуковое исследование (УЗИ) почек пациентам с ГФА для выявления дисметаболических нефропатий, нефрокальциноза. Частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется проведение рентгеноденситометрии (исследование минеральной плотности костной ткани) у пациентов с ГФА старше 5 лет для диагностики остеопороза, выявления группы риска по остеопорозу и принятия профилактических мер [48, 50].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется регистрация электрокардиограммы и проведение эхокардиографии пациентам с ГФА в связи с более частым выявлением патологии сердечно-сосудистой системы для своевременной диагностики и старта/коррекции терапии [134].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 4).
Комментарий: проводится электрокардиография пациентам со всеми формами ГФА, при необходимости, по показаниям, эхокардиография. Частота исследований определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется регистрация электрокардиограммы и/или проведение эхокардиографии пациентам с нарушением обмена тетрагидробиоптерина, получающим препараты группы N04B дофаминергические средства, с целью контроля побочных эффектов лечения [87].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 5)
Комментарии: частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
- Рекомендуется проведение дополнительного ультразвукового исследования плода беременным женщинам с ГФА с целью исключения врожденных аномалий развития плода [110, 142].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 5)
Комментарии: показано проведение ультразвукового исследования плода экспертного уровня. Всем беременным с ГФА проводится скрининговое ультразвуковое исследование при сроках беременности 11 - 14 недель, 18 - 21 неделю и 30 - 34 недели, а также дополнительно в срок 15 - 16 недель и 25 - 26 недель беременности. Частота исследования определяется врачом-специалистом в зависимости от клинического статуса.
2.5 Иные диагностические исследования
Консультации специалистов могут оказываться пациентам на разных этапах оказания медицинской помощи, в том числе в период диагностики заболевания.
- Рекомендуется прием (осмотр, консультация) врача-генетика первичный и повторный всем пациентам с установленным диагнозом ГФА с частотой, соответствующей возрасту пациента, с целью назначения и коррекции диетотерапии, осуществления контроля за адекватностью ее выполнения [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: проводят сбор анамнеза и жалоб; составление родословной; визуальное исследование с проведением антропометрии: измерение роста, веса, окружности головы. Частота - в зависимости от возраста пациента. Первичное обследование пациента должно быть проведено не позднее 3 недель жизни ребенка. Оптимальная частота наблюдения, согласно европейским рекомендациям:
- в возрасте до 1 года - не реже 1 раза в 2 месяца
- с 1 года до 12 лет - не реже 1 раз в 6 месяцев
- с 12 до 18 лет - не реже 1 раза в 6 месяцев
- старше 18 лет - не реже 1 раз в год
- при беременности - не реже 1 раз в триместр [16].
Согласно мнению рабочей группы российских экспертов, целесообразно проводить более частое наблюдение пациентов в возрасте до 1 года - не реже 1 раза в месяц, с 1 года - не реже 1 раза в 3 месяца, с 7 лет - не реже 1 раза в 6 месяцев, старше 18 лет - не реже 1 раз в год, у беременных - в зависимости от срока гестации, не реже 1 раз в 2 недели.
Если это не может быть выполнено ввиду удаленности места жительства ребенка, с пациентом должна быть налажена телекоммуникационная связь [16].
Для повышения комплаентности с законными представителями ребенка с ГФА возможно заполнение информированного согласия о необходимости соблюдения требований врача и лечения (Приложение А3.5).
- Рекомендуется прием (осмотр, консультация) врача-генетика повторный всем пациентам с установленным диагнозом ГФА с частотой, соответствующей возрасту пациента с целью консультирования, назначения и коррекции диетотерапии, осуществления контроля за адекватностью ее выполнения, разъяснения результатов лабораторного тестирования [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: проводят сбор анамнеза и жалоб; визуальное исследование с проведением антропометрии: измерение роста, веса, окружности головы.
- Рекомендуется прием (осмотр, консультация) врача-диетолога первичный всем пациентам с установленным диагнозом ГФА с целью дополнительной коррекции диетотерапии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: консультация врача-диетолога показана пациентам с целью оказания специализированной медицинской помощи. Если в штатном расписании отсутствует врач-диетолог, консультирование по диетотерапии проводит врач-генетик, врач-гастроэнтеролог. Консультация необходима при первичном обследовании и далее не реже 1 раза в месяц в течение 12 месяцев.
- Рекомендуется прием (осмотр, консультация) врача-диетолога повторный всем пациентам с установленным диагнозом ГФА для оценки эффективности диеты [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-педиатра или врача-терапевта первичный пациентам с установленным диагнозом ГФА при постановке диагноза и далее, каждые 6 месяцев, для оценки общего состояния здоровья и определения тактики дальнейшей терапии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-генетика первичный и повторный всем пациентам с подозрением на ГФА и подтвержденным диагнозом ГФА с целью определения тактики ДНК-диагностики, интерпретации полученных результатов ДНК-диагностики [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-кардиолога/врача-детского кардиолога первичный пациентам с ГФА с целью своевременного выявления и/или мониторинга кардиологических изменений [4, 5, 16, 45, 83].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: необходимо проводить кардиологическое обследование, которое включает в себя проведение эхокардиографии (при первичном обследовании и далее по показаниям) и регистрацию электрокардиограммы, в динамике - по показаниям.
- Рекомендуется прием (осмотр, консультация) врача-кардиолога/врача-детского кардиолога повторный пациентам с ГФА по показаниям для оценки выявленных кардиологических изменений и решения вопроса о терапии [4, 5, 16, 45, 83].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-невролога первичный и повторный, при необходимости, пациентам с ГФА по показаниям для своевременного выявления и коррекции неврологических изменений, подбора симптоматической терапии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога первичный всем пациентам с ГФА (при первичном обследовании и далее не реже 1 раза в 3 года), включающий обследование глазного дна (офтальмоскопию) с целью выявления глазной патологии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-гастроэнтеролога первичный пациентам с установленным диагнозом ГФА с целью выявления гастроэнтерологических нарушений и определения дальнейшей тактики лечения [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-психиатра первичный и повторный, при необходимости, пациентам с установленным диагнозом ГФА с целью оценки психиатрического статуса, назначения лечения, при необходимости [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (тестирование, консультация) медицинского психолога первичный и повторный, при необходимости, пациентам с установленным диагнозом ГФА с целью оценки и коррекции психологического состояния и психолого-педагогического сопровождения семьи [30, 51, 52, 77].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: пациентам необходимо тестирование по утвержденным методикам для определения интеллектуального развития. Целесообразно проводить с 6 месяцев и далее не реже 1 раза в 6 месяцев, взрослым - не реже 1 раза в год.
- Рекомендуется прием (осмотр, консультация) врача-сурдолога-оториноларинголога первичный пациентам с ГФА, по показаниям, с целью исключения нарушения слуха у ребенка с задержкой темпов психоречевого развития [88].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
- Рекомендуется прием (осмотр, консультация) врача-дерматовенеролога первичный пациентам с ГФА с целью диагностики патологии кожных покровов и подбора рационального лечения, при наличии показаний [78].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется прием (осмотр, консультация) врача-эндокринолога/врача - детского эндокринолога первичный пациентам с ГФА с целью уточнения нарушения функции эндокринной системы, при наличии показаний [3, 84, 85].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется осмотр (консультация) врача-физиотерапевта пациентам с ГФА с целью составления плана физиотерапевтических процедур, при наличии показаний [86].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-акушера-гинеколога и диспансерный прием (осмотр, консультация) врача-генетика женщинам с ГФА во время беременности с целью коррекции терапии и контроля ФА крови [29, 72 - 74].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Основная цель лечения - нормальное нейрокогнитивное и физическое развитие, а также психосоциальная адаптация пациента. Лучшим способом достижения этой цели является снижение и регулярный контроль содержания ФА в крови пациента с ГФА и стремление сохранять этот показатель в целевом терапевтическом диапазоне. Ведение пациентов с ГФА предполагает мультидисциплинарный подход с обязательным участием врачей-генетиков, врачей-диетологов, врачей-терапевтов, врачей-педиатров, врачей-неврологов, врачей-кардиологов/детских кардиологов, врачей-гастроэнтерологов, медицинских психологов, врачей-психиатров, врачей-физиотерапевтов, врачей-эндокринологов/детских эндокринологов и врачей других специальностей, имеющих опыт в лечении этого редкого заболевания [16].
- Рекомендуется всем пациентам с ГФА начинать диетотерапию с ограничением пищевого ФА как можно раньше (до 3-х недель жизни) после установления диагноза, с целью предотвращения повреждения центральной нервной системы [16, 17, 18, 96].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: большинство специалистов считает, что лечение новорожденных следует начинать до достижения возраста 10 дней [16]. Учитывая, что задержка начала лечения на каждые 4 недели приводила к снижению показателя IQ примерно на 4 балла [18], целесообразно начинать лечение не позднее 3-х недель жизни.
- Рекомендуется всем пациентам с ГФА начинать лечение, когда концентрация ФА в крови >= 360 мкмоль/л, с целью избежать отрицательного воздействия повышенного содержания ФА и его метаболитов на нервную систему [4, 16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: не следует назначать лечение ранее нелеченым пациентам, имеющим концентрацию ФА крови < 360 мкмоль/л. Необходимо осуществлять регулярный контроль (не реже 1 раза в месяц) уровня ФА крови у этих пациентов для того, чтобы при повышении уровня ФА вовремя назначить лечение [16].
Рекомендуется пожизненное проведение диетотерапии всем пациентам с ГФА с целью профилактики повреждений центральной нервной системы и улучшения социальной адаптации [17].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: исследования показали, что поддержание концентрации ФА крови ниже 360 мкмоль/л у пациентов с рождения до 12 лет и 400 - 600 мкмоль/л у пациентов старше 12 лет и взрослых позволяет сохранить удовлетворительное нейрокогнитивное развитие, адекватную скорость восприятия информации и сохранение психосоциальных функций. В связи с этим рекомендуется пожизненное проведение лечения, в том числе пожизненное следование диетическим ограничениям с использованием специализированных заменителей белка, источников витаминов и минералов [19].
3.1 Консервативное лечение
3.1.1 Диетотерапия
- Рекомендуется пациентам с ФАГ-зависимой ГФА назначение патогенетически обоснованной гипофенилаланиновой диеты с целью ограничения поступления ФА с пищей [20].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: диетотерапия основана на резком ограничении ФА в рационе пациентов за счет исключения высокобелковых продуктов и их замещении специализированными лечебными продуктами, частично или полностью лишенными ФА. Из рациона питания больного ГФА исключают натуральные продукты питания с высоким содержанием белка (соответственно, и ФА) - мясо, мясопродукты, рыбу, рыбопродукты, творог, яйцо, бобовые, орехи, шоколад и др. Допустимые в диете натуральные продукты вводят в рацион в соответствии с подсчетом содержащегося в них ФА.
Для детей грудного возраста (с рождения до 12 месяцев) к допустимым продуктам относятся женское молоко, детские молочные смеси, овощи, фрукты и некоторые продукты прикорма с низким содержанием белка. Прикорм вводится в те же сроки, что и здоровым детям (с 4 до 6 месяцев), но при этом используются продукты только с низким содержанием белка с учетом толерантности пациента к натуральному белку/фенилаланину [21]. Для компенсации белкового компонента пищи используют специализированные аминокислотные смеси без ФА, сбалансированные по составу наподобие адаптированных детских молочных смесей. (см. Приложение А3.6).
В диете пациентов старше 1 года, как правило, используются специализированные аминокислотные смеси без ФА с большим количеством белка, обогащенные витаминно-минеральными комплексами. В смесях, предназначенных для детей в возрасте от 1 до 8 лет, могут присутствовать в достаточном количестве углеводы и жиры. Это дает возможность индивидуального подбора лечебного продукта в зависимости от нутритивного статуса пациентов, функционального состояния желудочно-кишечного тракта и пищевых предпочтений. Кроме того, указанные смеси аминокислот, в том числе и смеси для детей первого года жизни, как более сбалансированные по составу, могут применяться также у пациентов более старшего возраста и беременных женщин с ГФА при состояниях, обусловленных заболеваниями желудочно-кишечного тракта и непереносимостью некоторых пищевых продуктов.
- Рекомендуется назначение специализированных продуктов лечебного питания, представленных в Приложении А3.6, пациентам всех возрастных групп с ГФА, требующим диетотерапию, с целью коррекции уровня ФА и улучшения качества жизни [20 - 23, 89].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется назначение низкобелковых продуктов питания пациентам старше 1 года с ГФА с целью коррекции энергетической ценности лечебного рациона [20 - 23, 89].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: низкобелковые продукты показаны детям после 1 года и далее - всем пациентам с ГФА. Список низкобелковых и безбелковых специализированных продуктов, зарегистрированных на территории Российской Федерации - в приложении А3.7. Рекомендуется при инициации диетотерапии титровать количество ФА пищи (натурального белка) всем пациентам с ГФА под контролем ФА крови для получения целевых терапевтических значений [22].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
- Рекомендуется при расчетах питания всем пациентам с ГФА ориентироваться на нормы физиологической потребности в основных нутриентах с целью обеспечения адекватного физического развития и снижения рисков нутритивной недостаточности [20, 23] (Приложение А3.8).
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: допускается уменьшение количества суточного белка (но не более 10%) в основном за счет белка аминокислотной смеси в зависимости от толерантности к пище и к фенилаланину, а также от физической активности пациента и состояния его нутритивного статуса [19, 24].
Белок за счет естественных продуктов в диете рассчитывается исходя из допустимых суточных количеств ФА с учетом, что 1 г белка содержит ~ 50 мг ФА. В зависимости от переносимости пищевого ФА допустимое и безопасное его количество в сутки составляет от 90 до 35 мг/кг массы тела для детей первого года жизни. В питании детей старше 1 года, а также подростков и взрослых допустимое количество ФА постепенно снижается с 35 до 10 мг/кг массы тела ребенка (Приложение А3.9, приложение А3.10). Также в процессе лечения определяется суточная толерантность к пищевому фенилаланину, которая зависит от степени поражения фермента фенилаланингидроксилазы и возраста пациента.
- Рекомендуется учитывать клиническую форму заболевания, уровень ФА в крови, возраст, пол, нутритивный статус (физическое развитие), толерантность к пищевому ФА, количество ФА и натурального белка, получаемого с пищей, количество основных пищевых веществ и энергии в лечебном рационе всем пациентам с ГФА при организации диетотерапии, с целью ее оптимизации [16, 20, 23].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: при назначении диеты важен индивидуальный и дифференцированный подход к использованию специализированных и натуральных продуктов соответственно возрасту пациента.
Для пациентов с ГФА независимо от их возраста сохраняется запрет на продукты, наиболее богатые фенилаланином, такие как мясо, рыба и изделия из них. Творог, твердые сыры, бобовые, куриные яйца, орехи могут в ограниченном количестве входить в рацион пациентов старшего возраста с учетом толерантности к фенилаланину. Необходимо исключить употребление пациентами с ГФА продуктов "фастфуда", газированных напитков с подсластителями (аспартам или пищевая добавка E951), содержащих фенилаланин.
Тактика диетотерапии при сопутствующих заболеваниях (выраженная гипертермия, интоксикация, различные диспепсические явления), а также при отказе от приема аминокислотной смеси заключается в кратковременном (на 2 - 3 дня) прекращении диетотерапии с заменой лечебных продуктов на натуральные с невысоким содержанием белка. После стихания острого периода болезни в рацион вновь вводится специализированный продукт, но за более короткий период, чем в начале лечения. Если пациент с ГФА не отказывается от пищи во время болезни, то лечение сопутствующих соматических заболеваний проводится по общепринятой схеме и не требует прекращения диетотерапии.
- Не рекомендуется употребление медикаментозных препаратов, биологически активных добавок, содержащих ФА или его производные, в том числе, подсластитель аспартам пациентам с ГФА с целью ограничения поступления ФА в организм [87].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
3.1.2 Медикаментозная терапия
- Рекомендуется назначение патогенетически обоснованного лечения синтетическим аналогом BH4 (сапроптерин** (A16AX Прочие препараты для лечения заболеваний желудочно-кишечного тракта и нарушений обмена веществ)) пациентам с ГФА, обусловленной недостаточностью BH4 (гиперфенилаланинемия BH4 дефицитная), с целью предотвращения тяжелых неврологических нарушений [87, 97].
Уровень убедительности рекомендации A (уровень достоверности доказательств - 1)
Комментарии: в зависимости от формы ГФА сапроптерин** используется в комплексе с диетотерапией или без нее (Приложение А3.11). Начальная доза сапроптерина** у пациентов с недостаточностью BH4 составляет от 2 до 5 мг/кг массы тела при приеме 1 раз в день. Доза может быть увеличена до 20 мг/кг массы тела в день. Для достижения оптимального терапевтического эффекта суточная доза препарата может быть разделена на 2 или 3 приема в течение дня.
- Рекомендуется назначать препараты группы N04B дофаминергические средства в комплексном лечении пациентов с BH4-дефицитными ГФА с целью коррекции экстрапирамидного синдрома [87, 124]
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: назначаются по показанию "синдром паркинсонизма" таблетки леводопа + [карбидопа]** (противопоказан детям до 18 лет, дозировка подбирается индивидуально, обычно требуется 10 - 15 мг/кг в сутки по леводопе)
- Рекомендуется проведение коррекции недостаточности фолиевой кислоты, а также дополнительное назначение фолиевой кислоты** пациентам с ГФА при беременности с целью профилактики врожденных пороков развития плода [5, 16, 121 - 124].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарий: фолиевая кислота** назначается пациентам при дефиците данного микронутриента в соответствии с инструкцией к препарату (особенно важно назначение фолиевой кислоты** в первый триместр беременности - 400 мкг/сут).
В некоторых случаях требуется диета с ограничением ФА и назначением фолиевой кислоты и ее производных (Приложение А3.11).
Назначение следует проводить под контролем уровня фолиевой кислоты в крови, в ряде исследований отмечается даже повышенный уровень фолиевой кислоты у пациентов с ФКУ [121].
- Рекомендуется медикаментозная терапия сапроптерином** пациентам с ФАГ-зависимой ГФА, имеющим до лечения концентрацию ФА крови выше 360 мкмоль/л, продемонстрировавшим положительный ответ на тестирование сапроптерином** в виде снижения концентрации ФА крови и повышения толерантности к пищевому фенилаланину с целью расширения диеты и повышения качества жизни пациента [27, 28].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: тестирование потенциальной чувствительности к препарату и лечение сапроптерином** проводит и контролирует врач, который осуществляет также наблюдение пациентов с ГФА (схемы тестирования Приложение А3.12).
Ответ на лечение препаратом сапроптерин** оценивается по степени снижения концентрации ФА в крови пациента при соблюдении стабильной гипофенилаланиновой диеты. Пациент считается чувствительным, если разница уровня ФА, полученного по окончании периода оценки ответа на лечение, и его исходного уровня перед началом приема препарата составляет 30% и более.
- Рекомендуется проведение 48-часового теста всем пациентам с ГФА старше 1 года с целью определения чувствительности к лечению сапроптерином** [27, 28].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 5).
Комментарии: при получении положительного ответа в виде снижения концентрации ФА крови и повышения толерантности к пищевому фенилаланину проводится пробное лечение не менее 28 суток и более, в течение которого определяется степень повышения толерантности к пищевому фенилаланину и вырабатывается дальнейшая тактика лечения. Возможно проведение тестирования у новорожденных пациентов.
- Рекомендуется продолжить тестирование до 7 суток в случае получения отрицательного ответа 48-часового теста пациентам с ГФА с целью определения чувствительности к лечению сапроптерином** [27, 28].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: у некоторых пациентов наблюдается отсроченный положительный ответ на лечение сапроптерином** (так называемые "поздние ответчики"). При необходимости длительная медикаментозная терапия у пациентов ГФА, отвечающих на лечение сапроптерином** снижением уровня ФА в крови, проводится в комбинации с диетой при использовании аминокислотных смесей, количество которых определяет врач.
С согласия пациентки возможно продолжение терапии сапроптерином** во время беременности: сапроптерин** назначают женщинам с ГФА, у которых ранее была доказана чувствительность к лечению сапроптерином** или тем, у кого ранее проводилось лечение данным препаратом.
- Рекомендуется прием профилактической дозы препаратов из группы A11CC витамины D и его аналоги всем пациентам с ГФА с целью коррекции/профилактики витамин D-дефицитного состояния [16, 121].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: обычно назначается колекальциферол** в соответствии с рекомендациями по коррекции витамин D-дефицитных состояний. Назначение проводится после консультации врача-эндокринолога и под контролем уровня витамина D в крови.
- Рекомендуется прием препаратов группы B03AB пероральные препараты трехвалентного железа, а также, при необходимости, препаратов группы B03BA витамин B12 (цианокобаламин и его аналоги) пациентам с ГФА и железодефицитной анемией с терапевтической целью [44, 46, 129].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
- Рекомендуется проводить симптоматическое лечение судорожного синдрома согласно действующим клиническим рекомендациям по соответствующим нозологиям пациентам с ГФА и судорожным синдромом с терапевтической целью [91, 130].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
3.2 Хирургическое лечение
Хирургического вмешательства обычно не требуется.
3.3 Иное лечение
3.3.1 Обучение
Обучение является неотъемлемой частью комплекса терапевтических мероприятий при ГФА и должно продолжаться на всем протяжении заболевания. Лечение ГФА обязательно включает обучение самоконтролю уровня ФА, принципам управления заболеванием (расчету диетотерапии).
- Рекомендуется проведение обучающих мероприятий со всеми пациентами с ГФА и, в зависимости от возраста, их родителями (законными представителями) от момента выявления заболевания и на всем его протяжении с целью повышения осведомленности пациентов и улучшения распознавания гиперфенилаланинемии, снижения рисков развития осложнений, для достижения целевых показателей уровня ФА и улучшения самостоятельного управления заболеванием [71, 79 - 82].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: цели и задачи обучения должны быть конкретизированы в соответствии с актуальным состоянием пациента. В школу фенилкетонурии направляются пациенты, не проходившие обучения (первичный цикл), или пациенты, уже прошедшие обучение (повторные циклы), для поддержания уровня знаний и мотивации или при появлении новых терапевтических целей.
- Рекомендуется использовать специально разработанные структурированные программы обучения, адресованные конкретному контингенту пациентов с ГФА (например, беременным) для достижения целевых показателей ФА, профилактики развития и прогрессирования осложнений [71, 79 - 82].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: обучение может проводиться как в индивидуальном порядке, так и в группах пациентов. Содержание обучающих программ должно соответствовать принятым стандартам диагностики и лечения ГФА, а их структура - учитывать основные принципы педагогики. Программы подразумевают строго практическую направленность и доступность для восприятия. Обязательные разделы обучающих программ:
1. школа молодых родителей ребенка с ГФА;
2. общие сведения о ГФА;
3. контроль уровня ФА;
4. диетотерапия;
5. социализация и качество жизни;
6. психологические аспекты у детей и подростков с ГФА;
7. динамическое наблюдение при ГФА;
8. подготовка к беременности и беременность при ГФА
Большая часть времени в процессе обучения должна быть посвящена практической отработке навыков, необходимых для самостоятельного управления заболеванием. Прежде всего это касается контроля уровня ФА, техники подсчета количества белка в пище.
- Рекомендуется проведение обучения пациентов с ГФА/законных представителей специально подготовленными медицинскими работниками: врачом-генетиком, врачом-диетологом, врачом-неврологом, врачом-педиатром, врачом-терапевтом, медицинской сестрой; а также с участием медицинского психолога, с целью поддержания уровня знаний и мотивации [80 - 82].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Основными аспектами медицинской и социальной помощи пациентам с ГФА являются диагностика, контроль за лечением и социальная реабилитация.
Преимущественно у детей школьного возраста и взрослых повышается уровень ФА крови в связи с нарушением рекомендаций по диетическому питанию, что требует психологической поддержки пациента. Уровень интеллектуального развития пациента, его когнитивные функции имеют корреляцию со значением ФА крови в течение жизни [36, 37].
- Рекомендуется прием (тестирование, консультация) медицинского психолога первичный пациентам с ГФА для коррекции психологического состояния, при наличии показаний [30, 51, 52].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
Комментарии: психолого-педагогическая реабилитация детей подросткового возраста. Они сталкиваются с проблемами периода полового созревания, которые сопровождается стремлением к независимости, протестным поведением, а также подверженностью влияния сверстников. Это период частых отказов пациентов с ГФА подростков от диетотерапии, употребления продуктов специализированного питания, а также высокого риска потери метаболического контроля и полной утраты медицинского наблюдения.
Социальная реабилитация включает в себя организацию питания детей с ГФА в общеобразовательных, оздоровительных учреждениях; у взрослых - возможность использования специализированных продуктов лечебного питания на рабочем месте.
Особую роль в помощи пациентам с ГФА играют общественные организации. Организация, объединяющая родителей детей с ГФА и взрослых пациентов, помогает в социальной реабилитации, социальной адаптации, помощи в трудоустройстве, организации отдыха в т.ч. в летних лагерях, досуга, социокультурной реабилитации и других мероприятиях, а также проведении родительских школ и семинаров.
Несмотря на то, что ГФА не является жизнеугрожающим заболеванием, при необходимости, в рамках реабилитации рассматривается паллиативная помощь, которая включает в себя систему мер по улучшению качества жизни пациентов с угрожающими жизни и сокращающими жизнь заболеваниями, преимущественно в терминальной стадии развития, и представляет собой активный и целостный подход к оказанию помощи, начинающийся с момента постановки диагноза и покрывающий физические, эмоциональные, социальные и духовные аспекты вплоть до смерти.
Паллиативная помощь пациентам с ГФА оказывается на основании соответствующих нормативных документов (см. Приложение А3.1)
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1 Профилактика
- Рекомендуется проспективное медико-генетическое консультирование пар, планирующих беременность, с рекомендацией обследования на гетерозиготное носительство частых мутаций в гене РАН с целью прогноза потомства [16, 55].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: частота носительства патогенной мутации в гене PAH в РФ составляет 1:50. При выявлении ГФА в семье - обследование родственников для уточнения гетерозиготного носительства мутации в генах PAH, PTS, QDPR, GCH1, PCBD, SPR, DNAJC12.
- Рекомендуется медико-генетическое консультирование пар, планирующих беременность и имеющих в семейном анамнезе детей с ГФА, с целью информирования о возможности дородовой диагностики: пренатальная диагностика, использование вспомогательных репродуктивных технологий [16, 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: дородовая диагностика проводится в паре, где установлено, что будущие родители являются носителями мутации в одном гене: PAH, PTS, QDPR, GCH1, PCBD, SPR, DNAJC12. Вероятность рождения ребенка с ГФА у женщины или мужчины, страдающих данным заболеванием, реализуется в случае, если второй родитель является гетерозиготным носителем мутантного гена (риск 50%) или также страдает ГФА (риск 100%).
- Рекомендуется консультирование девочек подросткового возраста и женщин, страдающих ГФА, по вопросу планирования семьи с целью предупреждения рождения ребенка с синдромом "материнской фенилкетонурии" [20, 115, 116, 126].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: при планировании беременности, желательно, чтобы уровень ФА крови за 2 - 3 месяца до зачатия и в течение беременности не превышал 360 мкмоль/л.
Профилактика патологии плода, в том числе ВПР, у беременной с ГФА
- Рекомендуются строгие диетические ограничения поступления ФА с пищей беременной с ГФА с целью профилактики патологии плода [16, 117, 118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендовано назначение сапроптерина** в случаях, если ранее у пациентки была подтверждена чувствительность к применению кофакторной терапии с целью расширения диеты и повышения качества жизни пациента [54].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: подробнее см. разделы "Диагностика" и "Лечение".
- Рекомендуется прием (осмотр, консультация) врача-генетика первичный взрослым пациентам с установленным диагнозом ГФА с целью обсуждения вопроса о необходимости проведения ДНК-тестирования партнеру, обсуждения возможностей по прегравидарной подготовке перед планированием беременности [72 - 74, 110, 126].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
5.2 Диспансерное наблюдение пациентов с классической фенилкетонурией
С целью предупреждения интеллектуальных, когнитивных, речевых, познавательных нарушений, гармоничного физического развития диспансерное наблюдение включает в себя следующие рекомендации:
Контроль за адекватностью лечения.
- Рекомендуется осуществлять взятие крови утром натощак (после ночного голодания) всем пациентам с целью определения контрольных значений ФА крови [25, 16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии. В настоящее время установлено, что уровень ФА в крови снижается в течение дня, причем самый высокий уровень ФА в крови достигается рано утром после ночного голодания. Правила забора крови на фильтр в приложении А3.14.
- Рекомендуется придерживаться уровня ФА крови в пределах от 120 до 360 мкмоль/л пациентам в возрасте с рождения до 12 лет с целью предупреждения нарушений нейропсихического развития и когнитивных расстройств [29, 16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: частые колебания и превышение целевых терапевтических значений ФА крови у детей в возрасте до 12 лет приводят впоследствии к нарушениям нейропсихического развития и когнитивным расстройствам [29, 16].
- Рекомендуется придерживаться уровня ФА крови в пределах от 120 до 360 мкмоль/л пациентам в возрасте с 12 - 18 лет с целью предупреждения нарушений нейропсихического развития и когнитивных расстройств [29, 30, 75, 76, 90, 105, 127].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
- Рекомендуется придерживаться уровня ФА крови в пределах от 120 до 360 мкмоль/л взрослым пациентам с целью предупреждения нарушений нейропсихического развития и когнитивных расстройств [29, 30, 75, 76, 90, 105, 127].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
Комментарии: допускаются более высокие колебания ФА крови на диете, но не выше 600 мкмоль/л [29]. Было показано, что длительное повышение уровня ФА в крови у взрослых с ФАГ-зависимой ГФА отрицательно влияет на психоэмоциональное состояние (лабильное настроение, депрессия), приводит к нарушению внимания и других нейрокогнитивных функций [30, 16, 52].
- Рекомендуется следовать гипофенилаланиновой диете и придерживаться уровня ФА крови в пределах от 120 до 360 мкмоль/л женщинам с ГФА в периоды прегравидарной подготовки, I и II семестров беременности с целью профилактики синдрома материнской ФКУ [16, 106, 107, 128].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
Комментарии: отсутствие диетических ограничений и контроля за содержанием ФА крови у женщин в прегравидарный период и во время беременности значительно повышают риск развития у плода "синдрома материнской ФКУ" [72 - 74].
- Рекомендуется поддерживать нижний целевой уровень ФА крови не менее 120 мкмоль/л всем пациентам с ГФА с целью профилактики дефицитных состояний и осложнений гипофенилаланиновой диеты [31].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4)
Комментарии: широко используемый нижний целевой уровень ФА в крови - 120 мкмоль/л получен на основании клинического опыта, описывающего неблагоприятные последствия на состояние здоровья пациента при длительно сохраняющихся очень низких концентрациях ФА в крови пациента [31]. В детском возрасте это повышенная заболеваемость, низкий нутритивный статус, энтеропатический акродерматит. У взрослых - недостаточность питания, психоэмоциональные расстройства, у женщин репродуктивного возраста - бесплодие, у беременных с ГФА - внутриутробная задержка развития плода, рождение ребенка с недостаточной массой тела к сроку гестации [25].
- Рекомендуется контролировать ФА крови не реже 1 раза в месяц всем пациентам с ГФА с максимальным значением уровня ФА на скрининге 360 мкмоль/л (6 мг/дл) в течение первого года жизни с целью своевременного выявления повышения ФА и назначения патогенетического лечения и/или уточнения формы ГФА и обязательного диспансерного наблюдения [42, 43].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: низкие уровни ФА по ре-тесту требуют проведения дифференциальной диагностики и исключения BH4-дефицитных форм ГФА [33].
- Рекомендуется регулярный контроль уровня ФА у пациентов с BH4-дефицитными формами ГФА с целью поддержания его концентрации в пределах нормальных значений (до 120 мкмоль/л или 2мг/дл) или приближенных к ним [33, 70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при BH4-дефицитной ГФА контроль адекватности терапии также проводится по уровню ФА крови [33, 70].
- Рекомендуется исследование уровня фенилаланина в крови всем пациентам с ГФА на фоне диетотерапии с целью контроля и поддержания целевых терапевтических значений [16, 22, 66].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5).
Комментарии: данные рекомендации основаны на многолетнем опыте работы врачей, специализирующихся на лечении пациентов фенилкетонурией в РФ, и были представлены в предыдущих клинических рекомендациях по фенилкетонурии. Проводить исследования необходимо со следующей частотой: в возрасте до 3-х месяцев - 1 раз в неделю (до получения результатов в пределах от 120 до 360 мкмоль/л и далее 1 раз в 10 дней); с 1 года до 6 лет - не реже 1 - 2 раза в месяц; с 7 лет и старше - не реже 1 раза в 3 месяца. В Европейских странах частота рекомендуемых исследований выше: до 1 года 1 раз в неделю, от 1 года до 12 лет 1 раз в 2 недели, старше 12 лет 1 раз в месяц, при подготовке к беременности 1 раз в неделю, при беременности 2 раза в неделю [16, 66].
- Рекомендуется контроль уровня ФА крови всем пациентам с ГФА с целью оценки эффективности терапии [36 - 41].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: необходимо придерживаться повозрастных рекомендаций по частоте контроля уровня ФА крови.
Комментарии: с появлением новых терапевтических возможностей медикаментозного лечения рекомендуется придерживаться уровня ФА в крови 120 - 360 мкмоль/л (2 - 6 мг/дл) для всех возрастов [36 - 42].
- Рекомендуется проведение общего (клинического) анализа крови всем пациентам с ГФА с целью оценки основных параметров кроветворения и наличия воспалительных процессов не реже 1 раза в год [16, 44, 66, 119 - 121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: проводят исследование уровня общего гемоглобина, эритроцитов, лейкоцитов, тромбоцитов в крови, оценку гематокрита, исследование скорости оседания эритроцитов, дифференцированный подсчет лейкоцитов (лейкоцитарная формула). При применении ограничительной диеты возможно развитие алиментарной железодефицитной анемии, которая может иметь латентный характер. Исследование проводится не реже 1 раза в год [16, 45].
- Рекомендуется проведение общего (клинического) анализа мочи всем пациентам с ГФА с целью выявления дисметаболической нефропатии [90].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при применении ограничительной диеты возможно развитие кристаллурии. Исследование проводится не реже 1 раза в год.
- Рекомендуется исследование уровня фосфора, кальция, креатинина в моче, определение белка, альбумина в моче пациентам с ГФА с целью выявления метаболической нефропатии [90, 92].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: не реже 1 раза в год.
- Рекомендуется в процессе комплексного определения концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии определять соотношения фенилаланина/тирозина пациентам с ГФА с целью своевременной диагностики и предупреждения явлений, вызванных дефицитом тирозина/избытком фенилаланина [101 - 103].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: при применении ограничительной диеты возможно развитие дефицита незаменимых аминокислот, в частности, тирозина. Исследование проводится методом тандемной масс-спектрометрии, частота определяется индивидуально, в среднем, не реже 1 раза в год.
- Рекомендуется проведение анализа крови биохимического общетерапевтического пациентам с ГФА с целью оценки состояния печени, почек и выявления отклонений важных биохимических показателей и их дальнейшей коррекции [44, 45, 46, 47, 49, 83, 121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: не реже 1 раза в год; целесообразно определение соотношения белковых фракций методом электрофореза, исследование уровня глюкозы, общего белка, общего билирубина, холестерина, триглицеридов, холестерина липопротеинов низкой плотности, холестерина липопротеинов высокой плотности, креатинина, мочевины, кальция общего и ионизированного, натрия, калия, неорганического фосфора, железа, ферритина, 25-OH витамина Д в крови, исследование уровня фолиевой кислоты в сыворотке крови, определение активности щелочной фосфатазы, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) в крови, с целью оценки баланса важнейших нутриентов при диетотерапии, оценки кальциево-фосфорного обмена, оценки состояния почек, печени с периодичностью 1 раз в год при применении ограничительной диеты возможно развитие диспротеинемии, нарушения минерального обмена и дефицита эссенциальных микроэлементов. [44, 45, 46, 47, 49].
- Рекомендуется определение уровня витамина B12 (цианокобаламин) в крови всем пациентам с ГФА, находящимся на диетотерапии, с целью оценки его уровня и своевременной коррекции отклонений [135].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 4).
Комментарии: необходимо контролировать уровень витаминов группы B с целью профилактики дефицитных состояний или гипервитаминозов. Частоту исследования определяет лечащий врач в зависимости от клинического статуса. Детям первого года жизни возможно контролировать показатели раз в 6 месяцев, далее - не реже 1 раза в год.
- Рекомендуется проведение ультразвукового исследования почек пациентам с ГФА в связи с высокой вероятностью развития поражения почек с целью своевременной диагностики и терапии данных состояний [99, 109].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: обычно в качестве скрининг-диагностики и динамического контроля проводится УЗИ почек пациентам с ГФА не реже 1 раза в год для выявления дисметаболических нефропатий, нефрокальциноза.
- Рекомендуется проведение ультразвукового исследования органов брюшной полости (комплексного) пациентам с ГФА с целью своевременного выявления изменений со стороны печени и поджелудочной железы [99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: обычно в качестве скрининг-диагностики и динамического контроля проводится ультразвуковое исследование (УЗИ) органов брюшной полости (комплексное) не реже 1 раза в год пациентам с ГФА для выявления изменений со стороны печени и поджелудочной железы.
- Рекомендуется проведение электроэнцефалографии (ЭЭГ) пациентам со всеми формами ГФА при наличии неврологической симптоматики с целью выявления эпилептической активности [91].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: при необходимости проводят так же электроэнцефалографию с видеомониторингом. ЭЭГ и ЭЭГ-мониторинг проводят по показаниям, при стабильном течении - 1 раз в год.
- Рекомендуется проведение магнитно-резонансной томографии головного мозга в процессе диспансерного наблюдения пациентам со всеми формами ГФА, при наличии у них неврологической симптоматики, для выявления прогрессирующих изменений белого вещества мозга [14, 45].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
Комментарий: возможно проведение магнитно-резонансной томографии головного мозга с применением комбинированного ингаляционного наркоза. У 90% пациентов с ГФА наблюдается прогрессирующее поражение белого вещества мозга даже при отсутствии неврологических нарушений. С возрастом у нелеченых или ушедших с диеты пациентов изменения на МРТ более выражены. Считается, что высокий уровень ФА у нелеченых пациентов препятствует миелинизации нейронов мозга, в то время как в случае раннего лечения формирование миелина не нарушается. Повреждение миелиновой оболочки может происходить под влиянием повышения ФА на фоне расширения или отказа от диеты, а также в результате низкой комплаентности пациента [14].
- Рекомендуется проведение рентгеноденситометрии (исследование минеральной плотности костной ткани) у пациентов старше 5 лет для диагностики остеопороза, выявления группы риска по остеопорозу и принятия профилактических мер [48, 50].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: частота исследований - по показаниям, но не чаще 1 раза в год [48, 50].
- Рекомендуется проведение рентгенографии кисти детям со всеми формами ГФА, имеющим задержку физического развития и полового развития, для определения костного возраста и дополнительной оценки кальциево-фосфорного обмена [104].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 4)
Комментарии: исследование проводится пациентам с 2 лет
- Рекомендуется проведение инструментальных обследований в соответствии с рекомендациями по атеросклерозу и ишемической болезни сердца в связи с более частым выявлением данной патологии у пациентов с ГФА для своевременной диагностики и старта/коррекции терапии [83, 99].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 5).
Комментарий: проводится регистрация электрокардиограммы пациентам со всеми формами ГФА, в среднем, не реже 1 раза в год, при необходимости, по показаниям, эхокардиография.
- Рекомендуется регистрация электрокардиограммы и/или проведение эхокардиографии пациентам с нарушением обмена тетрагидробиоптерина, получающим препараты группы N04B дофаминергические средства с целью контроля побочных эффектов лечения [87].
Уровень убедительности доказательств C (уровень достоверности рекомендации - 5).
Комментарий: проводится, в среднем, не реже 1 раза в год.
- Рекомендуется прием (осмотр, консультация) врачом-генетиком первичный и повторный с целью оценки нутритивного и психоневрологического статуса пациентам с ГФА для своевременного выявления нарушений и при необходимости направления к соответствующему специалисту для наблюдения и коррекции лечения [16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарий: оптимальная частота наблюдения, согласно европейским рекомендациям:
- в возрасте до 1 года - не реже 1 раза в 2 месяца
- с 1 года до 12 лет - не реже 1 раза в 6 месяцев
- с 12 до 18 лет - не реже 1 раза в 6 месяцев
- старше 18 лет - не реже 1 раз в год
- при беременности - не реже 1 раза в триместр [16].
Согласно мнению рабочей группы российских экспертов, целесообразно проводить более частое наблюдение пациентов в возрасте до 1 года - не реже 1 раза в месяц, с 1 года - не реже 1 раза в 3 месяца, с 7 лет - не реже 1 раза в 6 месяцев, старше 18 лет - не реже 1 раз в год, у беременных - не чаще 1 раза в месяц [16].
Данные рекомендации основаны на многолетнем опыте работы врачей, специализирующихся на лечении пациентов с фенилкетонурией в РФ и аналогичным рекомендациям, разработанным в странах Евросоюза [16].
- Рекомендован прием (осмотр, консультация) врача-диетолога первичный и повторный (не реже 1 раза в 12 месяцев) пациентам с установленным диагнозом ГФА для дополнительной коррекции диетотерапии и оценки эффективности диеты [16, 21, 23, 25, 26].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: консультация врача-диетолога показана пациентам с целью оказания специализированной медицинской помощи. Патогенетическим методом лечения фенилкетонурии является диетотерапия. Частота посещения врача-диетолога - по показаниям
- Рекомендован диспансерный прием (осмотр, консультация) врача-педиатра или врача-терапевта пациентам с ГФА не реже 1 раза в 6 месяцев для оценки общего состояния здоровья и определения тактики дальнейшей терапии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-генетика пациентам с установленным диагнозом ГФА с целью контроля эффективности диетотерапии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован диспансерный прием (осмотр, консультация) врача-кардиолога/детского кардиолога пациентам с ГФА не реже 1 раза в 12 месяцев для своевременного выявления и/или мониторинга кардиологических изменений [4, 5, 16, 45, 83].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован диспансерный прием (осмотр, консультация) врача-невролога пациентам с ГФА по показаниям для своевременного выявления и/или мониторинга неврологических изменений и определения тактики лечения [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован диспансерный прием (осмотр, консультация) врача-офтальмолога пациентам с ГФА осмотр не реже 1 раза в 3 года с целью выявления глазной патологии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован прием (осмотр, консультация) врача-гастроэнтеролога первичный и повторный (при необходимости) пациентам с установленным диагнозом ГФА, при наличии показаний, для своевременного выявления и/или мониторинга гастроэнтерологической патологии [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован прием (осмотр, консультация) врача-психиатра первичный и повторный (при необходимости) пациентам с установленным диагнозом ГФА, при наличии показаний, для оценки психиатрического статуса, коррекции выявленных психиатрических нарушений и определения дальнейшей тактики лечения [16].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован прием (тестирование, консультация) медицинского психолога первичный и повторный не реже 1 раза в год пациентам с ГФА, при наличии показаний, для оценки и коррекции психологического состояния и психолого-педагогического сопровождения семьи [30, 51, 52].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
Комментарии: для оценки интеллекта и других видов психической деятельности пациентов с ГФА используют соответствующие программы и тесты. Во время переходного периода подросткам особенно необходима психологическая помощь по вопросам коммуникации в семье и обществе, профессиональной ориентации; для женщин с ГФА акцент следует делать акцент на вопросах, связанных с беременностью.
Психологическая помощь пациентам может потребовать курс занятий - в зависимости от индивидуальных особенностей пациента и семьи.
- Рекомендован прием (осмотр, консультация) врача сурдолога-оториноларинголога первичный и повторный, при необходимости, пациентам с ГФА с целью исключения нарушения слуха у ребенка с задержкой темпов психоречевого развития [88].
Уровень убедительности рекомендации B (уровень достоверности доказательств - 3)
- Рекомендован прием (осмотр, консультация) врача-дерматовенеролога первичный и повторный пациентам с ГФА с целью диагностики патологии кожных покровов и подбора рационального лечения при наличии показаний [78].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендовано прием (осмотр, консультация) врача-эндокринолога первичный и повторный, при необходимости, пациентам с ГФА, при наличии показаний, с целью уточнения нарушения функции эндокринной системы [3, 84, 85].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован осмотр (консультация) врача-физиотерапевта пациентам с ГФА, при наличии показаний, с целью составления плана физиотерапевтических процедур [86].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендован диспансерный прием (осмотр, консультация) врача-акушера-гинеколога и диспансерный прием (осмотр, консультация) врача-генетика женщинам с ГФА во время беременности (с периодичностью, предусмотренной соответствующими документами, регламентирующими наблюдение за беременными) с целью коррекции терапии и контроля ФА крови [72 - 74].
Уровень убедительности рекомендации C (уровень достоверности доказательств - 5)
- Рекомендуется проводить профилактическую вакцинацию пациентам с ГФА, при отсутствии медицинских противопоказаний, с целью формирования иммунной защиты организма от инфекций по графику [16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: ГФА не является противопоказанием для профилактической вакцинации [140, 141] При наличии сопутствующих заболеваний разрешение на проведение прививок дается соответствующим специалистом. Данные рекомендации основаны, в том числе, на многолетнем опыте работы врачей, специализирующихся на лечении пациентов с фенилкетонурией в РФ.
6. Организация оказания медицинской помощи
6.1 Показания к госпитализации
Показания для плановой госпитализации в медицинскую организацию:
1. Проведение диагностики и лечения, требующие продолжительного (дневное или круглосуточное пребывание) медицинского наблюдения и мониторинга клинико-лабораторных показателей;
2. Необходимость проведения различных видов экспертиз или обследования в медицинской организации при невозможности проведения их в амбулаторных условиях (в том числе оформление заключения федерального консилиума/врачебной комиссии).
3. Проведение тестирования чувствительности к сапроптерину**.
Комментарии: проведение нагрузочного теста с сапроптерином** может быть в условиях как круглосуточного, так и дневного стационара (приложение А3.12).
При стационарном лечении пациенту назначается гипофенилаланиновая диета и аминокислотная смесь.
Показания для экстренной госпитализации в медицинскую организацию:
1. Острые угрожающие для жизни и развития осложнений состояния, требующие неотложного лечения, в том числе интенсивной терапии, а также круглосуточного медицинского наблюдения и проведения специальных видов обследования и лечения.
Показания к выписке пациента из медицинской организации:
1. Отсутствие угрозы для жизни пациента и угрозы развития осложнений, требующих неотложного лечения при завершении диагностических мероприятий.
2. Стабилизация состояния и основных клинико-лабораторных показателей патологического процесса, отсутствие необходимости в продолжительном медицинском наблюдении (дневное или круглосуточное пребывание);
3. Выполнен план обследования и лечения пациента, даны рекомендации по дальнейшему наблюдению и лечению.
4. Необходимость перевода пациента в другое медицинское учреждение или учреждение социального обеспечения.
6.2 Принципы организации медицинской помощи пациентам с ГФА
Постановка диагноза ГФА ставит много вопросов перед родственниками пациента и перед специалистами, работающими с такими пациентами. При обнаружении и развитии заболевания возникают многочисленные проблемы, для решения которых требуется грамотная организация процесса помощи при участии мультидисциплинарной команды специалистов и соблюдение основных принципов и подходов к ее оказанию.
Данные принципы должны соблюдаться на любом этапе оказания медицинской помощи, как в момент постановки диагноза, так и на любом этапе наблюдения пациента.
1) Пациент и его представители должны получать полную информацию о заболевании, его течении, патогенезе, прогнозах, осложнениях и методах возможной терапии.
2) Диагноз ГФА подразумевает возможность оказания первичной, специализированной и паллиативной помощи на всех этапах заболевания.
3) При постановке диагноза ГФА, семья должна быть направлена к специалисту, имеющему опыт работы с пациентами с ГФА, обладающего современной информацией о течении заболевания и возможности участия в клинических испытаниях (новых лекарственных препаратов и/или технических устройств). Также важным является информирование семей о существующих общественных организациях, работающих с этой группой пациентов.
4) К наблюдению за пациентом с ГФА должна быть привлечена мультидисциплинарная команда специалистов в составе: врача-педиатра/врача-терапевта, врача-генетика, врача-диетолога, врача-невролога, медицинского психолога, врача-эндокринолога/детского эндокринолога, врача-психиатра, врача-кардиолога/детского кардиолога, врача-физиотерапевта/врача по медицинской реабилитации/врача физической и реабилитационной медицины, врача-гастроэнтеролога. Другие специалисты должны привлекаться по мере возникновения специфических проблем.
Комментарии: врач-генетик осуществляет основное наблюдение за пациентами с ГФА. В круг обязанностей врача-генетика входит обследование и постановка диагноза, информирование семьи о заболевании, составление плана многопрофильного наблюдения, наблюдение за пациентом, оценка динамики и степени прогрессирования заболевания при регулярных осмотрах, назначение патогенетической терапии. При наступлении фертильного возраста у пациентов с ГФА в обязанности врача-генетика входит составление плана прегравидарной подготовки для профилактики материнской ФКУ, тестирование партнера на гетерозиготное носительство патогенных вариантов в гене РАН (или других генов в зависимости от формы ГФА у пациента). При составлении плана многопрофильного наблюдения, врач-генетик определяет кратность наблюдения у других специалистов многопрофильной команды соответственно текущему состоянию пациента. При каждом осмотре врач-генетик осуществляет переоценку текущего состояния пациента и в соответствии с этим вносит корректировки в план многопрофильного наблюдения. Также врач-генетик осуществляет наблюдение ребенка с синдромом материнской ФКУ (консультирование, определение тактики обследования, в том числе, необходимости ДНК-диагностики и интерпретации ее результатов).
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
ГФА - хроническое неизлечимое заболевание, поэтому пациенты нуждаются в активном диспансерном наблюдении и непрерывном лечении. При своевременной диагностике и адекватной терапии клиническая картина более благоприятна, при отсутствии - поражение нервной системы быстро прогрессирует. Многие пациенты, своевременно диагностируемые и получающие адекватную терапию, доживают до преклонного возраста, живут полноценной жизнью и оставляют здоровое потомство.
Критерии оценки качества медицинской помощи
Критерии оценки качества медико-санитарной помощи
|
N п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|
1.
|
Выполнен прием (осмотр, консультация) врача-педиатра или врача-терапевта первичный
|
Да/Нет
|
|
2.
|
Выполнен прием (осмотр, консультация) врача-генетика первичный
|
Да/Нет
|
|
3.
|
Выполнено исследование уровня фенилаланина в крови в рамках проведения неонатального скрининга
|
Да/Нет
|
|
4.
|
Выполнено исследование уровня фенилаланина в крови всем пациентам с подозрением на ГФА
|
Да/Нет
|
|
5.
|
Выполнено исследование уровня фенилаланина в крови всем пациентам с ГФА на фоне диетотерапии в возрасте до 3-х месяцев - 1 раз в неделю (до получения результатов в пределах от 120 до 360 мкмоль/л и далее до 1 года 1 раз в 10 дней); с 1 года до 6 лет - не реже 1 - 2 раза в месяц; с 7 лет и старше - не реже 1 раза в 3 месяца
|
Да/Нет
|
|
6.
|
Проведено в процессе проведения комплекса исследований для диагностики фенилкетонурии проводить молекулярно-генетическое исследование мутаций в генах PAH, PTS, QDPR, GCH1, PCBD, SPR, DNAJC12 в крови всем пациентам с гиперфенилаланинемией, у которых не выявлено частых мутаций в гене PAH
|
Да/Нет
|
|
7.
|
Проведен в процессе проведения комплекса исследований для диагностики фенилкетонурии нагрузочный тест с сапроптерином (в течение не менее 48-часов) пациентам старше года с мутациями в гене PAH, которые ассоциированы с чувствительностью к BH4
|
Да/Нет
|
|
8.
|
Выполнено в процессе комплексного определения концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии определение соотношения фенилаланина/тирозина пациентам с ГФА
|
Да/Нет
|
|
9.
|
Выполнено исследование уровня фенилаланина в крови (беременным с гиперфенилаланинемией на фоне диетотерапии не реже 1 раза в 7 дней в I триместре и не реже 1 раза в 2 недели во II и III триместрах)
|
Да/Нет
|
|
10.
|
Выполнено ультразвукового исследования плода беременным женщинам с ГФА на сроке 15 - 16 и 25 - 26 недель беременности
|
Да/Нет
|
|
11.
|
Выполнено назначение диетотерапии с использованием низкобелковых продуктов питания пациентам с концентрацией фенилаланина в крови >= 360 мкмоль/л
|
Да/Нет
|
|
12.
|
Назначена/скорректирована терапия сапроптерином пациентам с BH4-дефицитной и с ФАГ-дефицитной гиперфенилаланинемией, чувствительной к сапроптерину
|
Да/Нет
|
|
13.
|
Назначены специализированные продукты лечебного питания (без содержания фенилаланина)
|
Да/Нет
|
|
14.
|
Проведена коррекция диетотерапии для достижения целевых уровней фенилаланина (уровень фенилаланина <= 360 ммоль/л)
|
Да/Нет
|
Критерии оценки качества специализированной медицинской помощи
|
N п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|
1.
|
Выполнен прием (осмотр, консультация) врача-педиатра или врача-терапевта
|
Да/Нет
|
|
2.
|
Выполнен прием (осмотр, консультация) врача-генетика
|
Да/Нет
|
|
3.
|
Выполнено определение уровня фенилаланина в крови всем пациентам с ГФА на фоне диетотерапии
|
Да/Нет
|
|
4.
|
Проведен в процессе проведения комплекса исследований для диагностики фенилкетонурии нагрузочный тест с сапроптерином (в течение не менее 48-часов) пациентам старше года с мутациями в гене PAH, которые ассоциированы с чувствительностью к BH4
|
Да/Нет
|
|
5.
|
Выполнено в процессе комплексного определения концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии определение соотношения фенилаланина/тирозина пациентам с ГФА
|
Да/Нет
|
|
6.
|
Назначена/скорректирована диетотерапия с использованием низкобелковых продуктов питания пациентам с концентрацией фенилаланина в крови >= 360 мкмоль/л
|
Да/Нет
|
|
7.
|
Проведена/скорректирована терапия сапроптерином пациентам с BH4-дефицитной и с ФАГ-дефицитной гиперфенилаланинемией, чувствительной к сапроптерину
|
Да/Нет
|
|
8.
|
Назначены специализированные продукты лечебного питания (без содержания фенилаланина)
|
Да/Нет
|
Список литературы
1. Thomason MJ, Lord J, Bain MD, et al. A systematic review of evidence for the appropriateness of neonatal screening programmes for inborn errors of metabolism. J Public Health Med. 1998; 20(3): 331 - 343. doi: 10.1093/oxfordjournals.pubmed.a024777.
2. Regier DS, Greene CL. Phenylalanine Hydroxylase Deficiency. 2000 Jan 10 [Updated 2017 Jan 5]. In: Adam MP, Everman DB, Mirzaa GM, et al., editors. GeneReviews(R) [Internet]. Seattle (WA): University of Washington, Seattle; 1993 - 2022. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1504/.
3. van Spronsen FJ, van Wegberg AM, Ahring K, et al. Key European guidelines for the diagnosis and management of patients with phenylketonuria. Lancet Diabetes Endocrinol. 2017; 5(9): 743 - 756. doi: 10.1016/S2213-8587(16)30320-5.
4. Vockley J, Andersson HC, Antshel KM, et al. Phenylalanine hydroxylase deficiency: diagnosis and management guideline [published correction appears in Genet Med. 2014 Apr; 16(4): 356]. Genet Med. 2014; 16(2): 188 - 200. doi: 10.1038/gim.2013.157.
5. Blau N,  A, Demirkol M, et al. Management of phenylketonuria in Europe: survey results from 19 countries. Mol Genet Metab. 2010; 99(2): 109 - 115. doi: 10.1016/j.ymgme.2009.09.005.
A, Demirkol M, et al. Management of phenylketonuria in Europe: survey results from 19 countries. Mol Genet Metab. 2010; 99(2): 109 - 115. doi: 10.1016/j.ymgme.2009.09.005.
6. Blau N, Hennermann JB, Langenbeck U, Lichter-Konecki U. Diagnosis, classification, and genetics of phenylketonuria and tetrahydrobiopterin (BH4) deficiencies. Mol Genet Metab. 2011; 104 Suppl: S2 - S9. doi: 10.1016/j.ymgme.2011.08.017.
7. Blau N, Shen N, Carducci C. Molecular genetics and diagnosis of phenylketonuria: state of the art. Expert Rev Mol Diagn. 2014; 14(6): 655 - 671. doi: 10.1586/14737159.2014.923760.
8. Gundorova P, Stepanova AA, Kuznetsova IA, Kutsev SI, Polyakov AV. Genotypes of 2579 patients with phenylketonuria reveal a high rate of BH4 non-responders in Russia. PLoS One. 2019; 14(1): e0211048. Published 2019 Jan 22. doi: 10.1371/journal.pone.0211048.
9. Trujillano D, Perez B,  J, et al. Accurate molecular diagnosis of phenylketonuria and tetrahydrobiopterin-deficient hyperphenylalaninemias using high-throughput targeted sequencing. Eur J Hum Genet. 2014; 22(4): 528 - 534. doi: 10.1038/ejhg.2013.175.
J, et al. Accurate molecular diagnosis of phenylketonuria and tetrahydrobiopterin-deficient hyperphenylalaninemias using high-throughput targeted sequencing. Eur J Hum Genet. 2014; 22(4): 528 - 534. doi: 10.1038/ejhg.2013.175.
10. Kuznetcova I., Gundorova P., Ryzhkova O., Polyakov A. The study of the full spectrum of variants leading to hyperphenylalaninemia have revealed 10 new variants in the PAH gene//Metab Brain Dis. 2019. doi: 10.1007/s11011-019-00461-w.
11. Guldberg P, Rey F, Zschocke J, et al. A European multicenter study of phenylalanine hydroxylase deficiency: classification of 105 mutations and a general system for genotype-based prediction of metabolic phenotype [published correction appears in Am J Hum Genet 1998 Oct; 63(4): 1252 - 3]. Am J Hum Genet. 1998; 63(1): 71 - 79. doi: 10.1086/301920.
12. Danecka MK, Woidy M, Zschocke J, Feillet F, Muntau AC, Gersting SW. Mapping the functional landscape of frequent phenylalanine hydroxylase (PAH) genotypes promotes personalised medicine in phenylketonuria. J Med Genet. 2015; 52(3): 175 - 185. doi:10.1136/jmedgenet-2014-102621.
13. Wettstein S, Underhaug J, Perez B, et al. Linking genotypes database with locus-specific database and genotype-phenotype correlation in phenylketonuria. Eur J Hum Genet. 2015; 23(3): 302 - 309. doi: 10.1038/ejhg.2014.114.
14. Hawks Z, Hood AM, Lerman-Sinkoff DB, et al. White and gray matter brain development in children and young adults with phenylketonuria. Neuroimage Clin. 2019; 23: 101916. doi: 10.1016/j.nicl.2019.101916.
15. Feillet F, van Spronsen FJ, MacDonald A, et al. Challenges and pitfalls in the management of phenylketonuria. Pediatrics. 2010; 126(2): 333 - 341. doi: 10.1542/peds.2009-3584.
16. van Wegberg AMJ, MacDonald A, Ahring K, et al. The complete European guidelines on phenylketonuria: diagnosis and treatment. Orphanet J Rare Dis. 2017; 12(1): 162. Published 2017 Oct 12. doi: 10.1186/s13023-017-0685-2.
17. Blau N., van Spronsen F.J., Levy H.L. Phenylketonuria//Lancet. 2010. V. 376. N 9750. P. 1417 - 27.
18. Smith I., Beasley M.G., Ades A.E. Intelligence and quality of dietary treatment in phenylketonuria//Arch Dis Child. 1990. V. 65. N 5. P. 472 - 478.
19. Singh R.H., Cunningham A.C., Mofidi S., Douglas T.D. et al. Updated, web-based nutrition management guideline for PKU: An evidence and consensus based approach//Mol Genet Metab. 2016. V. 118. N 2. P. 72 - 83.
20. Singh R.H., Rohr F., Frazier D. Cunningham, A., Mofidi, S., Ogata, B., Van Calcar, S. C Recommendations for the nutrition management of phenylalanine hydroxylase deficiency//Genet Med. 2014. 16(2), 121 - 131 doi: 10.1038/gim.2013.179
21. Pinto A., Adams S., Ahring K., Allen H. et al. Weaning practices in phenylketonuria vary between health professionals in Europe. Mol Genet Metab Rep. 2018. V. 18. P. 39 - 44.
22. Rocha J.C., MacDonald A. Dietary intervention in the management of phenylketonuria: current perspectives//Pediatric Health Med. Therap. 2016. V. 7. P. 155 - 63.
23. Бушуева Т.В., Боровик Т.Э., Фисенко А.П. и др. Информационные материалы. Специализированные продукты лечебного питания для детей с фенилкетонурией//Москва. 2018 г. 127 с.
24. Aguiar A., Ahring K., Almeida M.F. et al. Practices in prescribing protein substitutes for PKU in Europe: no uniformity of approach Molecular Genetics and Metabolism. 2015. V. 115. N. P. 17 - 22.
25. van Spronsen F.J., van Rijn M., van Dijk T., Smit G.P. et al. Plasma phenylalanine and tyrosine responses to different nutritional conditions (fasting/postprandial) in patients with phenylketonuria: effect of sample timing//Pediatrics. 1993. V. 92. V. 4. P. 570 - 3.
26. Feillet F., Muntau A.C., Debray F.G., Lotz-Havla A.S. et al. Use of sapropterin dihydrochloride in maternal phenylketonuria. A European experience of eight cases//J. Inherit. Metab. Dis. 2014. V. 37. P. 753 - 62.
27. Muntau A.C., du Moulin M., Feillet F. Diagnostic and therapeutic recommendations for the treatment of hyperphenylalaninemia in patients 0 - 4 years of age//Orphanet J Rare Dis. 2018. V. 13. N 1. P. 173. doi: 10.1186/s13023-018-0911-6.
28. Muntau A.C., Adams D.J.,  A., Bushueva T.V. et al International best practice for the evaluation of responsiveness to sapropterin dihydrochloride in patients with phenylketonuria//Molecular Genetics and Metabolism. 2019. V. 127. N 1. P.: 1 - 11.
A., Bushueva T.V. et al International best practice for the evaluation of responsiveness to sapropterin dihydrochloride in patients with phenylketonuria//Molecular Genetics and Metabolism. 2019. V. 127. N 1. P.: 1 - 11.
29. Channon S., Goodman G., Zlotowitz S. et al. Effects of dietary management of phenylketonuria on long-term cognitive outcome//Arch Dis Child. 2007. V. 92. N 3. P. 213 - 18.
30. ten Hoedt A.E., de Sonneville L.M., Francois B. et al. High phenylalanine levels directly affect mood and sustained attention in adults with phenylketonuria: a randomised, double-blind, placebo-controlled, crossover trial//J Inherit Metab Dis. 2011. V. 34. N 1. P. 165 - 71.
31. Pode-Shakked B., Shemer-Meiri L., Harmelin A. et al. Man made disease: clinical manifestations of low phenylalanine levels in an nadequately treated phenylketonuria patient and mouse study//Mol Genet Metab. 2013. V. 110. Suppl: S66 - 70.
32. Lord J., Thomason M.J., Littlejohns P., Chalmers R.A. et al. Secondary analysis of economic data: a review of cost-benefit studies of neonatal screening for phenylketonuria//J Epidemiol Community Health. 1999. V. 53. N 3. P. 179 - 86.
33. Blau N., Burton B.K.,  B. et al. Phenylketonuria and BH4 Deficiencies//1st edition-Bremen:UNI-MED. 2010. 94P
B. et al. Phenylketonuria and BH4 Deficiencies//1st edition-Bremen:UNI-MED. 2010. 94P
34. Dhondt J.L. Strategy for the screening of tetrahydrobiopterin deficiency among hyperphenylalaninaemic patients: 15-years' experience//J Inherit Metab Dis. 1991. V. 14. N 2. P. 117 - 27.
35. Opladen T., Hoffmann G.F., Blau N. An international survey of patients with tetrahydrobiopterin deficiencies presenting with hyperphenylalaninaemia//J Inherit Metab Dis. 2012. V. 35. N 6. P. 963 - 73.
36. Fonnesbeck C.J., McPheeters M.L., Krishnaswami S. et al. Estimating the probability of IQ impairment from blood phenylalanine for phenylketonuria patients: a hierarchical meta-analysis//J Inherit Metab Dis. 2013. V. 36. N 5. P. 757 - 66.
37. Waisbren S.E., Noel K., Fahrbach K. et al. Phenylalanine blood levels and clinical outcomes in phenylketonuria: a systematic literature review and meta-analysis//Mol Genet Metab. 2007. V. 92. N 1 - 2. P. 63 - 70.
38. Regnault A., Burlina A., Cunningham A. et al. Development and psychometric validation of measures to assess the impact of phenylketonuria and its dietary treatment on patients" and parents" quality of life: the phenylketonuria - quality of life (PKU-QOL) questionnaires//Orphanet J Rare Dis. 2015. V. 10. N 1. P. 59.
39. Bosch A.M., Burlina A., Cunningham A. et al. Assessment of the impact of phenylketonuria and its treatment on quality of life of patients and parents from seven European countries//Orphanet J Rare Dis. 2015. V. 10. N 1. P. 80.
40. Albrecht J., Garbade S.F., Burgard P. Neuropsychological speed tests and blood phenylalanine levels in patients with phenylketonuria: a metaanalysis//Neurosci Biobehav Rev. 2009. V. 33. N 3. P. 414 - 21.
41. Weglage J., Fromm J., van Teeffelen-Heithoff A. et al. Neurocognitive functioning in adults with phenylketonuria: results of a long term study//Mol Genet Metab. 2013. V. 110. Suppl: S44 - S48.
42. Berlin C.M. L.H., Hanley W.B. Delayed increase in blood phenylalanine concentration in phenylketonuric children initially classified as mild hyperphenylalaninemia. 1995. V. 4. P. 35 - 9.
43. Schulze A., Mayatepek E., Hoffmann G.F. Evaluation of 6-year application of the enzymatic colorimetric phenylalanine assay in the setting of neonatal screening for phenylketonuria//Clin Chim Acta. 2002. V. 317. N 1 - 2. P. 27 - 37.
44. Bodley JL, Austin VJ, Hanley WB, Clarke JT, Zlotkin S. Low iron stores in infants and children with treated phenylketonuria: a population at risk for iron-deficiency anaemia and associated cognitive deficits. Eur J Pediatr. 1993; 152(2): 140 - 143. doi: 10.1007/BF02072491.
45. Приказ Министерства здравоохранения РФ от 9 ноября 2012 г. N 737н "Об утверждении стандарта специализированной медицинской помощи детям при классической фенилкетонурии".
46. Evans S., Daly A., MacDonald J. et al. The micronutrient status of patients with phenylketonuria on dietary treatment: an ongoing challenge//Ann Nutr Metab. 2014. V. 65. N 1. P. 42 - 8.
47. Robert M., Rocha J.C., van Rijn M. et al. Micronutrient status in phenylketonuria//Mol Genet Metab. 2013. V. 110. Suppl: S6 - 17.
48. Demirdas S., Coakley K.E., Bisschop P.H. et al. Bone health in phenylketonuria: a systematic review and meta-analysis//Orphanet J Rare Dis. 2015. V. 10. P. 17.
49. Wiig I., Motzfeldt K., Loken E.B., Kase B.F. Nutritional consequences of adhering to a low phenylalanine diet for late-treated adults with PKU: low Phe diet for adults with PKU//JIMD Rep. 2013. V. 7. P. 109 - 16.
50. Hansen K.E., Ney D. A systematic review of bone mineral density and fractures in phenylketonuria//J Inherit Metab Dis. 2014. V. 37. N 6. P. 875 - 80.
51. Anjema K., van Rijn M., Verkerk P.H. et al. PKU: high plasma phenylalanine concentrations are associated with increased prevalence of mood swings//Mol Genet Metab. 2011. V. 104. N 3. P. 231 - 4.
52. Голихина Т.А., Люманова Э.Р. Психологический статус личности детей фенилкетонурией, получающих диетотерапию с раннего возраста//Кубанский научный медицинский вестник. 2011. Т. 8. N 122. С. 50 - 3.
53. Pintoa A., Adamsb S., Ahringc K., Allend H. et al. Weaning practices in phenylketonuria vary between health professionals in Europe//Molecular Genetics and Metabolism Reports. 2019. V. 18. P. 39 - 44.
54. Grange D.K., Hillman R.E., Burton B.K. et al. Sapropterin dihydrochloride use in pregnant women with phenylketonuria: an interim report of the PKU MOMS sub-registry//Mol. Genet. Metab. 2014. 112. P. 9 - 16.
55. Абрамов, Д.Д., Кадочникова, В.В., Якимова, Е.Г., Белоусова и др. Высокая частота носительства в российской популяции мутации гена CFTR, ассоциированных с муковисцидозом, и мутации гена PAH, ассоциированных с фенилкетонурией//Вестник РГМУ. 2015. N 4. С. 32 - 35.
56. Бочков Н.П. Клиническая генетика Учебник. - 2-е изд., перераб. и доп. - М.: ГЭОТАР-МЕД, 2001. - 448 с.: ил.
57. Brumm VL, Grant ML. The role of intelligence in phenylketonuria: a review of research and management//Mol Genet Metab. 2010; 99 Suppl 1: S18 - 21
58. Moyle JJ, Fox AM, Arthur M, Bynevelt M, Burnett JR. Meta-analysis of neuropsychological symptoms of adolescents and adults with PKU//Neuropsychol Rev. 2007; 17: 91 - 101.
59. Bilder DA, Burton BK, Coon H, Leviton L, Ashworth J, Lundy BD, Vespa H, Bakian AV, Longo N. Psychiatric symptoms in adults with phenylketonuria//Mol Genet Metab. 2013; 108: 155 - 60.
60. Camp KM, Parisi MA, Acosta PB, Berry GT et al. Phenylketonuria Scientific Review Conference: state of the science and future research needs//Mol Genet Metab. 2014; 112: 87 - 122.
61. Modan-Moses D, Vered I, Schwartz G, Anikster Y, Abraham S, Segev R, Efrati O. Peak bone mass in patients with phenylketonuria//J Inherit Metab Dis. 2007; 30: 202 - 8.
62. Coakley KE, Douglas TD, Goodman M, Ramakrishnan U, Dobrowolski SF, Singh RH. Modeling correlates of low bone mineral density in patients with phenylalanine hydroxylase deficiency//J Inherit Metab Dis. 2016; 39: 363 - 72.
63. Robinson M, White FJ, Cleary MA, Wraith E, Lam WK, Walter JH. Increased risk of vitamin B12 deficiency in patients with phenylketonuria on an unrestricted or relaxed diet//J Pediatr. 2000; 136: 545 - 7.
64. Steinberger D., Blau N., Goriuonov D. et al. Heterozygous mutation in 5"-untranslated region of sepiapterin reductase gene (SPR) in a patient with dopa-responsive dystonia//Neurogenetics. - 2004. - V. 5 - P. 187 - 190
65. Blau N., Martinez A., Hoffmann G. F., Thony B. DNAJC12 deficiency: a new strategy in the diagnosis of hyperphenylalaninemias//Molec. Genet. Metab. 123: 1 - 5, 2018.
66. Волгина С.Я., Яфарова С.Ш., Клетенкова Г.Р. Фенилкетонурия у детей: современные аспекты патогенеза, клинических проявлений, лечения//Рос вестн перинатол и педиатр. 2017; 62: (5): 111 - 118.
67. Бушуева Т.В., Боровик Т.Э., Ладодо К.С. и др. Оценка физического развития у детей с классической фенилкетонурией. Вопр пит 2015; 84 (2): 34 - 43.
68. Coakley K.E., Felner E.I., Tangpricha V. et al. Impact of Dietary Intake on Bone Turnover in Patients with Phenylalanine Hydroxylase Deficiency//JIMDRep 2017. DOI: 10.1007/8904_2016_39
69. Бушуева Т.В., Винярская И.В., Черников В.В. и др. Оценка качества жизни детей, больных фенилкетонурией//Вестник Российской академии медицинских наук 2014; 11 - 12: 39 - 45.
70. Николаева Е.А., Яблонская М.И., Харабадзе М.Н. и др. Диагностика и лечение биоптериндефицитной гиперфенилаланинемии//Российский вестник перинатологии и педиатрии. 2015; 60(2): 66 - 71
71. Ford S., O"Driscoll M., MacDonald A. Living with Phenylketonuria: Lessons from the PKU community. Mol Genet Metab Rep. 2018; 17: 57 - 63. Published 2018 Oct 18. doi: 10.1016/j.ymgmr.2018.10.002
72. A. Pinto, M.F. Almeida, A. Cunha, C. Carmona, S. Rocha, et al. Dietary management of maternal phenylketonuria with glycomacropeptide and amino acids supplements: A case report//Molecular Genetics and Metabolism Reports. Volume 13, December 2017, Pages 105 - 110. doi: 10.1016/j.ymgmr.2017.10.004
73. Sween L. K., Althouse A.D., Roberts J.M. Early-pregnancy percent body fat in relation to preeclampsia risk in obese women. American Journal of Obstetrics & Gynecology. 2015; 212(1): 84.e1 - 84.e7. doi: 10.1016/j.ajog.2014.07.055.
74. Levy H.L., Guldberg P., Guttler F. et al. congenital heart disease in maternal phenylketonuria: report from the maternal PKU collaborative study//Pediatr Res. 2001; 49(5): 636 - 642.
75. Antenor-Dorsey J.A., Hershey T., Rutlin J. et al. White matter integrity and executive abilities in individuals with phenylketonuria//Mol Genet Metab. 2013; 109(2): 125 - 131.
76. White D.A., Connor L.T., Nardos B. et al. Age-related decline in the microstructural integrity of white matter in children with early- and continuously-treated PKU: a DTI study of the corpus callosum//Mol Genet Metab. 2010; 99(Suppl 1): S41 - S46
77. Jahja R., Huijbregts S.C., de Sonneville L.M. et al. Mental health and social functioning in early treated Phenylketonuria: the PKU-COBESO study//Mol Genet Metab. 2013; 110 Suppl: S57 - 61
78. Joshua Arbesman, Sairekha Ravichandran, Pauline Funchain, Cheryl L. Thompson. Melanoma cases demonstrate increased carrier frequency of Phenylketonuria/hyperphenylalanemia mutations//Pigment Cell Melanoma Res. 2018 Jul; 31(4): 529 - 533. doi: 10.1111/pcmr.12695
79. Witalis E., Mikoluc B., Motkowski R. et al. Phenylketonuria patients" and their parents" knowledge and attitudes to the daily diet - multi-centre study//Nutr Metab (Lond). 2017; 14: 57. Published 2017 Aug 17. doi: 10.1186/s12986-017-0207-1
80. Bernstein L.E., Helm J.R., Rocha J.C. et al. Nutrition education tools used in phenylketonuria: clinician, parent and patient perspectives from three international surveys//J Hum Nutr Diet. 2014; 27(Suppl 2): 4 - 11
81. Durham-Shearer S.J., Judd P.A., Whelan K., Thomas J.E. Knowledge, compliance and serum phenylalanine concentrations in adolescents and adults with phenylketonuria and the effect of a patient-focused educational resource//J Hum Nutr Diet. 2008; 21(5): 474 - 485
82. Bekhof J., van Spronsen F.J., Crone M.R. et al. Influence of knowledge of the disease on metabolic control in phenylketonuria//Eur J Pediatr. 2003; 162(6): 440 - 442
83. Aline Azabdaftari, Markus van der Giet, Mirjam Schuchardt, Julia B Hennermann, Ursula  , Uwe Querfeld The Cardiovascular Phenotype of Adult Patients With Phenylketonuria Orphanet J Rare Dis. 2019 Sep 6; 14(1): 213. doi: 10.1186/s13023-019-1188-0
, Uwe Querfeld The Cardiovascular Phenotype of Adult Patients With Phenylketonuria Orphanet J Rare Dis. 2019 Sep 6; 14(1): 213. doi: 10.1186/s13023-019-1188-0
84. Rocha J.C., Macdonald A., Trefz F. Is overweight an issue in phenylketonuria?//Mol. Genet. Metab. 2013; 110: S18 - S24.
85. Doulgeraki A., Skarpalezou A., Theodosiadou A. et al. Body composition profile of young patients with phenylketonuria and mild hyperphenylalaninemia//Int. J. Endocrinol. Metab. 2014; 12: e16061
86. Priscila Nicolao Mazzola, Bruno Costa Teixeira, Gabriel Henrique Schirmbeck, et al Acute exercise in treated phenylketonuria patients: Physical activity and biochemical response//Mol Genet Metab Rep. 2015 Dec; 5: 55 - 59. Published online 2015 Oct 22. doi: 10.1016/j.ymgmr.2015.10.003
87. Opladen T,  E,
E,  E, et al. Consensus guideline for the diagnosis and treatment of tetrahydrobiopterin (BH4) deficiencies [published correction appears in Orphanet J Rare Dis. 2020 Aug 5; 15(1): 202]. Orphanet J Rare Dis. 2020; 15(1): 126. Published 2020 May 26. doi: 10.1186/s13023-020-01379-8.
E, et al. Consensus guideline for the diagnosis and treatment of tetrahydrobiopterin (BH4) deficiencies [published correction appears in Orphanet J Rare Dis. 2020 Aug 5; 15(1): 202]. Orphanet J Rare Dis. 2020; 15(1): 126. Published 2020 May 26. doi: 10.1186/s13023-020-01379-8.
88. Mancini P.C., Durrant J.D., Starling A.L.,  MC. Children with phenylketonuria treated early: basic audiological and electrophysiological evaluation//Ear Hear. 2013; 34(2): 236 - 244. doi: 10.1097/AUD.0b013e31826a1c99
MC. Children with phenylketonuria treated early: basic audiological and electrophysiological evaluation//Ear Hear. 2013; 34(2): 236 - 244. doi: 10.1097/AUD.0b013e31826a1c99
89. Бушуева Т.В., Боровик Т.Э., Фисенко А.П. и др. Специализированные продукты лечебного питания для детей с фенилкетонурией//Москва, 2018. (4-е издание переработанное и дополненное) 128 с.
90. F. J. van Spronsen, A.  . Outcomes of Phenylketonuria with Relevance to Follow-Up//JIMD Rep. 2011; 1: 49 - 55
. Outcomes of Phenylketonuria with Relevance to Follow-Up//JIMD Rep. 2011; 1: 49 - 55
91. Guida M, Pesaresi I, Fabbri S, Sartucci F, Cosottini M, Giorgi FS. Epilepsy and phenylketonuria: a case description and EEG-fMRI findings. Funct Neurol. 2014; 29(1): 75 - 79.
92. Julia B. Hennermann, Sylvia Roloff, Jutta Gellermann et al. Chronic kidney disease in adolescent and adult patients with phenylketonuria//J Inherit Metab Dis. 2013 Sep; 36(5): 747 - 56.
93. Robin A Williams, Cyril DS Mamotte, John R Burnett. Phenylketonuria: An Inborn Error of Phenylalanine Metabolism//Clin Biochem Rev. 2008 Feb; 29(1): 31 - 41
94. Scala I., Concolino D., Casa R.D. et al. Long-term follow-up of patients with phenylketonuria treated with tetrahydrobiopterin: a seven years' experience//Orphanet J Rare Dis 10, 14 (2015). https://doi.org/10.1186/s13023-015-0227-8
95. A. M. Das, K. Goedecke, U. Meyer, N. et al. Dietary Habits and Metabolic Control in Adolescents and Young Adults with Phenylketonuria: Self-Imposed Protein Restriction May Be Harmful//JIMD Rep. 2014; 13: 149 - 158.
96. Hofman D.L., Champ C.L., Lawton C.L. et al. A systematic review of cognitive functioning in early treated adults with phenylketonuria//Orphanet J Rare Dis. 2018; 13(1): 150. Published 2018 Aug 30. doi: 10.1186/s13023-018-0893-4
97. Qu J., Yang T., Wang E. et al. Efficacy and safety of sapropterin dihydrochloride in patients with phenylketonuria: A meta-analysis of randomized controlled trials//Br J Clin Pharmacol. 2019; 85(5): 893 - 899. doi: 10.1111/bcp.13886
98. Somaraju U.R., Merrin M. Sapropterin dihydrochloride for phenylketonuria. Cochrane Database Syst Rev. 2015; 2015(3): CD008005. Published 2015 Mar 27. doi: 10.1002/14651858.CD008005.pub4
99. Trefz K. F., Muntau A. C., Kohlscheen K. M., Altevers J. et al. Clinical burden of illness in patients with phenylketonuria (PKU) and associated comorbidities - a retrospective study of German health insurance claims data//Orphanet J Rare Dis. 2019; 14: 181. doi: 10.1186/s13023-019-1153-y
100. Голихина Т.А. Фенилкетонурия у детей в Краснодарском крае (клинико-эпидемиологическое исследование) Автореф. дисс. к.м.н. 2004 г. 24 с.
101. Burlina AP, Cazzorla C, Massa P, Polo G, Loro C, Gueraldi D, Burlina AB. Large Neutral Amino Acid Therapy Increases Tyrosine Levels in Adult Patients with Phenylketonuria: A Long-Term Study. Nutrients. 2019 Oct 21; 11(10): 2541
102. Sharman R, Sullivan K, Young R, McGill J. A preliminary investigation of the role of the phenylalanine: tyrosine ratio in children with early and continuously treated phenylketonuria: toward identification of "safe" levels. Dev Neuropsychol. 2010; 35(1): 57 - 65
103. Ashe K, Kelso W, Farrand S, Panetta J, Fazio T, De Jong G, Walterfang M. Psychiatric and Cognitive Aspects of Phenylketonuria: The Limitations of Diet and Promise of New Treatments. Front Psychiatry. 2019 Sep 10; 10: 561
104. Greeves LG, Thomas PS, Carson DJ. Radiological assessment of the hand and wrist in phenylketonuria and hyperphenylalaninaemia. Pediatr Radiol. 1995; 25(5): 353 - 5
105. Peng H, Peck D, White DA, Christ SE. Tract-based evaluation of white matter damage in individuals with early-treated phenylketonuria. J Inherit Metab Dis. 2014; 37(2): 237 - 243.
106. Levy HL. Historical background for the maternal PKU syndrome. Pediatrics. 2003; 112 (6 pt 2): 1516 - 1518
107. Brown AS, Fernhoff PM, Waisbren SE, et al. Barriers to successful dietary control among pregnant women with phenylketonuria. Genet Med. 2002; 4 (2): 84 - 89
108. Wang L, Yu WM, He C, Chang M, Shen M, Zhou Z, Zhang Z, Shen S, Liu TT, Hsiao KJ. Long-term outcome and neuroradiological findings of 31 patients with 6-pyruvoyltetrahydropterin synthase deficiency. J Inherit Metab Dis. 2006 Feb; 29(1): 127 - 34. doi: 10.1007/s10545-006-0080-y. PMID: 16601879.
109. Hennermann JB, Roloff S, Gellermann J, et al. chronic kidney disease in adolescent and adult patients with phenylketonuria. J Inherit Metab Dis. 2013; 36(5): 747 - 756. doi: 10.1007/s10545-012-9548-0.
110. Яфарова С.Ш., Шавалиев Р.Ф., Волгина С.Я. Профилактика фенилкетонурии как пример системы превентивных мероприятий при орфанных заболеваниях//Рос вестн перинатол и педиат. 2017. N 5.
111. Huemer M,  M, Bodamer OA,
M, Bodamer OA,  A, Herle M, Weigmann C, Ulmer H,
A, Herle M, Weigmann C, Ulmer H,  S,
S,  D. Total homocysteine, B-vitamins and genetic polymorphisms in patients with classical phenylketonuria. Mol Genet Metab. 2008 May; 94(1): 46 - 51. doi: 10.1016/j.ymgme.2007.12.001. Epub 2008 Jan 14. PMID: 18249021.
D. Total homocysteine, B-vitamins and genetic polymorphisms in patients with classical phenylketonuria. Mol Genet Metab. 2008 May; 94(1): 46 - 51. doi: 10.1016/j.ymgme.2007.12.001. Epub 2008 Jan 14. PMID: 18249021.
112. Verduci E, Banderali G, Moretti F, Lassandro C, Cefalo G, Radaelli G, Salvatici E, Giovannini M. Diet in children with phenylketonuria and risk of cardiovascular disease: A narrative overview. Nutr Metab Cardiovasc Dis. 2016 Mar; 26(3): 171 - 7. doi: 10.1016/j.numecd.2015.10.005. Epub 2015 Nov 3. PMID: 26708644.
113. Ugarte M, Maties M, Ugarte JL. The offspring of a phenylketonuric couple. J Ment Defic Res. 1980 Jun; 24(2): 119 - 27. doi: 10.1111/j.1365-2788.1980.tb00065.x. PMID: 7411596.
114. Levy H. L. et al. Fetal ultrasonography in maternal PKU//Prenatal diagnosis. - 1996. - Т. 16. - N. 7. - С. 599 - 604.
115. Koch R et al Neuvropatologia of a 4 mounth old infant born to a women with PKU Dev.Mtd.Child Nevrol., 2008
116. Zeibe W.L, Matternial PKU syndrome/Pediatr.Res., 2018
117. Waisbren SE Chang P Neonatal nevrological assesment of offspring in maternial PKU/J.inherit Metabolizm dis, 1998
118. Waisbren SE, Azeu. Cognitive and behavioral development in matternial PKU, Pediatrics, 2003
119. Arnold GL, Kirby R, Preston C, Blakely E. Iron and protein sufficiency and red cell indices in phenylketonuria. J Am Coll Nutr. 2001; 20(1): 65 - 70. doi: 10.1080/07315724.2001.10719016.
120. Ordooei M, Malekzadeh G, Hashemi A, Forat Yazdi M Anemia in Patients with Phenylketonuria in Yazd. Iranian Journal of Pediatric Hematology Oncology Vol 2. No 2. 72 - 7.
121. Montoya Parra GA, Singh RH, Cetinyurek-Yavuz A, Kuhn M, MacDonald A. Status of nutrients important in brain function in phenylketonuria: a systematic review and meta-analysis. Orphanet J Rare Dis. 2018 Jun 26; 13(1): 101.
122. 122. Lucock M, Yates Z, Hall K, Leeming R, Rylance G, MacDonald A, Green A. The impact of phenylketonuria on folate metabolism. Mol Genet Metab. 2002 Aug; 76(4): 305 - 12
123. Levy HL. Phenylketonuria--1986. Pediatr Rev. 1986 Mar; 7(9): 269 - 75, https://emedicine.medscape.com/article/949470-medication#showall
124. Irons M, Levy HL, O"Flynn ME, Stack CV, Langlais PJ, Butler IJ, Milstien S, Kaufman S. Folinic acid therapy in treatment of dihydropteridine reductase deficiency. J Pediatr. 1987 Jan; 110(1): 61 - 7
125. Schneider A. J. Newborn Phenylalanine/Tyrosine Metabolism: Implications for Screening for Phenylketonuria//American Journal of Diseases of Children. - 1983. - Т. 137. - N. 5. - С. 427 - 432.
126. Shannon G. D. et al. Preconception healthcare and congenital disorders: systematic review of the effectiveness of preconception care programs in the prevention of congenital disorders//Maternal and child health journal. - 2014. - Т. 18. - N. 6. - С. 1354 - 1379.
127. Jahja R. et al. Social-cognitive functioning and social skills in patients with early treated phenylketonuria: a PKU-COBESO study//Journal of Inherited Metabolic Disease. - 2016. - Т. 39. - N. 3. - С. 355 - 362.
128. Koch R. et al. The maternal phenylketonuria international study: 1984 - 2002//Pediatrics. - 2003. - Т. 112. - N. Supplement 4. - С. 1523 - 1529.
129. Brantley K. D., Douglas T. D., Singh R. H. One-year follow-up of B vitamin and Iron status in patients with phenylketonuria provided tetrahydrobiopterin (BH4)//Orphanet journal of rare diseases. - 2018. - Т. 13. - N. 1. - С. 1 - 10.
130. Celik S. Y. et al. Clinical and electrophysiological findings in patients with phenylketonuria and epilepsy: Reflex features//Epilepsy & Behavior. - 2018. - Т. 82. - С. 46 - 51.
131. Открытое несравнительное клиническое исследование III фазы по оценке частоты ответа и безопасности сапроптерина у пациентов с фенилкетонурией и гиперфенилаланинемией/Т.В. Бушуева, Л.М. Кузенкова, Т.Э. Боровик [и др.]//Вестник Российской академии медицинских наук. - 2014. - Т. 69. - N 7 - 8. - С. 69 - 77. - DOI 10.15690/vramn. v69i7 - 8.1111. - EDN SNHYBV.
132. McBride KL, Pluciniczak J, Rhyand T, Bartholomew D. Phenylalanine and tyrosine measurements across gestation by tandem mass spectrometer on dried blood spot cards from normal pregnant women. Genet Med. 2019; 21(8): 1821 - 1826. doi:10.1038/s41436-018-0407-8
133. Gudinchet F, Maeder P, Meuli RA, Deonna T, Mathieu JM. Cranial CT and MRI in malignant phenylketonuria. Pediatr Radiol. 1992; 22(3): 223 - 224. doi: 10.1007/BF02012503
134. Greeves LG, Carson DJ, McMaster D, Craig BG. Cardiac status of patients with phenylketonuria. Acta Paediatr. 1994; 83(10): 1100 - 1101. doi: 10.1111/j.1651-2227. 1994.tb12995.x
135. Kose E, Arslan N. Vitamin/mineral and micronutrient status in patients with classical phenylketonuria. Clin Nutr. 2019; 38(1): 197 - 203. doi: 10.1016/j.clnu.2018.01.034
136. Lah M, Cook K, Gomes DA, et al. Real-world treatment, dosing, and discontinuation patterns among patients treated with pegvaliase for phenylketonuria: Evidence from dispensing data. Mol Genet Metab Rep. 2022; 33: 100918. Published 2022 Sep 25. doi: 10.1016/j.ymgmr.2022.100918
137.  J, Baerwald C, Heimbold C, et al. Two years of pegvaliase in Germany: Experiences and best practice recommendations. Mol Genet Metab. 2023; 139(1): 107564. doi: 10.1016/j.ymgme.2023.107564
J, Baerwald C, Heimbold C, et al. Two years of pegvaliase in Germany: Experiences and best practice recommendations. Mol Genet Metab. 2023; 139(1): 107564. doi: 10.1016/j.ymgme.2023.107564
138. Приказ Минздрава России от 21 апреля 2022 г. N 274н "Об утверждении Порядка оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями"
139. Неонатальный скрининг: национальное руководство/под ред. С.И. Куцева. Москва: ГЭОТАР-Медиа, 2023. - 360 с. - (Серия "Национальные руководства"). - DOI: 10.33029/9704-7737-3-NEO-2023-1-360
140. Ramos BCF, Aranda CS, Cardona RSB, Martins AM,  D, Clemens SAC, Clemens R. Vaccination strategies for people living with inborn errors of metabolism in Brazil. J Pediatr (Rio J). 2023 Mar - Apr; 99 Suppl 1 (Suppl 1): S70 - S80. doi: 10.1016/j.jped.2022.12.001.
D, Clemens SAC, Clemens R. Vaccination strategies for people living with inborn errors of metabolism in Brazil. J Pediatr (Rio J). 2023 Mar - Apr; 99 Suppl 1 (Suppl 1): S70 - S80. doi: 10.1016/j.jped.2022.12.001.
141. Menni F, Chiarelli G, Sabatini C, Principi N, Esposito S. Vaccination in children with inborn errors of metabolism. Vaccine. 2012 Nov 26; 30(50): 7161 - 4. doi: 10.1016/j.vaccine.2012.10.012.
142. Robin B. Kirby, Maternal Phenylketonuria: A New Cause for Concern, Journal of Obstetric, Gynecologic & Neonatal Nursing, Volume 28, Issue 3, 1999, Pages 227 - 234, ISSN 0884-2175, https://doi:10.1111/j.1552-6909.1999.tb01987.x.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Анисимова Инга Вадимовна - к.м.н., врач-генетик, заведующая отделом организации медицинской помощи ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков (АМГ).
2. Бакулина Елена Геннадьевна - к.м.н., заместитель главного врача АНМО "Ставропольский краевой клинический консультативно-диагностический центр", член Ассоциации медицинских генетиков (АМГ).
3. Баранов Александр Александрович - академик РАН, профессор, д.м.н., советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", профессор кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет) Почетный Президент Союза педиатров России.
4. Боровик Татьяна Эдуардовна - профессор, д.м.н., заведующая лабораторией питания здорового и больного ребенка ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков (АМГ)
5. Бушуева Татьяна Владимировна - д.м.н., главный научный сотрудник лаборатории питания здорового и больного ребенка ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков (АМГ).
6. Вафина Зульфия Ильсуровна - заведующая МГК ГАУЗ Республиканская клиническая больница МЗ республики Татарстан, член Ассоциации медицинских генетиков (АМГ).
7. Вишнева Елена Александровна - д.м.н., профессор РАН, заместитель руководителя НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского" по научной работе, профессор кафедры факультетской педиатрии педиатрического факультета ФГАОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, член Союза педиатров России
8. Голихина Татьяна Александровна - к.м.н., врач-генетик ГБУЗ "Научно-исследовательский институт - Краевая клиническая больница N 1 им. профессора С.В. Очаповского" МЗ Краснодарского края, член Ассоциации медицинских генетиков (АМГ).
9. Гундорова Полина - к.б.н., научный сотрудник лаборатории ДНК-диагностики ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова".
10. Журкова Наталия Вячеславовна - к.м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", член Союза педиатров России, член Ассоциации медицинских генетиков, член Ассоциации медицинских генетиков (АМГ).
11. Захарова Екатерина Юрьевна - д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Российского общества медицинских генетиков, член европейского общества по изучению наследственных болезней обмена веществ (SSIEM).
12. Звонкова Наталья Георгиевна - к.м.н., старший научный сотрудник лаборатории питания здорового и больного ребенка ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков (АМГ).
13. Кузенкова Людмила Михайловна - профессор, д.м.н., начальник Центра детской психоневрологии, заведующая отделением психоневрологии и психосоматической патологии ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков (АМГ).
14. Куцев Сергей Иванович - академик РАН, профессор, д.м.н., директор ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", Президент Ассоциации медицинских генетиков (АМГ).
15. Латыпов Артур Шамилевич - к.м.н., заведующий МГЦ ГБУЗ МО МОНИКИ, член Ассоциации медицинских генетиков (АМГ).
16. Лязина Лидия Викторовна - к.м.н., врач-генетик, Санкт-Петербургское государственное казенное учреждение здравоохранения "Диагностический центр (медико-генетический)", член Ассоциации медицинских генетиков (АМГ).
17. Матулевич Светлана Алексеевна - д.м.н., заведующая МГК ГБУЗ "Научно-исследовательский институт - Краевая клиническая больница N 1 им. профессора С.В. Очаповского" МЗ Краснодарского края, член Ассоциации медицинских генетиков (АМГ).
18. Назаренко Людмила Павловна - профессор, д.м.н., заместитель директора по научной и лечебной работе, руководитель лаборатории наследственной патологии НИИ медицинской генетики, Томского НИМЦ РАН, член Ассоциации медицинских генетиков
19. Намазова-Баранова Лейла Сеймуровна - академик РАН, профессор, д.м.н., руководитель НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", заведующая кафедрой факультетской педиатрии педиатрического факультета ФГАОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, Президент Союза педиатров России.
20. Никитина Наталья Викторовна - к.м.н., врач-генетик МГК ГАУЗ СО Клинико-диагностический центр "Охрана здоровья матери и ребенка", член Ассоциации медицинских генетиков
21. Николаева Екатерина Александровна - д.м.н., главный научный сотрудник отдела клинической генетики Научно-исследовательского клинического института педиатрии имени акад. Ю.Е. Вельтищева, проф. кафедры инновационной педиатрии и детской хирургии Института непрерывного образования и профессионального развития ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Ассоциации медицинских генетиков
22. Поляков Александр Владимирович - чл.-корр. РАН, профессор, д.м.н., заведующий лаборатории ДНК-диагностики ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", заведующий кафедрой молекулярной генетики и биоинформатики ИВиДПО ФГБНУ "МГНЦ" член Ассоциации медицинских генетиков
23. Пушков Александр Алексеевич - к.б.н., ведущий научный сотрудник лаборатории молекулярной генетики и клеточной биологии ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков
24. Репина Светлана Афанасьевна - к.м.н., врач-генетик отдела организации медицинской помощи ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков
25. Савостьянов Кирилл Викторович - к.б.н., начальник Центра фундаментальных исследований в педиатрии ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков
26. Сеитова Гульнара Наримановна - к.м.н., главный врач Медико-генетического центра (Генетической клиники) НИИ медицинской генетики, Томского НИМЦ РАН
27. Селимзянова Лилия Робертовна - к.м.н., заведующая отделом стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", доцент кафедры факультетской педиатрии педиатрического факультета ФГАОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, доцент кафедры педиатрии и детской ревматологии ФГАОУ ВО "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет), член Союза Педиатров России
28. Семенова Наталия Александровна - к.м.н, старший научный сотрудник научно-консультативного отдела ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков (АМГ).
29. Смирнова Ольга Яковлевна - врач-генетик, старший научный сотрудник отдела стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", член Союза педиатров России
30. Субботин Дмитрий Михайлович - врач-генетик ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков (АМГ)
31. Сумина Мария Геннадьевна - заведующий отделением медико-генетического консультирования, врач-генетик ГАУЗ Свердловской области "Клинико-диагностический центр "Охрана здоровья матери и ребенка"
32. Фисенко Андрей Петрович - профессор, д.м.н., директор ФГАУ "НМИЦ здоровья детей" Минздрава России, Президент Профессиональной общественной организации (ассоциации) детских врачей "Инициатива специалистов педиатрии и неонатологии в развитии клинических практик" по вопросам педиатрии.
33. Федотова Татьяна Валерьевна - к.м.н., заведующая МГК БУЗ ВО ВОКБ N 1, член Ассоциации медицинских генетиков (АМГ).
34. Шестопалова Елена Андреевна - к.м.н., руководитель Московского центра неонатального скрининга (медико-генетическое отделение) при Морозовской детской городской клинической больнице ДЗМ, член Ассоциации медицинских генетиков (АМГ).
Представители общественных организаций:
35. Балабанова Елена Николаевна - Президент АНО "Общество пациентов с фенилкетонурией", г. Москва
36. Башкирова Ольга Аркадьевна - Председатель Региональной Общественной Организации Республики Татарстан "Содействие больным фенилкетонурией"
37. Мареченкова Наталья Игоревна - Председатель Кемеровской Областной Общественной организации родителей детей с диагнозом фенилкетонурия
38. Свердлова Виктория Анатольевна - Председатель Новосибирской Региональной Общественной Организации инвалидов с фенилкетонурией и другими редкими заболеваниями "Формула жизни"
39. Слепцова Татьяна Алексеевна - директор Региональной общественной организации помощи людям с фенилкетонурией по Саратовской области "Вкус жизни"
40. Хакимова Матлюба Абдувахидовна - Председатель Правления Региональной общественной организации помощи людям с фенилкетонурией и другими редкими заболеваниями "ФКУ РБ" по Республике Башкортостан, руководитель направления ФКУ Всероссийского общества редких (орфанных) заболеваний.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Настоящие рекомендации предназначены для применения медицинскими организациями и учреждениями федеральных, территориальных и муниципальных органов управления здравоохранением, систем обязательного и добровольного медицинского страхования, другими медицинскими организациями различных организационно-правовых форм деятельности, направленной на оказание медицинской помощи.
Настоящие рекомендации устанавливают виды, объем и индикаторы качества медицинской помощи пациентам при фенилкетонурии и были рассмотрены 23 октября 2019 года в рамках экспертного совета в Москве.
Клинические рекомендации созданы на основании обзора литературы 1990 - 2023 гг. Medline (Pubmed version), Embase (Dialog version) и Cochrane Library databases, Orphanet и OMIM, а также Международных клинических рекомендаций по диагностике, лечению и ведению больных с метаболическими болезнями.
Были использованы интернет-данные, представленные на международных и национальных сайтах обществ редких болезней и общественных организаций. Глубина поиска составляла 20 лет
Оценка качества доказательств и силы рекомендаций применения медицинских технологий проводилась в соответствии с унифицированной шкалой, приведенной в таблицах 1 - 3.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-генетики;
2. Врачи общей врачебной практики (семейные врачи);
3. Врачи-педиатры;
4. Врачи-терапевты;
5. Врачи-диетологи;
6. Врачи-неврологи;
7. Врачи-психиатры;
8. Врачи-эндокринологи
9. Врачи - детские эндокринологи
10. Врачи-кардиологи
11. Врачи - детские кардиологи
12. Медицинские психологи;
13. Врачи - акушеры-гинекологи;
14. Врачи-неонатологи;
15. Врачи - лабораторные генетики;
16. Врачи клинической лабораторной диагностики;
17. Студенты медицинских ВУЗов;
18. Обучающиеся в ординатуре.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ОСНОВНЫЕ НОРМАТИВНО-ПРАВОВЫЕ АКТЫ
1. Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" (N 323-ФЗ от 21.11.2011).
2. Постановление Правительства РФ от 30 июля 1994 г. N 890 "О государственной поддержке развития медицинской промышленности и улучшении обеспечения населения и учреждений здравоохранения лекарственными средствами и изделиями медицинского назначения" (с изменениями и дополнениями)
3. Приказ Минздрава России от 21.04.2022 N 274н "Об утверждении Порядка оказания медицинской помощи пациентам с врожденными и (или) наследственными заболеваниями".
4. Постановление Правительства N 403 от 26.04.2012 г "О порядке ведения Федерального регистра лиц, страдающих угрожающими и хронически прогрессирующими редкими орфанными заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности и его регионального сегмента".
5. Критерии оценки качества медицинской помощи (Приказ МЗ РФ от 10 мая 2017 г. N 203н "Об утверждении критериев оценки качества медицинской помощи)".
6. Приказ Министерства здравоохранения Российской Федерации от 15 декабря 2014 г. N 834н "Об утверждении унифицированных форм медицинской документации, используемых в медицинских организациях, оказывающих медицинскую помощь в амбулаторных условиях, и порядков по их заполнению".
7. Приказ Минздрава России от 12.11.2021 N 1051н "Об утверждении Порядка дачи информированного добровольного согласия на медицинское вмешательство и отказа от медицинского вмешательства, формы информированного добровольного согласия на медицинское вмешательство и формы отказа от медицинского вмешательства" (вместе с "Порядком дачи информированного добровольного согласия на медицинское вмешательство и отказа от медицинского вмешательства в отношении определенных видов медицинских вмешательств")
8. Приказ Минздрава России от 24.11.2021 N 1094н "Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов"
9. Постановление Правительства N 333 от 09.04.2015 г "Об утверждении Правил формирования перечня специализированных продуктов лечебного питания для детей-инвалидов"
Информация о лекарственных средствах: https://grls.rosminzdrav.ru/
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи
1. Федеральный закон "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам оказания паллиативной медицинской помощи" от 06.03.2019 N 18-ФЗ.
2. Приказ Минздрава России N 345н, Минтруда России от 31.05.2019 N 372н "Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья".
3. Приказ Минздрава России N 348н от 31 мая 2019 года "Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому".
4. Приказ Минздрава России N 505н от 10 июля 2019 года "Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи".
Прочие нормативно-правовые документы, с учетом которых разработаны клинические рекомендации:
1. Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ-10);
2. Приказ Минздрава России от 02.05.2023 N 205н "Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников"
3. Приказ Минздрава России N 103н от 28.02.2019 г. "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации".
4. Приказ Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг".
5. Приказ Министерства здравоохранения и социального развития Российской Федерации "О порядке применения лекарственных средств у больных по жизненным показаниям" от 9 августа 2005 г. N 494
Приложение А3.2
ЭТИОПАТОГЕНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ГФА
|
Код OMIM
|
Название Патологии
|
Фермент
|
Ген
|
Локализация гена
|
|
261600
|
Гиперфенилаланемия ФАГ-дефицитная (ФКУ)
|
фенилаланин-гидроксилаза (РАН)
|
РАН
|
12q22q24.2
|
|
261640
|
Гиперфенилаланинемия BH4-дефицитная (тип A)
|
6-пирувоил-тетрагидроптеринсинтаза (PTPS)
|
PTS
|
11q22.3q23.3
|
|
233910
|
Гиперфенилаланинемия BH4-дефицитная (тип B)
|
гуанозин-трифосфатциклогидролаза (GTPCH)
|
GCHI
|
14q22.1q22.2
|
|
261630
|
Гиперфенилаланинемия BH4-дефицитная (тип C)
|
дигидро-птеридин-редуктаза (DHPR)
|
QDPR
|
4p15.31
|
|
264070
|
Гиперфенилаланинемия BH4-дефицитная (тип D)
|
птерин-4-альфакарбиноламиндегидратаза (PCD)
|
PCBD
|
10q22
|
|
182125
|
ДОФА-зависимая дистония BH4-дефицитная
|
сепиаптерин-редуктаза (SPR)
|
SPR
|
2p13.2
|
|
617384
|
Гиперфенилаланинемия не-BH4-дефицитная
|
J-домен-содержащий белок 1 (JDP1)
|
DNAJC12
|
10q21.3
|
--------------------------------
<*> http://www.ncbi.nlm.nih.gov/omim/?term=HPA Blau монография
Приложение А3.3
ДИАГНОСТИЧЕСКИЕ ПОКАЗАТЕЛИ
ФЕНИЛАНАНИНА И ПТЕРИНОВ В КРОВИ,
МОЧЕ И СПИННОМОЗГОВОЙ ЖИДКОСТИ
|
Показатели/фермент
|
Phe
(К)
|
Neo
(К, М)
|
Bio
(К, М)
|
Pri
(К, М)
|
Neo
(СМж)
|
Bio
(СМж)
|
SHIAA
(СМж)
|
HVA
(СМж)
|
SMTHF
(СМж)
|
активность DHPR (К)
|
|
AdGTPCH
|
N
|
N
|
N
|
N
|
 |
 |
 |
 |
N
|
N
|
|
ArGTPCH
|
 |
 |
 |
N
|
 |
 |
 |
 |
N
|
N
|
|
PTPS
|
 |
 |
 |
N
|
 |
 |
 |
 |
N
|
N
|
|
SR
|
N
|
N
|
N
|
N
|
N
|
 |
 |
 |
N
|
N
|
|
PCD
|
 |
 |
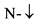 |
 |
N
|
N
|
N
|
N
|
N
|
N
|
|
DHPR
|
 |
N
|
 |
N
|
N
|
 |
 |
 |
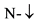 |
 |
--------------------------------
<*> AdGTPCH - аутосомно доминантный дефицит гуанозин-трифосфат-циклогидролазы I; ArGTPCH - аутосомно рецессивный дефицит гуанозин-трифосфат-циклогидролазы I, PTPS - 6-пирувоилтетрагидроптеринсинтаза, SR - сепиаптеринредуктаза, PCD - птерин-4-альфа-карбиноламиндегидратаза, DHPR - дигидроптеридинредуктаза, Phe - фенилаланин, Neo - неоптерин, Bio - биоптерин, Pri - примаптерин, SHIAA - S-гидроксииндолуксусная кислота, HVA - гомованилиновая кислота, SMTHF - 5-метитетрагидрофолат, К - кровь, М - моча, СМж - спиномозговая жидкость.
Приложение А3.4
АЛГОРИТМ
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ ПАЦИЕНТОВ С ГФА
Поиск мутаций гена PAH
Комментарий: вне зависимости от диагностической концентрации ФА, наиболее частой (98%) причиной всех ГФА являются мутации в гене PAH. Поиск мутаций гена PAH является молекулярно-генетическим исследованием, которое следует назначать в первую очередь. Исключением являются пациенты с проведенным исследованием птеринов мочи или крови, по результатам которого можно однозначно заподозрить BH4-дефицитную ГФА.
1. Поиск частых мутаций гена PAH
Исследование кодирующей последовательности гена PAH (секвенирование по Сенгеру или массовое параллельное секвенирование с последующим подтверждением результатов методом секвенирования по Сенгеру)
2. Поиск делеций и дупликаций гена PAH (метод MLPA)
Комментарий: В случае не обнаружения одной или обеих мутаций гена PAH после поиска частых мутаций (a) последовательно назначаются исследования (b), (c). Если в результате полного исследования гена PAH обе мутации не были обнаружены, следует проводить исследование генов по алгоритму ниже.
3. Поиск мутаций в генах PTS, QDPR, GCH1, PCBD1, SPR, DNAJC12
Комментарий: В случае наличия результатов биохимических исследований, подтверждающих наличие у пациента определенной формы BH4-дефицитной ГФА, можно приступить сразу к исследованию соответствующего гена. В противном случае, рекомендуется проводить исследование генов в указанной последовательности: PTS, QDPR, GCH1, PCBD1, SPR, DNAJC12 (по частоте встречаемости). В случае использования методом массового параллельного секвенирования возможно исследование вышеперечисленных генов одновременно. Необходимо отметить, что все результаты, полученные с использованием методов массового параллельного секвенирования, не могут использоваться в клинической практике без подтверждения результатов референсным методом (секвенирование по Сенгеру для точечных нуклеотидных замен), а также семейного анализа сегрегации выявленных вариантов (определение цис- или транс-положения для аутосомно-рецессивных заболеваний).
Приложение А3.5
Информированное согласие
законного представителя ребенка с ГФА о необходимости лечения
и соблюдения требований врача
Я, ________________________________________________________________________
(Ф.И.О. полностью)
являюсь законным представителем (мать, отец, усыновитель, опекун,
попечитель) ребенка или лица, признанного недееспособным
___________________________________________________________________________
(Ф.И.О. ребенка или недееспособного гражданина - полностью, год рождения)
осведомлен о необходимости соблюдения требований врача и лечения.
Мне даны полные и всесторонние сведения о характере, степени тяжести
заболевания, возможных осложнениях, включая данные о результатах
обследования, прогнозе, возможных вариантах медицинского вмешательства
(обследования, лечения), и ожидаемых результатах проводимого лечения.
Мне подробно в доступной для меня форме разъяснены возможные последствия
несоблюдения требований врача и лечения (умственная отсталость,
эпилептические приступы и др.). Я осознаю, что несоблюдение требований
врача и лечения отрицательно скажется на состоянии здоровья ребенка и даже
может привести к неблагоприятному исходу.
_________ ___________________________________________________ "_" __ 20_ г.
(подпись) (Ф.И.О. гражданина или его законного представителя)
_________ ___________________________________________ "__" _______ 20__ г.
(подпись) (Должность и Ф.И.О. медицинского работника)
Приложение А3.6
ХИМИЧЕСКИЙ СОСТАВ
И ВОЗРАСТ ПРИМЕНЕНИЯ СПЕЦИАЛИЗИРОВАННЫХ ПРОДУКТОВ
НА ОСНОВЕ АМИНОКИСЛОТ БЕЗ ФА
(в 100 г сухого продукта/100 мл готового жидкого продукта) [16, 25, 27, 31, 53]
|
Наименование продукта
|
Белок (эквивалент), г
|
Жир, г
|
Углеводы, г
|
Энергетическая ценность, ккал
|
Возраст применения
|
|
|
Специализированный сухой продукт для диетического (лечебного) питания детей первого года жизни, больных фенилкетонурией "Афенилак 13"
|
13
|
25
|
52
|
485
|
0 - 12 мес
|
|
|
Специализированный сухой продукт для диетического (лечебного) питания детей первого года жизни, больных фенилкетонурией, "Афенилак 15"****
|
15
|
23
|
51,7
|
474
|
||
|
Продукт сухой специализированный для диетического (лечебного) питания детей старше одного года, больных фенилкетонурией, "Афенилак 20"****
|
20
|
18
|
50,4
|
444
|
старше 1 года
|
|
|
Продукт сухой специализированный для диетического (лечебного) питания детей старше одного года, больных фенилкетонурией, "Афенилак 40"****
|
40
|
13,5
|
31
|
405
|
||
|
Продукт сухой специализированный для диетического (лечебного) питания детей "Нутриген 14-phe"****
|
14
|
23
|
50,4
|
471
|
0 - 12 мес
|
|
|
Специализированный продукт сухой для диетического (лечебного) питания детей старше года, больных фенилкетонурией, "Нутриген 20-phe"****
|
20
|
18
|
50,4
|
444
|
старше 1 года
|
|
|
Специализированный продукт сухой для диетического (лечебного) питания детей старше года, больных фенилкетонурией, "Нутриген 40-phe"****
|
40
|
13
|
31,4
|
403
|
||
|
Специализированный продукт сухой для диетического (лечебного) питания детей старше одного года, больных фенилкетонурией, "Нутриген 70-phe"****
|
70
|
0
|
4,5
|
298
|
старше 7 лет, взрослые, беременные женщины
|
|
|
Специализированный сухой продукт для диетического (лечебного) питания детей старше одного года, больных фенилкетонурией, "Нутриген 30"****
|
30
|
0
|
54,1
|
336
|
старше 1 года
|
|
|
Специализированный продукт сухой для диетического (лечебного) питания детей старше одного года, больных фенилкетонурией, "Нутриген 70"****
|
70
|
0
|
6,9
|
308
|
старше 7 лет, взрослые,
беременные женщины
|
|
|
Специализированный продукт сухой для диетического (лечебного) питания детей старше одного года, больных фенилкетонурией, "Нутриген 75"****
|
75
|
0
|
1,3
|
305
|
||
|
Специализированный продукт детского питания для диетического (лечебного) питания детей первого года жизни от 0 до 12 месяцев, страдающих фенилкетонурией, а также для детей старше 1 года в качестве дополнительного питания "PKU Анамикс Инфант"****
|
13,1
|
23
|
49,5
|
457
|
0 - 12 мес
|
|
|
Специализированный продукт диетического (лечебного) питания для детей старше 4 лет, больных фенилкетонурией, "PKU Лофлекс LQ Juicy Berries"****
|
100
|
16
|
0
|
7
|
394
|
старше 4 лет, взрослые, беременные женщины
|
|
62,5
|
10
|
0
|
4,4
|
246
|
||
|
Специализированный продукт диетического лечебного питания детей старше одного года, больных фенилкетонурией, "PKU Nutri Energy 2"****
|
27
|
14
|
42
|
402
|
старше 1 года
|
|
|
Специализированный продукт диетического (лечебного) питания детей старше 9 лет, больных фенилкетонурией, "PKU Nutri 3 Energy" с нейтральным вкусом****
|
35,4
|
12,6
|
44
|
387
|
старше 9 лет, взрослые, беременные женщины
|
|
|
Специализированный продукт диетического (лечебного) питания детей старше 1 года, больных фенилкетонурией и гиперфенилаланинемией, "PKU Nutri 2 Concentrated" с нейтральным вкусом****
|
60
|
0
|
10
|
280
|
старше 1 года
|
|
|
Специализированный продукт диетического (лечебного) питания детей старше 8 лет, больных фенилкетонурией и гиперфенилаланинемией, "PKU Nutri 3 Concentrated" с нейтральным вкусом ****
|
70
|
0
|
4,3
|
297
|
старше 9 лет, взрослые, беременные женщины
|
|
|
Специализированный продукт детского диетического лечебного питания для детей от 0 до 1 года, больных фенилкетонурией, "COMIDA-PKU A формула + LCP"****
|
11,8
|
27,4
|
52,6
|
506
|
0 - 12 мес
|
|
|
Специализированный продукт детского диетического лечебного питания для детей старше 1 года, больных фенилкетонурией, "COMIDA-PKU B"****
|
73
|
0,5
|
296
|
старше 1 года
|
||
|
Специализированный продукт детского диетического лечебного питания для детей старше 1 года, больных фенилкетонурией, "COMIDA-PKU B формула"****
|
31,1
|
15
|
40,6
|
424
|
||
|
Специализированный продукт детского диетического лечебного питания для детей старше 7 лет, больных фенилкетонурией, "COMIDA-PKU C"****
|
75
|
0
|
0,4
|
302
|
старше 7 лет
|
|
|
Специализированный продукт детского диетического лечебного питания для детей старше 7 лет, больных фенилкетонурией, "COMIDA-PKU C формула"****
|
45
|
0
|
38,9
|
335
|
||
|
Специализированный продукт лечебного питания для детей первого года жизни, больных фенилкетонурией, "MD мил ФКУ-0"****
|
13
|
23
|
59
|
495
|
0 - 12 мес
|
|
|
Специализированный продукт детского диетического (лечебного) питания для детей старше одного года, больных фенилкетонурией, на основе аминокислот без фенилаланина с фруктовым вкусом "MD мил ФКУ-1"****
|
20
|
0
|
73
|
372
|
старше 1 года
|
|
|
Специализированный продукт диетического (лечебного) питания для детей старше одного года, больных фенилкетонурией, с нейтральным вкусом "MD мил ФКУ-2"****
|
40
|
6,1
|
46,9
|
402
|
||
|
Специализированный продукт диетического (лечебного) питания для детей старше одного года, больных фенилкетонурией, с нейтральным вкусом "MD мил ФКУ-3"****
|
69,1
|
0
|
23
|
368
|
старше 1 года, взрослые и беременные женщины
|
|
|
Специализированный лечебный продукт на основе аминокислот без фенилаланина для детей старше одного года, больных фенилкетонурией, с нейтральным вкусом "MD мил ФКУ Премиум"****
|
69,1
|
1,9
|
23
|
385
|
||
|
Специализированный пищевой продукт диетического лечебного питания для детей старше одного года, больных фенилкетонурией, сухая максимально сбалансированная смесь заменимых и незаменимых аминокислот без фенилаланина с нейтральным вкусом "MD мил ФКУ MAXI"****
|
75
|
0
|
14
|
356
|
старше 1 года
|
|
|
Продукт сухой специализированный для диетического лечебного питания детей первого года жизни, больных фенилкетонурией, "БенАмин 13-phe"****
|
13
|
26
|
50,3
|
493
|
0 - 12 мес
|
|
|
Продукт сухой специализированный для диетического лечебного питания детей первого года жизни, больных фенилкетонурией, "БенАмин 15-phe"****
|
15
|
26
|
48
|
492
|
0 - 12 мес
|
|
|
Продукт сухой специализированный для диетического лечебного питания детей старше одного года, больных фенилкетонурией, "БенАмин 20-phe"****
|
20
|
15
|
52,8
|
431
|
старше 1 года
|
|
|
Продукт сухой специализированный для диетического лечебного питания детей старше одного года, больных фенилкетонурией, "БенАмин 40-phe"****
|
40
|
13
|
31,9
|
410
|
старше 1 года
|
|
|
Продукт сухой специализированный для диетического лечебного питания детей старше одного года, больных фенилкетонурией, "БенАмин 70-phe"****
|
70
|
0
|
5,4
|
308
|
старше 1 года, взрослые и беременные женщины
|
|
|
Продукт сухой специализированный для диетического лечебного питания детей старше одного года, больных фенилкетонурией, "БенАмин 75-phe"****
|
75
|
0
|
0,6
|
308
|
старше 1 года, взрослые и беременные женщины
|
|
|
Специализированный продукт детского диетического лечебного питания для детей старше 3 лет, больных фенилкетонурией и гиперфенилаланинемией, Mavalia PKU Motion (тропические фрукты) 70 мл (10 г белкового эквивалента) ****
|
14
|
0
|
5
|
77
|
Старше 3 лет
|
|
|
Специализированный продукт детского диетического лечебного питания для детей старше 3 лет, больных фенилкетонурией и гиперфенилаланинемией, Mavalia PKU Motion (красные фрукты) 70 мл (10 г белкового эквивалента) ****
|
14
|
0
|
5
|
77
|
Старше 3 лет
|
|
|
Специализированный продукт детского диетического лечебного питания для детей старше 3 лет, больных фенилкетонурией и гиперфенилаланинемией, Mavalia PKU Motion (тропические фрукты) и 140 мл (20 г белкового эквивалента)****
|
14
|
0
|
5
|
77
|
Старше 3 лет
|
|
|
Специализированный продукт детского диетического лечебного питания для детей старше 3 лет, больных фенилкетонурией и гиперфенилаланинемией, Mavalia PKU Motion (красные фрукты) 140 мл (20 г белкового эквивалента)****
|
14
|
0
|
5
|
77
|
Старше 3 лет
|
|
|
Специализированный продукт диетического лечебного питания для детей старше 3 лет, больных фенилкетонурией, сухая смесь на основе аминокислот без фенилаланина с нейтральным вкусом PKU express (PKU экспресс): 25 г (15 г белкового эквивалента - PKU express 15)
|
60
|
0
|
16
|
304
|
Старше 3 лет
|
|
|
Специализированный продукт диетического лечебного питания для детей старше 3 лет, больных фенилкетонурией, сухая смесь на основе аминокислот без фенилаланина с нейтральным вкусом PKU express (PKU экспресс): 34 г (20 г белкового эквивалента - PKU express 20).
|
60
|
0
|
16
|
304
|
Старше 3 лет
|
|
Приложение А3.7
СПИСОК
НИЗКОБЕЛКОВЫХ И БЕЗБЕЛКОВЫХ СПЕЦИАЛИЗИРОВАННЫХ ПРОДУКТОВ,
ЗАРЕГИСТРИРОВАННЫХ НА ТЕРРИТОРИИ РОССИЙСКОЙ ФЕДЕРАЦИИ
|
Вид продуктов низкобелковых специализированных <*>
|
Среднее количество белка в 100 г готового продукта
|
Возраст применения
|
||||
|
Мука низкобелковая для выпечки хлеба, оладий, хлебобулочных и кондитерских изделий (в виде полуфабрикатов)
|
<= 1 г
|
Старше 1 года, включая подростков, взрослых, беременных женщин с ФКУ
|
||||
|
Макаронные изделия низкобелковые в ассортименте (вермишель, макароны и др.)
|
||||||
|
Низкобелковые хлебобулочные изделия готовые (хлеб и др.)
|
||||||
|
Низкобелковые кондитерские изделия (печенье, вафли и др.)
|
||||||
|
Низкобелковые полуфабрикаты на основе крахмалов для приготовления супов, пюре, овощных котлет и других блюд.
|
||||||
|
Низкобелковые крупы (саго, рис и др.)
|
||||||
|
Низкобелковый заменитель яиц
|
||||||
|
Безбелковые сухие напитки с молочным вкусом
|
||||||
|
Содержание фенилаланина, основных пищевых веществ и энергии некоторых крахмалосодержащих низкобелковых продуктов, используемых в питании пациентов с фенилкетонурией (100 г продукта)
|
||||||
|
ФА
|
белки
|
жиры
|
углеводы
|
ккал
|
||
|
Саго искусственное
|
40
|
0,8
|
0,2
|
86,5
|
360,0
|
|
|
Макаронные изделия малобелковые
|
50
|
1,0
|
0,6
|
85,0
|
358,0
|
|
|
Крахмал картофельный
|
5,0
|
0,1
|
-
|
78,2
|
313
|
|
|
Крахмал кукурузный
|
50
|
1,0
|
0,6
|
83,5
|
343
|
|
|
Крахмал пшеничный
|
20
|
0,4
|
0,1
|
86,8
|
367,0
|
|
|
Крахмал амилопектиновый набухающий
|
50
|
1,0
|
0,6
|
85,2
|
329,0
|
|
|
Хлеб безбелковый
|
35
|
0,7
|
2,5
|
58,9
|
276,0
|
|
|
Полуфабрикат низкобелковый для приготовления блинов и оладий
|
95
|
1,9
|
1,0
|
90,5
|
417,5
|
|
|
Глюкозная помадка с фруктовыми добавками
|
30 - 100
|
0,6 - 2,0
|
0,1 - 1,0
|
71,0 - 73,0
|
300 - 310
|
|
Приложение А3.8
НОРМЫ
ФИЗИОЛОГИЧЕСКОЙ ПОТРЕБНОСТИ В ОСНОВНЫХ НУТРИЕНТАХ
ДЛЯ ЗДОРОВЫХ ДЕТЕЙ РАЗЛИЧНЫХ ВОЗРАСТНЫХ ГРУПП И ВЗРОСЛЫХ
Среднесуточные нормы потребностей в основных пищевых веществах и энергии для детей первого года жизни (на кг массы тела) [24].
|
Возраст
(мес.)
|
Энергия,
ккал/ кг
|
Белок,
г/кг
|
Жиры,
г/кг
|
Углеводы, г/кг
|
|
0 - 3
|
115
|
2,2
|
6,5
|
13
|
|
4 - 6
|
115
|
2,6
|
6,0
|
13
|
|
7 - 12
|
110
|
2,9
|
5,5
|
13
|
Среднесуточные нормы физиологической потребности в основных пищевых веществах и энергии для детей старше года [24].
|
Возраст
|
Энергия, ккал
|
Белок, г/день
|
Жиры, г/день
|
Углеводы, г/день
|
|
от 1 года до 2 лет
|
1200
|
36
|
40
|
174
|
|
от 2 лет до 3 лет
|
1400
|
42
|
47
|
203
|
|
от 3 лет до 7 лет
|
1800
|
54
|
60
|
261
|
|
от 7 лет до 11 лет
|
2100
|
63
|
70
|
305
|
|
от 11 лет до 14 лет мальчики
|
2500
|
75
|
83
|
363
|
|
от 11 лет до 14 лет девочки
|
2300
|
69
|
77
|
334
|
|
от 14 лет до 18 лет юноши
|
2900
|
87
|
97
|
421
|
|
от 14 лет до 18 лет девушки
|
2500
|
76
|
83
|
363
|
Приложение А3.9
МИНИМАЛЬНОЕ ДОПУСТИМОЕ КОЛИЧЕСТВО
ФА В ПИТАНИИ ПАЦИЕНТОВ С ГФА В ЗАВИСИМОСТИ ОТ ВОЗРАСТА
|
Возраст детей
|
Количество ФА
|
|
|
мг/кг/сутки <*>
|
мг/сутки <**>
|
|
|
от 0 до 2 месяцев
|
90 - 60
|
130 - 430
|
|
2 - 6 месяцев
|
55 - 45
|
135 - 400
|
|
6 - 9 месяцев
|
40 - 35
|
145 - 370
|
|
9 - 12 месяцев
|
135 - 330
|
|
|
1 - 3
|
35 - 25
|
200 - 320
|
|
3 - 7
|
25 - 20
|
200 - 1100
|
|
7 и старше
|
20 - 10
|
|
|
Беременные и кормящие женщины <**>
|
||
|
Триместр 1
|
265 - 770
|
|
|
Триместр 2
|
400 - 1650
|
|
|
Триместр 3
|
700 - 2275
|
|
|
Период лактации
|
700 - 2275
|
|
--------------------------------
Примечание: <*> - [23]; <**> - [4, 20].
Недостающее количество белка восполняется за счет специализированных лечебных продуктов - смесей аминокислот без ФА и низкобелковых продуктов питания. Аминокислотные смеси различаются по содержанию белка (от 13 г до 77,5 г на 100 г сухого продукта) и других питательных веществ (углеводы, жиры, витамины, микро- и макроэлементы). Все смеси в своем составе не содержат ФА. Аминокислотные смеси с содержанием 13 - 15 г белка в 100 г сухой смеси предназначены для детей первого года жизни. Детям старше 1 года, подросткам, взрослым, включая беременных женщин, назначаются смеси с более высоким содержанием белка (Приложение А3.3). Расчет суточной дозы специализированного продукта производится по формуле:
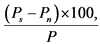
где Ps - суточное количество белка, Pn - белок естественных продуктов, P - белковый эквивалент в 100 г сухого специализированного продукта. Принцип расчета гипофенилаланиновой диеты показан на примере расчета питания 3-х летнему ребенку с ФАГ-зависимой ГФА (ФКУ).
Приложение А3.10
ПРИМЕР РАСЧЕТА ПИТАНИЯ РЕБЕНКУ С ФАГ-ЗАВИСИМОЙ ГФА
Пациент 3 года, масса тела 14,5 кг
1. Общее суточное количество белка в рационе больного (см. приложение А3.8): 54,0 г
2. Допустимое суточное количество ФА (см. приложение А3.9):
25 x 14,5 = 363 мг
3. Допустимое количество белка естественных продуктов (1 г белка содержит 50 мг ФА):
363 : 50 = 7,3 г
4. Количество белка за счет специализированного продукта на основе смеси L-аминокислот без ФА:
54,0 - 7,3 = 46,7 г
5. Суточное количество аминокислотной смеси (100 г содержит 20 г белка):
46,7 x 100:20 = 233 г
6. Рекомендуемое суточное количество жира в рационе (см. приложение А3.8): 60 г
7. Рекомендуемое суточное количество углеводов (см. приложение А3.8): 261 г
Приложение А3.11
СХЕМА ТЕРАПИИ ПРИ РАЗЛИЧНЫХ BH4-ДЕФИЦИТНЫХ СОСТОЯНИЯХ
Схема терапии при различных BH4-дефицитных состояниях (с/без гиперфенилаланинемии) <*>
|
Средства терапии
Ферменты
|
Сапрптерин**
|
#Леводопа+[Карбидопа]**
|
5-гидрокси триптофан (биологически активная добавка)
|
Диета с низким ФА
|
Фолиевая кислота**
|
|
BH4-состояние
|
|||||
|
GTPCH
|
+
|
+
|
+
|
-
|
-
|
|
DRD/аутосомно-доминантный тип GTPCH
|
-
|
+
|
-
|
-
|
-
|
|
PTPS умеренная форма
|
+
|
-
|
-
|
-
|
-
|
|
PTPS тяжелая форма
|
+
|
+
|
+
|
-
|
-
|
|
DHPR
|
-
|
+
|
+
|
+
|
+
|
|
SR
|
-
|
+
|
+
|
-
|
-
|
|
PCBD
|
+
|
+
|
+
|
-
|
-
|
--------------------------------
Примечание: <*> - таблица составлена по данным N.Blau 2014.
Приложение А3.12
ТЕСТ НА ЧУВСТВИТЕЛЬНОСТЬ К САПРОПТЕРИНУ**
Тестирование потенциальной чувствительности к сапроптерину** и дальнейшее лечение им проводит и контролирует врач, который осуществляет наблюдение пациентов с ГФА. Для более тщательного контроля тест целесообразно проводить в стационаре, возможно дневного пребывания, при удовлетворительной комплаентности пациента - амбулаторно. Перед проведением тестирования у родителей (законных представителей) ребенка, а также у пациентов старше 14 лет берут информированное согласие (приложение А3.13) на проведение данной процедуры, проводится предварительная беседа, в которой разъясняются цели и задачи тестирования, роль родителей и самого пациента в обеспечении и выполнении условий проведения теста.
Важными условиями тестирования являются
- ведение пищевого дневника и стабильная гипофенилаланиновая диета с целью исключения ее влияния на колебания концентрации ФА в крови;
- необходимость тесного взаимодействия с врачом для своевременного сообщения о нежелательных явлениях, интеркуррентных заболеваниях или других событиях, способных повлиять на результат тестирования;
- образцы крови для определения ФА следует собирать непосредственно перед введением сапроптерина**, а затем 2 - 5 проб в течение периода испытаний в одно и то же время дня, желательно натощак;
- измерение ФА в сухих образцах крови проводить одним и тем же методом.
Тестирование может быть проведено с 1 года с целью выявить BH4 дефицитные формы ГФА, что не исключает повторного проведения теста в более старшем возрасте для определения чувствительности к сапроптерину** у больных с ФАГ зависимой формой ГФА.
Можно использовать различные схемы тестирования (короткие схемы - 24 час, 48 часов, 7 дней, длительные схемы - от 28 дней и более). Длительность тестирования и кратность взятия крови во время тестирования определяет врач, руководствуясь при этом данными исследований по оптимальному проведению теста [28].
Для получения наиболее информативного результата целесообразно использовать для тестирования максимальную дозировку #сапроптерина** (20 мг/кг) [5 - 7]. Суточная доза рассчитывается индивидуально для каждого пациента в соответствии с инструкцией.
"Короткие" схемы тестирования
Основным критерием эффективности препарата при коротком тестировании является снижение концентрации ФА крови на 30% и более.
Проведение теста у детей старше 1 года, подростков и взрослых пациентов
Перед проведением тестирования стабилизируют содержание ФА в крови путем поддержания постоянства пищевого рациона в течение 4 - 5 дней до начала теста и в период тестирования. Тестирование начинают на фоне стабильного уровня ФА крови, при этом рассчитывается среднее значение двух показателей ФА, полученных в результате двукратного взятия крови перед началом тестирования. Целесообразно, чтобы среднее значение ФА было не ниже 450 мкмоль/л (7,5 мг/дл), поэтому "короткое" тестирование необходимо проводить в первую очередь у пациентов с повышенным содержанием ФА в крови. При нормальном содержании ФА крови, диета может быть слегка расширена (только при согласии родителей/законных представителей или самого пациента) до получения стабильных значений ФА крови не ниже 450 мкмоль/л (7,5 мг/дл).
В день первого приема препарата натощак берут анализ крови из пальца на фенилаланин, затем ребенок принимает рассчитанную дозу препарата вместе с завтраком или сразу же после завтрака. В течение 2-х (или 7-ми) дней утром в одно и то же время после завтрака (или вместе с едой) ребенок принимает препарат, разведенный в теплой воде в соответствии с инструкцией.
Повторное взятие крови проводят на 3-й (или 8-й) день строго натощак. Ответ на чувствительность к препарату оценивается по степени снижения концентрации ФА в крови больного при соблюдении стабильной гипофенилаланиновой диеты. Пациент считается чувствительным, если разница уровня ФА, полученного по окончании периода оценки ответа на лечение, и исходного уровня ФА перед началом приема препарата составляет 30% и более.
При снижении уровня ФА более 85% высока вероятность, что гиперфенилаланинемия у пациента обусловлена недостаточностью тетрагидробиоптерина (BH4).
Примерные схемы тестирования приведены в таблицах 1 - 2.
Таблица 1. Двухдневная схема тестирования для определения чувствительности к сапроптерину <*>.
|
Процедуры
|
До теста
|
Дни тестирования
|
||||
|
I
|
II
|
1
|
2
|
3
|
4
|
|
|
Кровь натощак
|
X
|
X
|
X
|
X
|
||
|
Прием препарата
|
+
|
+
|
||||
|
Определение ответа по результатам ФА крови
|
*
|
|||||
--------------------------------
<*> - кратность взятия крови может быть увеличена до 3-х раз в сутки по решению врача. Более частый контроль ФА позволяет зафиксировать момент максимального снижения концентрации ФА крови на фоне приема сапроптерина**.
Таблица 2. Семидневная схема тестирования для определения чувствительности к сапроптерину** <1>.
|
Процедуры
|
До теста
|
Дни тестирования
|
|||||||||
|
7-и дневная схема
|
|||||||||||
|
I
|
II
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
|
Кровь натощак
|
X
|
X
|
X
|
X
|
|||||||
|
Прием препарата
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
||||
|
Определение ответа по результатам ФА крови
|
X
|
*
|
|||||||||
--------------------------------
<1> - кратность взятия крови может быть увеличена до 3-х раз в сутки по решению врача. Более частый контроль ФА позволяет зафиксировать момент максимального снижения концентрации ФА крови на фоне приема сапроптерина**.
После проведения тестирования и получения положительного результата необходимо подтвердить его в ходе длительного наблюдения.
"Длительный" тест
Основным критерием эффективности "длительного" тестирования является повышение толерантности к пищевому фенилаланину. Преимуществом такого тестирования является возможность его проведения на фоне референсных значений ФА крови у пациента (т.е. не выше 360 мкмоль/л). При этом требуется ежедневное ведение пищевого дневника, тщательный контроль диеты, фактического потребления пациентом натурального белка и ФА.
Во время длительного теста на реакцию с сапроптерином** образцы крови для определения концентраций ФА следует собирать по возможности ежедневно, если такой возможности нет, то не реже одного раза в неделю.
Максимальная толерантность к пищевому ФА определяется путем постепенного увеличения потребления ФА (расширение диеты) при сохранении показателей ФА в крови пациента в целевом диапазоне. В соответствии с европейскими рекомендациями по диагностике и лечению ГФА повышение естественной толерантности к белку >= 100% по сравнению с исходной (до начала тестирования) при сохранении концентрации ФА крови в пределах терапевтического диапазона после 6 месяцев приема сапроптерина** является доказательством чувствительности пациента к лечению данным препаратом.
В течение пробного лечения и последующей коррекции терапии концентрация ФА в крови не должна превышать целевого значения 6 мг/дл (360 мкмоль/л). При комбинированном использовании гипофенилаланиновой диеты и сапроптерина** контроль за антропометрическими и биохимическими показателями нутритивного статуса должны быть систематическим во избежание развития дефицита основных и минорных пищевых веществ, алиментарно-зависимых состояний.
При необходимости длительная медикаментозная терапия у больных ГФА, отвечающих на лечение сапроптерином** снижением уровня ФА в крови, проводится в комбинации с диетой при использовании аминокислотных смесей, количество которых определяет врач.
Пациенты, получающие сапроптерин** требуют тщательного контроля за состоянием их нутритивного статуса и другими показателями здоровья не реже 1 раза в 6 месяцев.
Тестирование на чувствительность к сапроптерину** во время беременности.
Женщинам с ГФА настоятельно рекомендуется выполнить тест до наступления беременности. Возможность проведения 48-часового теста на чувствительность к сапроптерину** рассматривается в случаях, когда беременная женщина с ГФА не могут достичь уровня ФА <= 360 мкмоль/л в крови с помощью гипофенилаланиновой диеты. Такой подход считается оправданным, так как риск тератогенности высоких концентраций в крови матери превышает риск использования сапроптерина** во время беременности. Если тестирование было проведено ранее (в подростковом возрасте, до беременности и т.д.) и был получен положительный ответ, позволяющий расширить диету женщины с ГФА, препарат назначается ей в период прегравидарной подготовки (за 2 - 3 месяца до планируемого зачатия). После наступления беременности прием препарата продолжается до родов, с коррекцией дозы лекарственного препарата [26, 54].
Медикаментозная терапия при BH4-дефицитных состояниях с ГФА является патогенетической и назначается после установления диагноза в обязательном порядке без проведения тестирования. Начальная доза сапроптерина** у больных с недостаточностью BH4 составляет от 2 до 5 мг/кг массы тела при приеме 1 раз в день. При необходимости доза сапроптерина** может быть увеличена до 20 мг/кг массы тела в день, для достижения оптимального терапевтического эффекта возможен прием препарата 2 - 3 в день.
Приложение А3.13
Информированное согласие
на проведение тестирования препаратом сапроптерин**
Я, _________________________________________________________________ (ФИО),
паспорт N ____________, выдан _____________________________________________
проинформирован(-а) о том, что препарат сапроптерин** (Сапроптерина**
дигидрохлорид) является синтетическим аналогом природного
тетрагидробиоптерина и является средством для лечения больных с
наследственными нарушениями обмена веществ (нужное подчеркнуть) -
фенилкетонурии, чувствительной к лечению сапроптерином**, и нарушений
обмена тетрагидробиоптерина (атипичная, кофакторная,
тетрагидробиоптерин-зависимая форма фенилкетонурии), которым страдает мой
ребенок (ФИО) __________________________________________, ____________ г.р.
Я информирован(-а) о том, что для подтверждения чувствительности к
лечению сапроптерином**, необходимо провести тестирование, целью которого
является подтвердить снижение уровня фенилаланина в крови на фоне
применения сапроптерина** в соответствии с имеющимися международными
стандартами (30% и более).
Я информирован(-а) о том, что в случае подтверждения чувствительности к
терапии сапроптерином**, данное лечение будет предоставлено моему ребенку
только после подтверждения государственного финансирования.
Я информирован(-а) лечащим врачом о том, что в процессе применения
сапроптерина** могут развиваться побочные эффекты, наиболее частыми из
которых являются:
- Незначительная головная боль
- Насморк, заложенность носа
- Боль в горле
- Кашель
- Желудочно-кишечные расстройства: понос, рвота, боли в животе
- Гипофенилаланинемия
- Могут быть другие побочные эффекты, о которых пока не известно.
Я обязуюсь обеспечить моему ребенку стабильную диету и не вносить в нее
никаких изменений в период проведения тестирования.
Я обязуюсь сообщать лечащему врачу обо всех побочных эффектах,
нежелательных явлениях и изменениях в состоянии моего ребенка, развившихся
во время применения сапроптерина**.
Я информирован(-а) о том, что я имею право отказаться от лечения
препаратом в любое время, о чем обязуюсь уведомить лечащего врача в течение
суток.
Я информирован(-а) о рекомендуемой дозе препарата, схеме лечения и
ожидаемых результатах терапии.
Моя подпись под данным согласием означает, что текст данного согласия
прочитан, в нем все понятно, на все вопросы я получил(-а) удовлетворившие
меня ответы, с предложенным планом лечения согласен(-а).
___________________________
(число, месяц, год)
Законный представитель (мать/отец/другой родственник)
______________________________________ (подпись)
______________________________________ (Ф.И.О.)
Лечащий врач __________________________(подпись)
______________________________________ (Ф.И.О.)
ЛПУ: ____________________________________________
Приложение А3.14
ВЗЯТИЕ БИОМАТЕРИАЛА
ДЛЯ ПРОВЕДЕНИЯ ДИАГНОСТИКИ В ПЯТНАХ КРОВИ
Подготовка к взятию крови
Подготовка к взятию крови стандартна: медицинский персонал должен соблюдать правила стерильности, протирая место прокола раствором антисептика, используя одноразовые иглы-скарификаторы и перчатки.
Получение сухого пятна крови
Как правило, для получения сухих пятен [72] кровь берут из пальца, также возможно использование венозной крови, взятой из пробирки с ЭДТА (в зависимости от используемых наборов).
У новорожденных кровь на неонатальный скрининг и ретест берут только из пятки, в исключительных случаях - из пальца (при невозможности взятия крови из пятки).
Место прокола (пятка, палец) следует обработать стерильной салфеткой, смоченной 70% спиртом, после чего промокнуть сухой стерильной салфеткой. Первая капля, образовавшаяся на месте прокола, не используется - ее стирают сухим ватным тампоном. Последующие капли поочередно наносят в круги на впитывающую мембрану тест-бланка. Круги на бланке должны быть пропитаны равномерно, насквозь, без белых пятен на обратной стороне бланка (рис. 1Г3). Для получения одного пятна требуется 80 - 100 мкл крови. После нанесения крови на тест-бланк образец выдерживают до полного высыхания в течение не менее 2-х часов при комнатной температуре, не соприкасаясь с другими тест-бланками. После высушивания тест-бланки складываются в индивидуальную упаковку, не соприкасаясь и не накладываясь пятнами крови друг на друга.

Рисунок 1Г3. Сухие пятна крови на тест-бланке.
Для молекулярно-генетических и биохимических исследований не в рамках неонатального скрининга, помимо капельного нанесения, может применяться нанесение необходимого объема цельной крови на тест-бланк полуавтоматическим дозатором, например, из пробирки, содержащей анализируемый биоматериал.
Транспортировка тест-бланков осуществляется при температуре не выше 25 °C [МР СПК].
Алгоритм действий медицинского персонала при взятии образцов крови:
- вымыть руки (гигиенический уровень), надеть перчатки;
- вымыть руки пациента (пятку ребенка в случае, если кровь берется из пятки);
- протереть область прокалывания стерильной салфеткой, смоченной 70% спиртом, промокнуть сухой стерильной салфеткой; проколоть стерильным одноразовым скарификатором;
- снять первую каплю крови стерильным сухим тампоном;
- мягко надавить для получения второй капли крови;
- приложить перпендикулярно тест-бланк к капле крови и пропитать его кровью насквозь;
- аналогичным образом нанести на тест-бланк 6 - 8 капель, вид пятен крови должен быть одинаковым с обеих сторон.
- высушить тест-бланк в горизонтальном положении на чистой обезжиренной поверхности не менее 4 ч без применения тепловой обработки и попадания прямых солнечных лучей;
- упаковать тест-бланки в чистый конверт таким образом, чтобы пятна крови не соприкасались.
Особенности при инфузионной терапии
Некоторые пациенты могут получать инфузионную терапию, переливание компонентов крови, что может оказать влияние на результаты тестов. Например, при переливании плазмы крови могут быть получены ложноотрицательные результаты, так как определяемые ферменты находятся в плазме и в клетках крови. Рекомендуется осуществить забор крови для ферментной и ДНК-диагностики не ранее, чем через 6 - 7 дней после переливания плазмы крови и через 7 - 10 дней после переливания компонентов крови.
Не допускается взятие крови:
- сразу после проведения пациенту инфузионной терапии (можно через 48 - 72 часа);
- сразу после заменного переливания крови (через 120 дней после заменного переливания крови можно).
Хранение и транспортировка биоматериала
Образцы высушенных пятен крови можно хранить в обычной камере холодильника при +4 °C до отправки. Срок хранения до момента отправки не должен превышать 7 дней. Температура при транспортировке биоматериала должна быть от 0 °C до +10 °C. Если хранить дольше и при более высокой температуре, то активность фермента даже в норме может снижаться, что приведет к ложноположительным результатам.
Алгоритм действий медицинского персонала при взятии образцов крови
- вымыть руки (гигиенический уровень), надеть перчатки;
- вымыть руки пациента (пятку ребенка в случае, если кровь берется из пятки); важно согреть область пункции путем обертывания в салфетку, смоченную во влажной воде; ребенок должен быть вертикализирован;
- протереть область прокалывания стерильной салфеткой, смоченной 70% спиртом, промокнуть сухой стерильной салфеткой; прижать конечность к неподвижной поверхности, проколоть стерильным одноразовым скарификатором;
- снять первую каплю крови стерильным сухим тампоном;
- мягко надавить для получения второй капли крови;
- приложить перпендикулярно тест-бланк к капле крови и пропитать его кровью насквозь;
- аналогичным образом нанести на тест-бланк 6 - 8 капель, вид пятен крови должен быть одинаковым с обеих сторон.
- высушить тест-бланк в горизонтальном положении на чистой обезжиренной поверхности не менее 4 ч без применения тепловой обработки и попадания прямых солнечных лучей;
- упаковать тест-бланки в чистый конверт таким образом, чтобы пятна крови не соприкасались.
Особенности при инфузионной терапии
Некоторые пациенты могут получать инфузионную терапию, переливание компонентов крови, что может оказать влияние на результаты тестов. Например, при переливании плазмы крови могут быть получены ложноотрицательные результаты. Рекомендуется осуществить взятие крови для анализа метаболитов и ДНК-диагностики не ранее чем через 6 - 7 дней после переливания плазмы крови и через 7 - 10 дней после переливания компонентов крови.
Не допускается взятие крови:
- сразу после проведения пациенту инфузионной терапии (можно через 48 - 72 часа);
- сразу после заменного переливания крови (через 120 дней после заменного переливания крови можно).
Хранение и транспортировка биоматериала
Образцы высушенных пятен крови можно хранить при комнатной температуре и влажности не более 60%. Срок хранения до момента отправки не должен превышать 7 дней.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
I Общий алгоритм диагностики и терапии ГФА
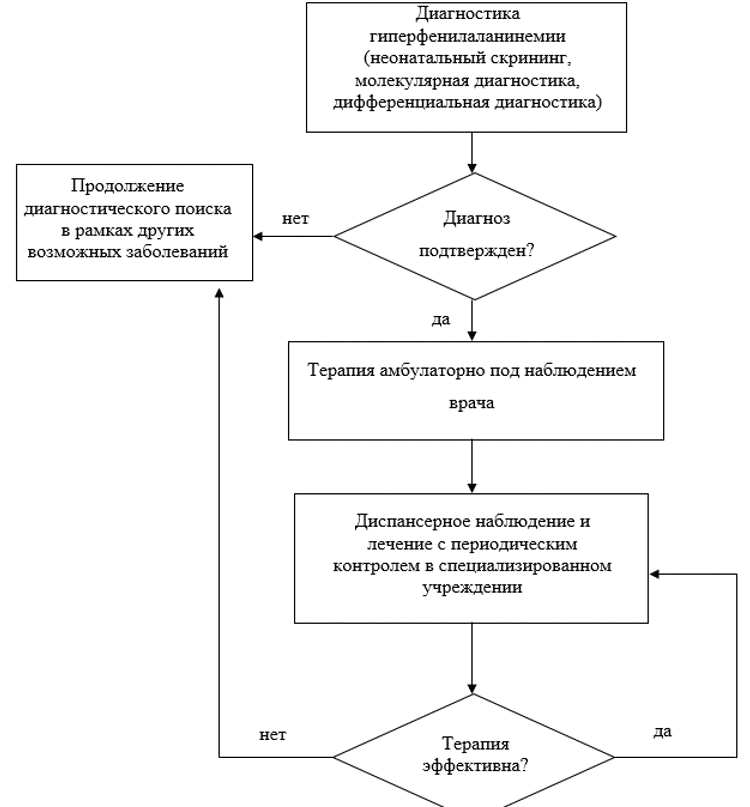
II Алгоритм дифференциальной диагностики ГФА
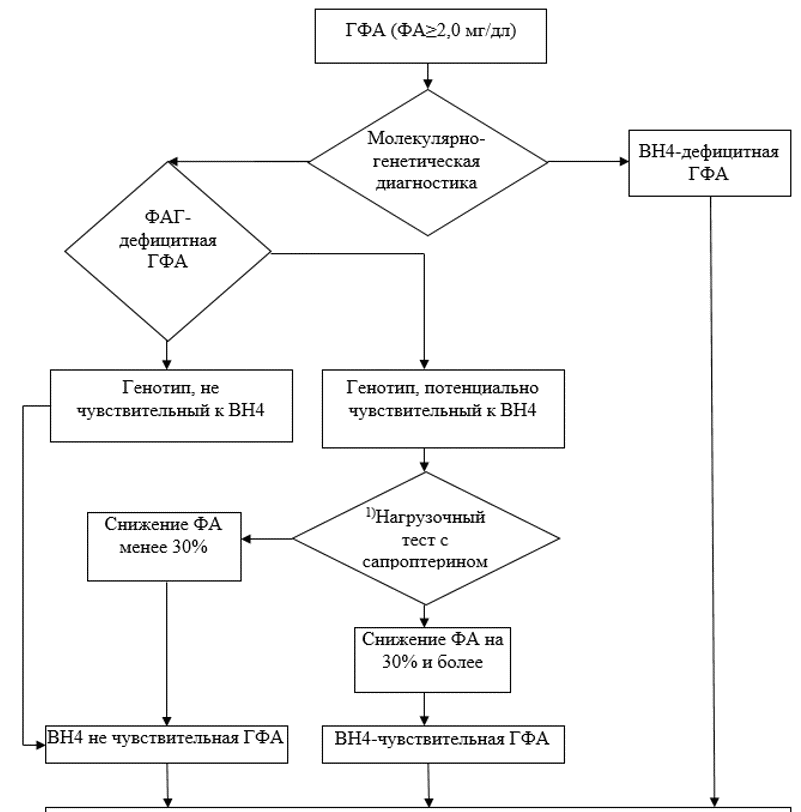
--------------------------------
1) Нагрузочный тест проводится после 1 года
III Алгоритм неонатального скрининга
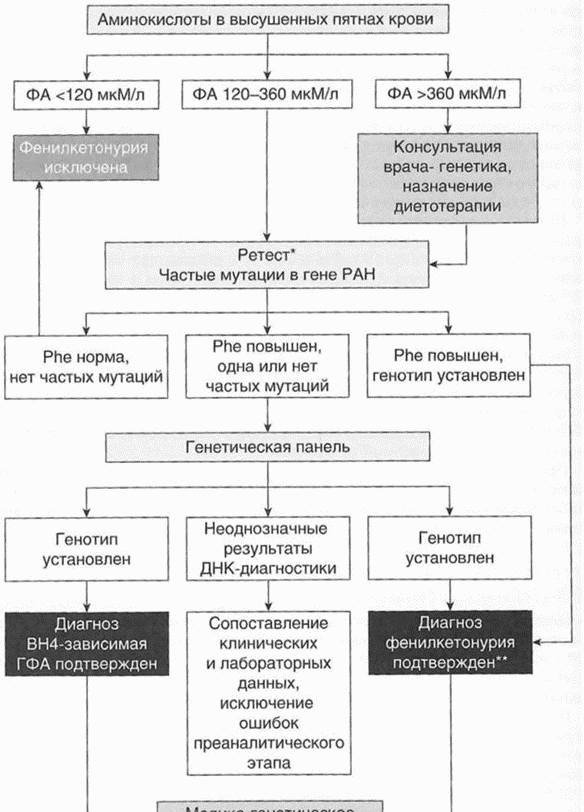
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое фенилкетонурия?
Фенилкетонурия (ФКУ) - это наследственное заболевание, характеризующееся нарушением метаболизма фенилаланина (ФА, незаменимая аминокислота, которая не синтезируется в организме, поступает с пищей - продуктами животного и растительного происхождения, в том числе с грудным молоком и детскими молочными смесями). ФКУ - целая группа заболеваний различной тяжести. В России рождается с этим заболеванием более 200 детей в год (примерно 1 на 7 - 8 тысяч новорожденных).
При отсутствии своевременной диагностики и лечения заболевание проявляется обычно в возрасте 2 - 6 месяцев жизни признаками поражения центральной нервной системы: родителей беспокоят вялость ребенка, отсутствие интереса к окружающему, иногда повышенная раздражительность, беспокойство, срыгивания, нарушение мышечного тонуса (чаще мышечная гипотония), признаки атопического дерматита, задержка психомоторного развития, иногда судороги. С возрастом дети имеют тяжелое поражение нервной системы вплоть до умственной отсталости и эпилепсии. При своевременно назначенном патогенетическом лечении жалобы имеют более легкий характер или отсутствуют.
Как врачи обнаруживают, что ребенок болен?
С целью ранней диагностики и профилактики развития указанных симптомов всем новорожденным проводится неонатальный скрининг в родильном доме на 3 - 7 день жизни.
Результаты данного обследования сообщаются родителям по телефону.
Родители обязаны внимательно отнестись к полученной из центра неонатального скрининга информации и немедленно явиться на прием к врачу и/или связаться с ним по телефону, даже если у ребенка отсутствуют клинические симптомы. Решение о назначении и характере диетотерапии принимает врач.
Какие проблемы вызывает фенилкетонурия?
Пища, которую мы едим, содержит белки, состоящие из отдельных аминокислот. При фенилкетонурии одна из этих аминокислот, которая называется фенилаланин, не усваивается организмом обычным образом. Из-за этого ФА накапливается в крови ребенка. Без лечения это приводит нарушению развития мозга. Но это можно предупредить, если уменьшить количество белка в пище. Таким образом, Ваш ребенок нуждается в специальной низкобелковой диете.
Диета, с одной стороны, должна содержать мало ФА, но, с другой стороны, быть сбалансированной для обеспечения роста и развития малыша. Ваш врач-генетик поможет лучше понять ситуацию, чтобы она была ясна Вам полностью.
Что делать родителям?
За исключением диеты, относитесь к ребенку как к здоровому, не старайтесь избыточно опекать его.
Диета поначалу кажется сложной, но врачи-генетики и диетологи окажут Вам максимальную поддержку и помощь, всегда, когда Вы будете в ней нуждаться.
Будет ли ребенок нормально расти и развиваться?
Для всех детей с ФКУ, которые своевременно начали лечение, ответ один - ДА! Если лечение Вашего ребенка проводится постоянно, ребенок растет и развивается нормально.
Но, если контроль за соблюдением диеты недостаточный, это может вызвать проблемы обучения и поведения ребенка. Ребенок не сможет добиться тех успехов, которых он бы достиг при тщательном соблюдении диеты.
Это пожизненная диета?
В настоящее время считается, что наиболее благоприятно пожизненное соблюдение диеты. Жесткое соблюдение диеты необходимо у женщин с ФКУ непосредственно перед и во время беременности для предупреждения развития пороков плода. Диетотерапия, основанная на резком ограничении ФА в рационе больных детей за счет исключения высокобелковых продуктов, должна быть начата не позднее первых недель жизни ребенка с целью достижения максимальной эффективности лечения. Недостающее количество белка восполняется за счет специализированных лечебных продуктов, частично или полностью лишенных ФА [23].
Назначение патогенетической диетотерапии с первых дней жизни ребенка определяет благоприятный прогноз течения фенилкетонурии.
Основные принципы диеты при ФКУ.
Обычное питание, рассчитанное на здорового ребенка, содержит гораздо больше фенилаланина, чем может усвоить ребенок с ФКУ. Таким образом, лечение состоит в диете, содержащей ровно столько фенилаланина, сколько необходимо для роста и развития ребенка.
Мясо, рыба, сыр, яйца, орехи, молоко, соя богаты белком и, таким образом, не могут использоваться в диете. Другие продукты, содержащие меньшее количество белка, такие как картофель и злаки, даются в таком количестве, чтобы уровень фенилаланина, который должен регулярно проверяться, оставался в безопасных пределах. Прием этих продуктов должен быть равномерно распределен в течение дня. Разрешенное количество каждого продукта со временем может меняться даже у одного ребенка.
Большинство фруктов, почти все овощи, в том числе листовые, сахар, варенья, сиропы и жиры, такие как сливочное масло, свиное сало, растительное масло, могут использоваться относительно свободно. Кроме того, существуют специально разработанные и производимые промышленным образом продукты питания для детей с ФКУ, содержащие мало белка. К ним относятся специальный хлеб, макаронные изделия, печенье и вафли, рис, молоко и другие изделия, которые можно использовать достаточно свободно для того, чтобы разнообразить питание малыша. Вы можете готовить их обычным способом (жарить, варить, печь и т.д.), добавляя травы и специи по вкусу.
Высокобелковые продукты, такие как мясо, рыба, сыр, яйца, которые не может есть Ваш ребенок, заменяются специальной аминокислотной смесью, в которой отсутствует фенилаланин. Эти заменители белка употребляются в виде напитков или паст, а у более старших детей могут быть в форме таблеток. Эти смеси выдаются по рецепту врача и обеспечивают ребенка "безопасным" белком для его роста и развития. Врач-генетик подробно расскажет Вам, как правильно готовить и принимать такую смесь.
Заменители белка - крайне важная часть диеты при ФКУ. Они даются в несколько приемов в течение дня. Это помогает удержать уровень фенилаланина крови в безопасных границах.
В диете ребенка также важны минералы и витамины. Если они уже не включены в заменитель белка, Ваш врач назначит необходимые количества этих веществ в виде дополнительных добавок к пище. Давайте ребенку только те препараты, которые назначит врач!
При каких формах ФКУ возможна медикаментозная терапия?
Для некоторых форм ФКУ разработана медикаментозная терапия препаратом сапроптерин** (Сапроптерина дигидрохлорид**), который является синтетическим аналогом природного тетрагидробиоптерина. Эффективность лекарственного препарата определяется с помощью тестирования.
Тестирование проводит, контролирует и оценивает врач, который осуществляет лечение и наблюдение пациентов с ФКУ. Для более тщательного контроля тест целесообразно проводить в стационаре, возможно дневного пребывания, при строгом соблюдении пациентом рекомендаций врача по проведению теста - амбулаторно.
Перед проведением тестирования очень важно стабилизировать содержание фенилаланина в крови путем соблюдения неизменного пищевого рациона в течение 4 - 5 дней до начала теста и в период тестирования для исключения влияния диеты на колебания концентрации ФА в крови. После получения положительного результата тестирования необходимо подтвердить его в ходе более длительного наблюдения.
Повышение толерантности к пищевому ФА на фоне приема синтетических аналогов BH4 является показанием для расширения диеты, при этом концентрация ФА не должна превышать 6 мг/дл. При комбинированном использовании гипофенилаланиновой диеты и синтетического аналога BH4 контроль за химическим составом диеты, антропометрическими и биохимическими показателями нутритивного статуса пациента, ФА крови должны быть систематическим.
Пациенты, получающие синтетический аналог BH4 требуют тщательного контроля за состоянием их нутритивного статуса и другими показателями здоровья.
Чтобы лечение было эффективным, родители и члены семей, где есть пациенты с ФКУ, сами пациенты должны быть в тесном контакте со своим лечащим врачом и выполнять все его назначения!
Как это коснется других детей в нашей семье?
Учитывая аутосомно-рецессивный тип наследования, мать и отец больного ребенка являются носителями болезни, хотя они совершенно здоровы. При каждой беременности риск родить больного ребенка составляет 1 шанс из 4, то есть достаточно высокий риск повторного рождения в семье больного ребенка. Поэтому показано медико-генетическое консультирование, чтобы помочь семье родить здорового ребенка. Также медико-генетическое консультирование необходимо всем пациентам с ФКУ репродуктивного возраста.
Взрослым пациентам с ФКУ (независимо от пола) следует знать, что если у их партнера нет мутаций в гене ФАГ, то в данном браке все дети будут только носителями, и болезнь не повлияет на их здоровье. С другой стороны, если партнер пациента с ФКУ имеет мутацию в гене ФАГ, то 50% их детей могут страдать фенилкетонурией. Если оба родителя являются пациентами с ФКУ, то все их дети также будут иметь данное заболевание и должны будут получать одинаковое с родителями лечение. Женщинам репродуктивного возраста с установленным ранее диагнозом ФКУ рекомендуется заранее планировать беременность, предварительно проконсультироваться у гинеколога и генетика и строго выполнять их назначения. Эти меры необходимы для снижения риска рождения у женщин с ФКУ младенцев с различными врожденными пороками развития (синдромом "материнской ФКУ").
Памятка будущим мамам с диагнозом "фенилкетонурия" а также родителям девочек с фенилкетонурией.
Это важно знать!
Нужно помнить, что после окончания специализированного лечения у Вас в крови остается высокое содержание фенилаланина и его производных. На Ваш организм это не оказывает вредного воздействия. Но если вы собираетесь стать матерью, то высокий уровень фенилаланина у вас в крови остановится "грозным врагом" Вашего будущего ребенка. Повышенный уровень фенилаланина в крови беременной женщины, страдающей ФКУ, вызывает у плода тяжелые пороки развития сердечно сосудистой системы, головного мозга, задержку физического развития, интеллектуального развития, эпилепсию. Высокая концентрация фенилаланина и его производных в крови во время беременности является "ядом" для развивающего организма малыша.
Что нужно сделать, чтобы предотвратить рождение больного ребенка:
1) Посетить медико-генетическую консультацию при планировании беременности. Если Вам не выполняли ДНК-диагностику, следует провести ДНК-диагностику Вам и Вашему партнеру.
2) Встать на учет в медико-генетической консультации и начать лечение за 2 - 3 месяца до планируемой беременности. В этот период перейти на строгую гипофенилаланиновую диету с применением специализированного продукта лечебного питания (аминокислотная смесь с низким значением ФА). Уровень фенилаланина в крови на этом этапе не должен превышать 360 мкмоль/л (6 мг/дл).
3) После наступления беременности уровень фенилаланина в крови должен оставаться в пределах 120 - 240 мкмоль/л (2 - 4 мг/дл). До 12 недель беременности контроль уровня фенилаланина должен проводится не реже один раз в неделю. После 12 недель - не реже 1 раз в 2 недели. Врач медико-генетической консультации составит оптимальный расчет специализированной диеты и дозы специализированного продукта лечебного питания.
Только соблюдение вышеуказанных действий, постоянное наблюдение врача медико-генетической консультации, плановый контроль уровня фенилаланина в крови позволит избежать серьезных осложнений развития Вашего ребенка.
Частота проведения обследования у пациентов с ГФА
Первичная диагностика
|
Консультации врачей, лабораторные и инструментальные исследования, тестирование и терапия
|
Комментарий
|
|
Повторное определение содержания ФА в периферической крови новорожденным детям с повышенным уровнем ФА по результатам первичного теста
|
не позднее 3 недель от первично положительного результата
|
|
Молекулярно-генетическая диагностика
|
в максимально возможно короткие сроки
|
|
Проведение нагрузочного теста с синтетическим аналогом BH4 (в течение не менее 48-часов) пациентам старше года с мутациями в гене РАН, которые ассоциированы с чувствительностью к BH4
|
старше года
|
|
Исследование общего анализа крови для оценки основных параметров кроветворения
|
в первые 6 месяцев
|
|
Исследование общего анализа мочи с целью выявления дисметаболической нефропатии
|
в первые 6 месяцев
|
|
Исследование биохимического анализа крови общетерапевтического (содержание глюкозы, общего белка, белковых фракций, общего билирубина, холестерина, триглицеридов, липопротеидов низкой и высокой плотности, щелочной фосфатазы, креатинина, мочевины, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), кальция общего и ионизированного, натрия, калия, неорганического фосфора, железа, ферритина) с целью оценки баланса важнейших нутриентов при диетотерапии, оценки кальциево-фосфорного обмена, оценки состояния почек и печени
|
в первые 6 месяцев
|
|
Исследование биохимического анализа мочи (фосфаты, оксалаты, ураты) с целью оценки состояния почек, выявления дисметаболической нефропатии, кальциурии
|
в первые 6 месяцев
|
|
Проведение тандемной масс-спектрометрии пациентам с ГФА с целью определения соотношения фенилаланина/тирозина
|
в максимально возможно короткие сроки
|
|
Исследование содержания птеринов в моче
|
не позднее 3 недель от первично положительного результата
|
|
12-канальная ЭКГ для выявления дисметаболических нарушений в миокарде
|
в первые 6 месяцев
|
|
Эхокардиография при изменениях на ЭКГ
|
по показаниям
|
|
Проведение ЭЭГ и ЭЭГ-мониторинга пациентам со всеми формами ГФА при наличии неврологической симптоматики
|
по показаниям
|
|
УЗИ органов брюшной полости и почек для выявления дисметаболических нефропатий, нефрокальциноза, изменений со стороны печени и поджелудочной железы
|
в первые 6 месяцев
|
|
Консультация врача-генетика первичная (назначение и коррекция диетотерапии, осуществление контроля за адекватностью ее проведения)
|
не позднее 3 недель от первично положительного результата
|
|
Консультация врача-диетолога для анализа и коррекции диетотерапии (первично)
|
не позднее 3 недель от рождения
|
|
Консультация врача-педиатра для оценки общего состояния здоровья и определения тактики дальнейшей терапии
|
в первые 6 месяцев
|
|
Консультация врача-кардиолога и кардиологическое обследование, для своевременного выявления и/или мониторинга кардиологических изменений
|
в первые 6 месяцев
|
|
Консультация врача-невролога для своевременного выявления и/или мониторинга неврологических изменений
|
в первые 6 месяцев
|
|
Осмотр врачом-офтальмологом, включающий обследование глазного дна (офтальмоскопии)
|
в первые 6 месяцев
|
|
Консультация врача-психиатра пациентам с установленным диагнозом ГФА для оценки психиатрического статуса
|
по показаниям
|
|
Консультация медицинского психолога с оценкой интеллекта и других видов психической деятельности, используя соответствующие программы и тесты
|
по показаниям
|
|
Назначение лечения
|
Комментарий
|
|
Назначение диетотерапии после установления диагноза, чтобы предотвратить повреждение ЦНС
|
как можно раньше (до 3-х недель жизни)
|
|
Назначение синтетического аналога BH4 пациентам с BH4-дефицитной ГФА с целью предотвращения тяжелых неврологических нарушений
|
после установления диагноза
|
|
Назначение синтетического аналога пациентам с ФАГ-дефицитной ГФА, чувствительной к синтетическому аналогу BH4 с целью предотвращения тяжелых неврологических нарушений
|
после положительного тестирования синтетическим аналогом BH4
|
|
Назначение допаминергических препаратов, предшественников серотонина
|
в комплексном лечении пациентов с BH4 - дефицитной ГФА
|
|
Назначение препаратов кальция и витамина D и его аналогов
|
при наличии остеопении
|
|
Назначение препаратов трехвалентного железа
|
при наличии железодефицитной анемии
|
|
Назначение противоэпилептических препаратов
|
при наличии судорожного синдрома
|
Динамическое наблюдение детей с ГФА
|
Консультации врачей, лабораторные и инструментальные исследования, тестирование и терапия
|
Младше 12 лет
|
12 - 18 лет
|
||
|
Анализ крови на ФА (утром натощак)
|
в возрасте до 3-х месяцев - 1 раз в неделю (до получения стабильных результатов) и далее 1 раз в 10 дней;
|
не реже 1 раза в 3 месяца
|
||
|
с 1 года до 6 лет - не реже 1 - 2 раза в месяц;
|
||||
|
с 7 лет и старше - не реже 1 раза в 3 месяца
|
||||
|
Анализ крови пациентам с ГФА с максимальным значением уровня ФА на протяжении длительного периода 360 мкмоль/л (6 мг/дл)
|
не реже 1 раза в месяц
|
по показаниям
|
||
|
Исследование общего анализа крови для оценки основных параметров кроветворения
|
не реже 1 раза в год
|
|||
|
Исследование общего анализа мочи с целью выявления дисметаболической нефропатии
|
не реже 1 раза в год
|
|||
|
Исследование биохимического анализа крови общетерапевтического (содержание глюкозы, общего белка, белковых фракций, общего билирубина, холестерина, триглицеридов, липопротеидов низкой и высокой плотности, щелочной фосфатазы, креатинина, мочевины, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), кальция общего и ионизированного, натрия, калия, неорганического фосфора, железа, ферритина) с целью оценки баланса важнейших нутриентов при диетотерапии, оценки кальциево-фосфорного обмена, оценки состояния почек и печени
|
не реже 1 раза в год
|
|||
|
Исследование биохимического анализа мочи (фосфаты, оксалаты, ураты) с целью оценки состояния почек, выявления дисметаболической нефропатии
|
не реже 1 раза в год
|
|||
|
Проведена тандемная масс-спектрометрия пациентам с ГФА с целью определения соотношения фенилаланина/тирозина
|
не реже 1 раза в год
|
|||
|
Эхокардиография при изменениях на ЭКГ
|
по показаниям
|
|||
|
12-канальная ЭКГ для выявления дисметаболических нарушений в миокарде
|
не реже 1 раза в год
|
|||
|
МРТ головного мозга при наличии неврологической симптоматики
|
по показаниям
|
|||
|
ЭЭГ и ЭЭГ-мониторинг при наличии неврологической симптоматики
|
при стабильном течении - 1 раз в год, по показаниям - чаще
|
|||
|
УЗИ органов брюшной полости и почек для выявления дисметаболических нефропатий, нефрокальциноза, изменений со стороны печени и поджелудочной железы на фоне высокобелковой диеты
|
не реже 1 раза в год
|
|||
|
Исследование минеральной плотности костной ткани денситометрия для диагностики остеопороза и его профилактики
|
проводится детям старше 5 лет по показаниям, но не чаще 1 раза в год
|
по показаниям
|
||
|
Проведение рентгенографии кисти рук детям, имеющим задержку физического развития и полового развития для определения костного возраста и кальциево-фосфорного обмена
|
по показаниям
|
|||
|
Консультация врача-генетика (назначение и коррекция диетотерапии, осуществление контроля за адекватностью ее проведения)
|
в возрасте до 1 года - не реже 1 раза в месяц;
|
не реже 1 раза в 3 месяца
|
||
|
с 1 года - не реже 1 раза в 3 месяца
|
||||
|
Консультация врача-диетолога для анализа и коррекции диетотерапии
|
не реже 1 раза в год
|
|||
|
Консультация врача-педиатра для оценки общего состояния здоровья и определения тактики дальнейшей терапии
|
1 раз в 6 месяцев
|
|||
|
Консультация врача-кардиолога и кардиологическое обследование, для своевременного выявления и/или мониторинга кардиологических изменений
|
по показаниям
|
|||
|
Консультация врача-невролога для своевременного выявления и/или мониторинга неврологических изменений
|
не реже 1 раза в год
|
|||
|
Осмотр врачом-офтальмологом, включающий обследование глазного дна (офтальмоскопии)
|
не реже 1 раза в 3 года
|
|||
|
Консультация врача-гастроэнтеролога
|
по показаниям
|
|||
|
Консультация врача-психиатра для оценки психиатрического статуса
|
по показаниям
|
|||
|
Консультация врача-физиотерапевта для назначения и проведения физиотерапевтических процедур
|
по показаниям
|
|||
|
Консультация медицинского психолога для оценки и коррекции психологического состояния и оказания психологической помощи
|
Обязательно при отказе от диетотерапии, употребления продуктов специализированного питания, а также высокого риска потери метаболического контроля и полной утраты медицинского наблюдения
|
По необходимости оказывается психологическая помощь по вопросам коммуникации в семье и обществе, профессиональной ориентации; для пациентов женского пола дополнительно по вопросам, связанным с беременностью
|
||
|
Назначение лечения
|
Комментарий
|
|||
|
Диетотерапия (с целью профилактики повреждений ЦНС и улучшения социальной адаптации)
|
пожизненно
|
|||
|
Прием синтетического аналога BH4 пациентам с BH4-дефицитной ГФА, с ФАГ-дефицитной ГФА, чувствительной к синтетическому аналогу BH4 с целью предотвратить тяжелых неврологических нарушений
|
пожизненно
|
|||
|
Назначение допаминергических препаратов, предшественников серотонина с целью коррекции экстрапирамидного синдрома
|
по показаниям
|
|||
|
Назначение препаратов кальция и витамина D и его аналогов
|
при наличии остеопении
|
|||
|
Назначение препаратов трехвалентного железа
|
при наличии железодефицитной анемии
|
|||
|
Назначение противоэпилептических препаратов
|
при наличии судорожного синдрома
|
|||
|
Консультация девочек подросткового возраста по вопросу планирования семьи с целью предупреждения рождения ребенка с "материнской ФКУ"
|
-
|
не менее 1 раза
|
||
|
Консультация женщин по вопросу планирования семьи с целью предупреждения рождения ребенка с "материнской ФКУ"
|
-
|
при планировании беременности
|
||
|
Консультация пар, планирующих беременность, при условии, что будущие родители являются носителями патогенных вариантов
|
-
|
при планировании беременности
|
||
Динамическое наблюдение взрослых пациентов с ГФА
|
Консультации врачей, лабораторные и инструментальные исследования, тестирование и терапия
|
18 лет и старше
|
|
|
мужчины и небеременные женщины
|
Беременные с ФАГ-дефицитной ГФА
|
|
|
Анализ крови на ФА (утром натощак)
|
1 раз в 3 месяца
|
Не реже 1 раз в 7 дней в I триместре
Не реже 1 раз в 2 недели во 2 - 3 триместре
|
|
Анализ крови пациентам с ГФА с максимальным значением уровня ФА на протяжении длительного периода 360 мкмоль/л (6 мг/дл)
|
по показаниям
|
|
|
Исследование общего анализа крови для оценки основных параметров кроветворения
|
не реже 1 раза в год
|
|
|
Исследование общего анализа мочи с целью выявления дисметаболической нефропатии
|
не реже 1 раза в год
|
|
|
Исследование биохимического анализа крови общетерапевтического (содержание глюкозы, общего белка, белковых фракций, общего билирубина, холестерина, триглицеридов, липопротеидов низкой и высокой плотности, щелочной фосфатазы, креатинина, мочевины, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), кальция общего и ионизированного, натрия, калия, неорганического фосфора, железа, ферритина) с целью оценки баланса важнейших нутриентов при диетотерапии, оценки кальциево-фосфорного обмена, оценки состояния почек и печени
|
не реже 1 раза в год
|
|
|
Исследование биохимического анализа мочи (фосфаты, оксалаты, ураты) с целью оценки состояния почек, выявления дисметаболической нефропатии, кальциурии
|
не реже 1 раза в год
|
|
|
Проведена тандемная масс-спектрометрия пациентам с ГФА с целью определения соотношения фенилаланина/тирозина
|
не реже 1 раза в год
|
|
|
Проведено исследование уровня глюкозы и гликированного гемоглобина в крови
|
-
|
при наступлении беременности
|
|
Исследование уровня гомоцистеина в крови с целью оценки риска развития сердечно-сосудистых заболеваний
|
по показаниям
|
|
|
Эхокардиография при изменениях на ЭКГ
|
по показаниям
|
|
|
12-канальная ЭКГ для выявления дисметаболических нарушений в миокарде
|
не реже 1 раза в год
|
|
|
МРТ головного мозга при наличии неврологической симптоматики
|
по показаниям
|
|
|
ЭЭГ и ЭЭГ-мониторинг при наличии неврологической симптоматики
|
по показаниям
|
|
|
УЗИ органов брюшной полости и почек для выявления дисметаболических нефропатий, нефрокальциноза, изменений со стороны печени и поджелудочной железы на фоне высокобелковой диеты
|
не реже 1 раза в год
|
|
|
Исследование минеральной плотности костной ткани - денситометрия для диагностики остеопороза и его профилактики
|
по показаниям
|
|
|
Проведение рентгенографии кисти рук детям, имеющим задержку физического развития и полового развития для определения костного возраста и кальциево-фосфорного обмена
|
по показаниям
|
|
|
Проведено дополнительное экспертное ультразвуковое исследование плода женщинам с ГФА при беременности с целью исключения врожденных аномалий развития плода
|
-
|
на сроке 15 - 16 и 25 - 26 недель беременности
|
|
Консультация врача-генетика (назначение и коррекция диетотерапии, осуществление контроля за адекватностью ее проведения)
|
не реже 1 раза в год
|
не реже 1 раза в месяц
|
|
Консультация врача-диетолога для анализа и коррекции диетотерапии
|
не реже 1 раза в год
|
по показаниям
|
|
Консультация врача-терапевта для оценки общего состояния здоровья и определения тактики дальнейшей терапии
|
1 раз в 6 месяцев
|
по показаниям
|
|
Консультация врача-кардиолога и кардиологическое обследование, для своевременного выявления и/или мониторинга кардиологических изменений:
|
по показаниям
|
|
|
Эхокардиография при изменениях на ЭКГ
|
по показаниям
|
|
|
12-канальная ЭКГ для выявления дисметаболических нарушений в миокарде
|
не реже 1 раза в год
|
|
|
Консультация врача-невролога для своевременного выявления и/или мониторинга неврологических изменений
|
по показаниям
|
|
|
Осмотр врачом-офтальмологом, включающий обследование глазного дна (офтальмоскопии) с целью выявления глазной патологии и неврологического статуса
|
не реже 1 раза в 3 года
|
|
|
Консультация врача-гастроэнтеролога
|
по показаниям
|
|
|
Консультация врача-психиатра для оценки психиатрического статуса
|
по показаниям
|
|
|
Консультация врача-физиотерапевта для назначения и проведения физиотерапевтических процедур
|
по показаниям (заболевания суставов, рахит, нарушения кальциево-фосфорного обмена)
|
|
|
Консультация медицинского психолога для оценки и коррекции психологического состояния и оказания психологической помощи
|
По необходимости оказывается психологическая помощь по вопросам коммуникации в семье и обществе, профессиональной ориентации; для пациентов женского пола дополнительно по вопросам, связанным с беременностью
|
|
|
МРТ головного мозга при наличии неврологической симптоматики
|
по показаниям
|
|
|
ЭЭГ-мониторинг при наличии неврологической симптоматики
|
по показаниям
|
|
|
УЗИ органов брюшной полости и почек для выявления дисметаболических нефропатий, нефрокальциноза, изменений со стороны печени и поджелудочной железы на фоне высокобелковой диеты
|
1 раз в год
|
|
|
Исследование минеральной плотности костной ткани - денситометрия для диагностики остеопороза и его профилактики
|
по показаниям
|
|
|
Проведение рентгенографии кисти рук детям, имеющим задержку физического развития и полового развития для определения костного возраста и кальциево-фосфорного обмена
|
по показаниям
|
|
|
Консультация женщин по вопросу планирования семьи с целью предупреждения рождения ребенка с "материнской ФКУ"
|
при планировании беременности
|
-
|
|
Консультация пар, планирующих беременность, при условии, что будущие родители являются носителями мутации
|
при планировании беременности
|
-
|
|
Назначение лечения
|
Комментарий
|
|
|
Диетотерапия
|
пожизненно
|
|
|
Назначение синтетического аналога BH4 пациентам с BH4-дефицитной ГФА, с ФАГ-дефицитной ГФА, чувствительной к синтетическому аналогу BH4 с целью предотвратить тяжелые неврологические нарушения.
|
пожизненно
|
|
|
Назначение допаминергических препаратов, предшественников серотонина с целью коррекции экстрапирамидного синдрома
|
по показаниям
|
|
|
Назначение препаратов кальция и витамина D и его аналогов
|
при наличии остеопении
|
|
|
Назначение препаратов трехвалентного железа
|
при наличии железодефицитной анемии
|
|
|
Назначение противоэпилептических препаратов
|
при наличии судорожного синдрома
|
|
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ
ГФА В ЗАВИСИМОСТИ ОТ УРОВНЯ ФА В КРОВИ ДО ЛЕЧЕНИЯ
Название на русском языке: Клиническая классификация ГФА в зависимости от уровня ФА в крови до лечения
Оригинальное название:
Источник: Blau N., Burton B.K.,  B. et al. Phenylketonuria and BH4 Deficiencies//1st edition-Bremen: UNI-MED. 2010. 94P
B. et al. Phenylketonuria and BH4 Deficiencies//1st edition-Bremen: UNI-MED. 2010. 94P
Тип: шкала оценки
Назначение: определение формы заболевания в зависимости от уровня ФА
Содержание:
|
Форма заболевания
|
Уровень ФА в сыворотке крови <**>
|
|
|
мкмоль/л
|
мг/дл
|
|
|
Легкая ГФА
|
120 - 360
|
2 - 6
|
|
Умеренная ГФА
|
360 - 1200
|
6 - 20
|
|
Тяжелая ГФА
|
> 1200
|
> 20
|
Примечание: <**> - коэффициент пересчета мкмоль/л в мг/дл равен 60 [33].
Ключ: содержится в самой шкале