См. Документы Министерства здравоохранения Российской Федерации
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 26 октября 2022 г. N 700
ОБ УТВЕРЖДЕНИИ МЕТОДИК
РАСЧЕТА ПОКАЗАТЕЛЕЙ ФЕДЕРАЛЬНОГО ПРОЕКТА
"МЕДИЦИНСКАЯ НАУКА ДЛЯ ЧЕЛОВЕКА"
В целях обеспечения реализации мероприятий федерального проекта "Медицинская наука для человека" приказываю:
1. Утвердить методики расчета:
показателя "Количество проведенных исследований полных экзомов новорожденных (нарастающим итогом)", согласно приложению N 1;
показателя "Доля приоритетных разработок в интересах медицины, заканчивающихся "продуктом", согласно приложению N 2;
показателя "Количество зарегистрированных в установленном порядке диагностических тест-систем для раннего выявления онкозаболеваний, подбора оптимального лечения и (или) мониторинга эффективности получаемого лечения, а также рецидивов заболевания (нарастающим итогом)", согласно приложению N 3;
показателя "Количество созданных научных/научно-образовательных комплексов полного цикла на базе медицинских образовательных организаций высшего образования или научных организаций, консолидирующих на функциональной основе компетенции по отдельным направлениям (нарастающим итогом)", согласно приложению N 4;
показателя "Доля образовательных организаций высшего образования, осуществляющих подготовку медицинских и фармацевтических кадров, в которых реализуется более одной приоритетной разработки в интересах медицины", согласно приложению N 5;
показателя "Количество зарегистрированных в установленном порядке лекарственных препаратов на каждые 10 млрд руб., направленных на выполнение тематик государственного задания на прикладные научные исследования в области медицинской науки за 5 лет", согласно приложению N 6;
показателя "Количество зарегистрированных в установленном порядке медицинских изделий на каждые 1 млрд руб., направленных на выполнение тематик государственного задания на прикладные научные исследования в области медицинской науки за 5 лет", согласно приложению N 7;
показателя "Число случаев распоряжения правами на результаты интеллектуальной деятельности, созданных при выполнении прикладных научных исследований в рамках государственного задания, в год", согласно приложению N 8;
показателя "Количество разработанных персонализированных тест-систем для диагностики in vitro на основе генетических технологий (нарастающим итогом)", согласно приложению N 9;
показателя "Количество разработанных генотерапевтических лекарственных препаратов (нарастающим итогом)", согласно приложению N 10;
показателя "Количество доступных для оказания медицинской помощи разработанных клеточных продуктов (нарастающим итогом)", согласно приложению N 11;
показателя "Количество введенных в эксплуатацию опытно-промышленных производств на базе научного/научно-образовательного комплекса полного цикла с использованием инновационных технологических процессов (нарастающим итогом)", согласно приложению N 12;
показателя "Доля внедренных в практическое здравоохранение лекарственных препаратов и медицинских изделий, разработанных в рамках приоритетных проектов", согласно приложению N 13;
показателя "Доля пациентов с B-клеточным острым лимфобластным лейкозом, для которых применение CAR-T терапии позволит достичь ремиссии", согласно приложению N 14.
2. Контроль за исполнением настоящего приказа возложить на заместителя Министра здравоохранения Российской Федерации Т.В. Семенову.
Министр
М.А.МУРАШКО
Приложение N 1
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО ПРОВЕДЕННЫХ ИССЛЕДОВАНИЙ
ПОЛНЫХ ЭКЗОМОВ НОВОРОЖДЕННЫХ (НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество проведенных исследований полных экзомов новорожденных (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации только за 2022 год.
4. Информация по Показателю формируется и представляется:
ежемесячно по состоянию на последний календарный день отчетного месяца нарастающим итогом с начала 2022 года в срок не позднее 15 календарного дня, следующего за отчетным месяцем;
по итогам 2022 года - до 25 марта 2023 г.
5. Для целей настоящей методики экзомом является часть генома, сформированная экзомами <1>.
--------------------------------
<1> ГОСТ Р 58505-2019 Информатизация здоровья. Элементы данных и их метаданные для описания структурированной информации о клиническом геномном секвенировании в электронных медицинских картах.
6. Значение Показателя Ni (единиц) для отчетного периода i-го месяца рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го месяца, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го месяца, единиц;
ni - количество проведенных исследований полных экзомов новорожденных в i-ом месяце, единиц.
7. Значением Показателя по итогам 2022 года является значение Показателя для отчетного периода декабрь 2022 г.
8. Источником информации для формирования Показателя с ежемесячной периодичностью являются оперативные данные, предоставляемые федеральным государственным бюджетным учреждением "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства здравоохранения Российской Федерации.
9. Верификация значения Показателя по итогам 2022 года осуществляется на основании данных итогового отчета федерального государственного бюджетного учреждения "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства здравоохранения Российской Федерации о выполнении государственного задания на проведение работ по проведенным научным исследованиям (разработкам), полученным научным и (или) научно-техническим результатам, представленного путем его размещения в единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения <2>.
--------------------------------
<2> Постановление Правительства РФ от 12 апреля 2013 г. N 327 "О единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения" (Собрание законодательства Российской Федерации, 2013, N 16, ст. 1956; 2018, N 41, ст. 6260).
Приложение N 2
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "ДОЛЯ ПРИОРИТЕТНЫХ РАЗРАБОТОК
В ИНТЕРЕСАХ МЕДИЦИНЫ, ЗАКАНЧИВАЮЩИХСЯ "ПРОДУКТОМ"
1. Настоящая методика применяется для расчета показателя "Доля приоритетных разработок в интересах медицины, заканчивающихся "продуктом" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2024 год не позднее 31 марта года, следующего за отчетным.
5. Значение Показателя Ni (процентов) для отчетного периода i-го года рассчитывается по формуле:
Ni = (Bi / Ai) * 100%,
где
Ai - количество тематик научных исследований в единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения <1> по разработке лекарственных препаратов, медицинских изделий, методов профилактики, прогнозирования, диагностики, лечения или реабилитации, материалов для использования в медицинских целях, моделей заболеваний человека (далее - Тематики), реализуемых в i-ом году, единиц;
--------------------------------
<1> Постановление Правительства РФ от 12 апреля 2013 г. N 327 "О единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения" (Собрание законодательства Российской Федерации, 2013, N 16, ст. 1956; 2018, N 41, ст. 6260).
Bi - количество тематик научных исследований по направлениям разработок, указанных выше (Тематики), с результатом реализации, соответствующим уровню готовности технологии <2> равным или большим 5, единица.
--------------------------------
<2> Приложение А к ГОСТ Р 56861-2016. Национальный стандарт Российской Федерации. Система управления жизненным циклом. Разработка концепции изделия и технологий. Общие положения, утвержденного приказом Федерального агентства по техническому регулированию и метрологии от 20 февраля 2016 г. N 60-ст.
6. Источником информации для формирования Показателя являются данные из единой государственной информационной системы учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения.
Приложение N 3
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО ЗАРЕГИСТРИРОВАННЫХ
В УСТАНОВЛЕННОМ ПОРЯДКЕ ДИАГНОСТИЧЕСКИХ ТЕСТ-СИСТЕМ
ДЛЯ РАННЕГО ВЫЯВЛЕНИЯ ОНКОЗАБОЛЕВАНИЙ, ПОДБОРА ОПТИМАЛЬНОГО
ЛЕЧЕНИЯ И (ИЛИ) МОНИТОРИНГА ЭФФЕКТИВНОСТИ ПОЛУЧАЕМОГО
ЛЕЧЕНИЯ, А ТАКЖЕ РЕЦИДИВОВ ЗАБОЛЕВАНИЯ
(НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество зарегистрированных в установленном порядке диагностических тест-систем для раннего выявления онкозаболеваний, подбора оптимального лечения и (или) мониторинга эффективности получаемого лечения, а также рецидивов заболевания (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2023 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики медицинское изделие является зарегистрированным в установленном порядке в i-ом году в случае если медицинское изделие включено в i-ом году в государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий <1> и (или) единый реестр медицинских изделий, зарегистрированных в рамках Евразийского экономического союза <2> (далее - реестры) или в реестр разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro внесена в i-ом году запись о предоставлении разрешения на применение незарегистрированных медицинских изделий для диагностики in vitro <3>.
--------------------------------
<1> Статья 38 Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (Собрание законодательства Российской Федерации, 2011, N 48, ст. 6724; 2022, N 13, ст. 1953).
<2> Решение Совета Евразийской экономической комиссии от 12 февраля 2016 г. N 46 "О Правилах регистрации и экспертизы безопасности, качества и эффективности медицинских изделий".
<3> Постановление Правительства Российской Федерации от 24 ноября 2021 г. N 2026 "О незарегистрированных медицинских изделиях для диагностики in vitro" (Собрание законодательства Российской Федерации, 2021, N 49, ст. 8219).
6. Для целей настоящей методики медицинское изделие считается разработанным федеральным государственным учреждением в случае если регистрационное удостоверение на медицинское изделие выдано на имя указанного учреждения в соответствии со сведениями в реестрах или указанное учреждение передало права, на основании которых третье лицо является держателем или владельцем регистрационного удостоверения лекарственного препарата, такому лицу, заключив с ним соответствующий договор, или разрешение на применение незарегистрированного медицинского изделия для диагностики in vitro предоставлено федеральному государственному учреждению.
7. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го года, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го года, единиц;
ni - количество зарегистрированных в установленном порядке в i-ом году медицинских изделий, предназначенных для раннего выявления онкозаболеваний и (или) их рецидивов, подбора оптимального лечения и (или) мониторинга эффективности получаемого лечения, разработанных в федеральных государственных учреждениях, разработка которых осуществлялась федеральными государственными учреждениями полностью или частично за счет средств федерального бюджета или фондов поддержки научной, научно-технической, инновационной деятельности, учредителем которых является Российская Федерация, единиц.
8. При расчете Показателя N2023 для отчетного периода 2023 года значение Показателя N2022 для принимается равным значению показателя, рассчитанного для 2022 г.
9. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, осуществляющими деятельность по разработке диагностических тест-систем для раннего выявления онкозаболеваний, подбора оптимального лечения и (или) мониторинга эффективности получаемого лечения, а также рецидивов заболевания, подведомственными Министерству здравоохранения Российской Федерации, Министерству науки и высшего образования Российской Федерации, Федеральному медико-биологическому агентству, а также научными организациями и образовательными организациями высшего образования, функции и полномочия учредителя которых осуществляет Правительство Российской Федерации.
10. Верификация значения Показателя осуществляется на основании сведений реестров: реестра разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro, Государственного реестра изобретений Российской Федерации, Государственного реестра полезных моделей Российской Федерации, Государственного реестра промышленных образцов Российской Федерации, Реестра программ для ЭВМ, Реестра баз данных <4>.
--------------------------------
<4> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 4
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО СОЗДАННЫХ
НАУЧНЫХ/НАУЧНО-ОБРАЗОВАТЕЛЬНЫХ КОМПЛЕКСОВ ПОЛНОГО ЦИКЛА
НА БАЗЕ МЕДИЦИНСКИХ ОБРАЗОВАТЕЛЬНЫХ ОРГАНИЗАЦИЙ ВЫСШЕГО
ОБРАЗОВАНИЯ ИЛИ НАУЧНЫХ ОРГАНИЗАЦИЙ, КОНСОЛИДИРУЮЩИХ
НА ФУНКЦИОНАЛЬНОЙ ОСНОВЕ КОМПЕТЕНЦИИ ПО ОТДЕЛЬНЫМ
НАПРАВЛЕНИЯМ (НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество созданных научных/научно-образовательных комплексов полного цикла на базе медицинских образовательных организаций высшего образования или научных организаций, консолидирующих на функциональной основе компетенции по отдельным направлениям (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2022 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики научный/научно-образовательный комплекс полного цикла понимается в соответствии с понятием научно-образовательного комплекса полного цикла, определенного в Положении о создании научно-образовательного комплекса полного цикла <1>.
--------------------------------
<1> Приказ Министерства здравоохранения Российской Федерации от 1 марта 2022 г. N 124 "Об организации работы по созданию научно-образовательных комплексов полного цикла".
6. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го года, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го года, единиц;
ni - количество программ деятельности научно-образовательных комплексов полного цикла на 2022 - 2026 годы, утвержденных руководителями входящих в научно-образовательный комплекс полного цикла учреждений, или лицами, исполняющими их обязанности, и согласованных администратором федерального проекта "Медицинская наука для человека" <1> в i-ом году, единиц.
7. При расчете Показателя N2022 для отчетного периода 2022 года значение Показателя N2021 для принимается равным нулю.
8. Источником информации для формирования Показателя являются оперативные данные Министерства здравоохранения Российской Федерации.
Приложение N 5
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "ДОЛЯ ОБРАЗОВАТЕЛЬНЫХ ОРГАНИЗАЦИЙ
ВЫСШЕГО ОБРАЗОВАНИЯ, ОСУЩЕСТВЛЯЮЩИХ ПОДГОТОВКУ МЕДИЦИНСКИХ
И ФАРМАЦЕВТИЧЕСКИХ КАДРОВ, В КОТОРЫХ РЕАЛИЗУЕТСЯ БОЛЕЕ
ОДНОЙ ПРИОРИТЕТНОЙ РАЗРАБОТКИ В ИНТЕРЕСАХ МЕДИЦИНЫ"
1. Настоящая методика применяется для расчета показателя "Доля образовательных организаций высшего образования, осуществляющих подготовку медицинских и фармацевтических кадров, в которых реализуется более одной приоритетной разработки в интересах медицины" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2024 год не позднее 31 марта года, следующего за отчетным.
5. Значение Показателя Ni (процентов) для отчетного периода i-го года рассчитывается по формуле:
Ni = (Bi / Ai) * 100%,
где
Ai - количество образовательных организаций высшего образования, учредителем которых является Правительство Российской Федерации или федеральный орган исполнительной власти, для которых на i / (i+1)-ый учебный год в соответствии с Правилами установления организациям, осуществляющим образовательную деятельность, контрольных цифр приема по профессиям, специальностям и направлениям подготовки и (или) укрупненным группам профессий, специальностей и направлений подготовки для обучения по образовательным программам среднего профессионального и высшего образования, а также по группам научных специальностей и (или) научным специальностям для обучения по программам подготовки научных и научно-педагогических кадров в аспирантуре (адъюнктуре) за счет бюджетных ассигнований федерального бюджета <1> (далее - контрольные цифры приема) установлены отличные от нулевых контрольные цифры приема за счет бюджетных ассигнований федерального бюджета по одному или более направлению подготовки высшего образования - магистратуры из числа 32.00.00 - "Науки о здоровье и профилактическая медицина", 33.00.00 - "ФАРМАЦИЯ" и (или) по одной или более специальности высшего образования - специалитета из числа 30.00.00 - "ФУНДАМЕНТАЛЬНАЯ МЕДИЦИНА", 30.05.01 - "Медицинская биохимия", 30.05.02 - "Медицинская биофизика", 30.05.03 - "Медицинская кибернетика", 31.00.00 - "КЛИНИЧЕСКАЯ МЕДИЦИНА", 31.05.01 - "Лечебное дело", 31.05.02 - "Педиатрия", 31.05.03 - "Стоматология", 31.05.04 - "Остеопатия", 32.00.00 - "НАУКИ О ЗДОРОВЬЕ И ПРОФИЛАКТИЧЕСКАЯ МЕДИЦИНА", 32.05.01 - "Медико-профилактическое дело", 33.00.00 - "ФАРМАЦИЯ", 33.05.01 - "Фармация" и (или) одному или более направлению подготовки высшего образования - подготовки кадров высшей квалификации по программам подготовки научно-педагогических кадров в аспирантуре из числа 30.00.00 - "ФУНДАМЕНТАЛЬНАЯ МЕДИЦИНА", 30.06.01 - "Фундаментальная медицина", 31.00.00 - "КЛИНИЧЕСКАЯ МЕДИЦИНА", 31.06.01 - "Клиническая медицина", 32.00.00 - "НАУКИ О ЗДОРОВЬЕ И ПРОФИЛАКТИЧЕСКАЯ МЕДИЦИНА", 32.06.01 - "Медико-профилактическое дело", 33.00.00 - "ФАРМАЦИЯ", 33.06.01 - "Фармация" и (или) одной или более специальности высшего образования - подготовки кадров высшей квалификации по программам ординатуры (за исключением специальностей 31.08.10 - "Судебно-медицинская экспертиза", 31.08.24 - "Судебно-психиатрическая экспертиза", 31.08.41 - "Медико-социальная экспертиза", 31.08.71 - "Организация здравоохранения и общественное здоровье", 32.08.01 - "Гигиена детей и подростков", 32.08.02 - "Гигиена питания", 32.08.03 - "Гигиена труда", 32.08.04 - "Гигиеническое воспитание", 32.08.05 - "Дезинфектология", 32.08.06 "Коммунальная гигиена", 32.08.07 - "Общая гигиена", 32.08.09 - "Радиационная гигиена", 32.08.10 - "Санитарно-гигиенические лабораторные исследования", 32.08.11 - "Социальная гигиена и организация госсанэпидслужбы" и 33.08.02 "Управление и экономика фармации") (далее - образовательных организаций высшего образования, осуществляющих подготовку медицинских и фармацевтических кадров), единиц;
--------------------------------
<1> Утверждены постановлением Правительство Российской Федерации от 15 октября 2021 г. (Собрание законодательства Российской Федерации, 2021, N 43, ст. 7248; 2022, N 3, ст. 574).
Bi - количество образовательных организаций высшего образования, осуществляющих подготовку медицинских и фармацевтических кадров, в которых в i-ом году в соответствии со сведениями из единой государственной информационной системы учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения <2> реализовывались тематики научных исследований по разработке лекарственных препаратов, медицинских изделий, методов профилактики, прогнозирования, диагностики, лечения или реабилитации, материалов для использования в медицинских целях, моделей заболеваний человека, единиц.
--------------------------------
<2> Постановление Правительства РФ от 12 апреля 2013 г. N 327 "О единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения" (Собрание законодательства Российской Федерации, 2013, N 16, ст. 1956; 2018, N 41, ст. 6260).
6. Источником информации для формирования Показателя являются оперативные данные, предоставляемые образовательными организациями высшего образования, учредителем которых являются Министерство здравоохранения Российской Федерации, Министерство науки и высшего образования Российской Федерации, а также научными организациями и образовательными организациями высшего образования, функции и полномочия учредителя которых осуществляет Правительство Российской Федерации.
7. Верификация значения Показателя осуществляется на основании сведений о контрольных цифрах приема, установленных приказами Министерства науки и высшего образования Российской Федерации, и сведений единой государственной информационной системы учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения.
Приложение N 6
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО ЗАРЕГИСТРИРОВАННЫХ
В УСТАНОВЛЕННОМ ПОРЯДКЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ НА КАЖДЫЕ
10 МЛРД РУБ., НАПРАВЛЕННЫХ НА ВЫПОЛНЕНИЕ ТЕМАТИК
ГОСУДАРСТВЕННОГО ЗАДАНИЯ НА ПРИКЛАДНЫЕ НАУЧНЫЕ
ИССЛЕДОВАНИЯ В ОБЛАСТИ МЕДИЦИНСКОЙ НАУКИ ЗА 5 ЛЕТ"
1. Настоящая методика применяется для расчета показателя "Количество зарегистрированных в установленном порядке лекарственных препаратов на каждые 10 млрд руб., направленных на выполнение тематик государственного задания на прикладные научные исследования в области медицинской науки за 5 лет" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2024 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики лекарственный препарат является зарегистрированным в установленном порядке в i-ом году в случае если лекарственный препарат включен в i-ом году в государственный реестр лекарственных средств <1> и (или) в единый реестр зарегистрированных лекарственных средств Евразийского экономического союза <2> (далее - реестры).
--------------------------------
<1> Статья 33 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; 2019, N 52, ст. 7793).
<2> Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 84 "О порядках формирования и ведения единого реестра зарегистрированных лекарственных средств Евразийского экономического союза и информационных баз данных в сфере обращения лекарственных средств".
6. Для целей настоящей методики лекарственный препарат считается разработанным федеральным государственным учреждением в случае если указанное учреждение является держателем или владельцем регистрационного удостоверения лекарственного препарата в соответствии со сведениями в реестрах или указанное учреждение передало права, на основании которых третье лицо является держателем или владельцем регистрационного удостоверения лекарственного препарата, такому лицу, заключив с ним соответствующий договор.
7. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
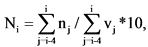
где
nj - количество зарегистрированных в установленном порядке в j-ом году лекарственных препаратов, разработанных федеральными государственными учреждениями, для которых указанными учреждения представлены сведения об их разработке, в том числе осуществлении отдельных этапов разработки, в рамках государственного задания учреждению на выполнение прикладных научных исследований в области здравоохранения, единица;
vj - объем средств федерального бюджета в j-ом году по коду подраздела классификации расходов бюджетов 0908 "Прикладные научные исследования в области здравоохранения" по кодам вида расходов "611 Субсидии бюджетным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" и "621 Субсидии автономным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" <3>, млрд руб.
--------------------------------
<3> Приказ Министерства финансов Российской Федерации от 6 июня 2019 г. N 85н "О Порядке формирования и применения кодов бюджетной классификации Российской Федерации, их структуре и принципах назначения" (зарегистрирован в Министерстве юстиции Российской Федерации 8 июля 2019 г., регистрационный N 55171) с изменениями, внесенными приказами Министерства финансов Российской Федерации Приказов Минфина России от 17 сентября 2019 г. N 148н (зарегистрирован в Министерстве юстиции Российской Федерации 15 октября 2019 г., регистрационный N 56231), от 29 ноября 2019 г. N 206н (зарегистрирован в Министерстве юстиции Российской Федерации 31 января 2020 г., регистрационный N 57388), от 10 марта 2020 г. N 37н (зарегистрирован в Министерстве юстиции Российской Федерации 10 апреля 2020 г., регистрационный N 58044), от 12 мая 2020 г. N 86н (зарегистрирован в Министерстве юстиции Российской Федерации 20 июня 2020 г., регистрационный N 58742) и от 8 июня 2020 г. N 98н (зарегистрирован в Министерстве юстиции Российской Федерации 24 сентября 2020 г., регистрационный N 60018).
8. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, которым устанавливается государственное задание на выполнение прикладных научных исследований в области здравоохранения.
9. Верификация значения Показателя осуществляется на основании сведений реестров, сведений государственной интегрированной информационной системы управления Российской Федерации <4>.
--------------------------------
<4> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 7
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО ЗАРЕГИСТРИРОВАННЫХ
В УСТАНОВЛЕННОМ ПОРЯДКЕ МЕДИЦИНСКИХ ИЗДЕЛИЙ НА КАЖДЫЕ
1 МЛРД РУБ., НАПРАВЛЕННЫХ НА ВЫПОЛНЕНИЕ ТЕМАТИК
ГОСУДАРСТВЕННОГО ЗАДАНИЯ НА ПРИКЛАДНЫЕ НАУЧНЫЕ
ИССЛЕДОВАНИЯ В ОБЛАСТИ МЕДИЦИНСКОЙ НАУКИ ЗА 5 ЛЕТ"
1. Настоящая методика применяется для расчета показателя "Количество зарегистрированных в установленном порядке медицинских изделий на каждые 1 млрд руб., направленных на выполнение тематик государственного задания на прикладные научные исследования в области медицинской науки за 5 лет" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2024 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики медицинское изделие является зарегистрированным в установленном порядке в i-ом году в случае если медицинское изделие включено в i-ом году в государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий <1> и (или) единый реестр медицинских изделий, зарегистрированных в рамках Евразийского экономического союза <2> (далее - реестры) или в реестр разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro внесена в i-ом году запись о предоставлении разрешения на применение незарегистрированных медицинских изделий для диагностики in vitro <3>.
--------------------------------
<1> Статья 38 Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (Собрание законодательства Российской Федерации, 2011, N 48, ст. 6724; 2022, N 13, ст. 1953).
<2> Решение Совета Евразийской экономической комиссии от 12 февраля 2016 г. N 46 "О Правилах регистрации и экспертизы безопасности, качества и эффективности медицинских изделий".
<3> Постановление Правительства Российской Федерации от 24 ноября 2021 г. N 2026 "О незарегистрированных медицинских изделиях для диагностики in vitro" (Собрание законодательства Российской Федерации, 2021, N 49, ст. 8219).
6. Для целей настоящей методики медицинское изделие считается разработанным федеральным государственным учреждением в случае если регистрационное удостоверение на медицинское изделие выдано на имя указанного учреждения в соответствии со сведениями в реестрах или указанное учреждение передало права, на основании которых третье лицо является держателем или владельцем регистрационного удостоверения лекарственного препарата, такому лицу, заключив с ним соответствующий договор, или разрешение на применение незарегистрированного медицинского изделия для диагностики in vitro предоставлено федеральному государственному учреждению.
6. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
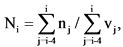
где
nj - количество зарегистрированных в установленном порядке в j-ом году медицинских изделий, разработанных федеральными государственными учреждениями, для которых указанными учреждения представлены сведения об их разработке, в том числе осуществлении отдельных этапов разработки, в рамках государственного задания учреждению на выполнение прикладных научных исследований в области здравоохранения, единица;
vj - объем средств федерального бюджета в j-ом году по коду подраздела классификации расходов бюджетов 0908 "Прикладные научные исследования в области здравоохранения" по кодам вида расходов "611 Субсидии бюджетным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" и "621 Субсидии автономным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" <4>, млрд руб.
--------------------------------
<4> Приказ Министерства финансов Российской Федерации от 6 июня 2019 г. N 85н "О Порядке формирования и применения кодов бюджетной классификации Российской Федерации, их структуре и принципах назначения" (зарегистрирован в Министерстве юстиции Российской Федерации 8 июля 2019 г., регистрационный N 55171) с изменениями, внесенными приказами Министерства финансов Российской Федерации Приказов Минфина России от 17 сентября 2019 г. N 148н (зарегистрирован в Министерстве юстиции Российской Федерации 15 октября 2019 г., регистрационный N 56231), от 29 ноября 2019 г. N 206н (зарегистрирован в Министерстве юстиции Российской Федерации 31 января 2020 г., регистрационный N 57388), от 10 марта 2020 г. N 37н (зарегистрирован в Министерстве юстиции Российской Федерации 10 апреля 2020 г., регистрационный N 58044), от 12 мая 2020 г. N 86н (зарегистрирован в Министерстве юстиции Российской Федерации 20 июня 2020 г., регистрационный N 58742) и от 8 июня 2020 г. N 98н (зарегистрирован в Министерстве юстиции Российской Федерации 24 сентября 2020 г., регистрационный N 60018).
8. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, которым установлено государственное задание на выполнение прикладных научных исследований в области здравоохранения по коду подраздела классификатора расходов бюджетов 0908.
9. Верификация значения Показателя осуществляется на основании сведений реестров, сведений реестра разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro, сведений Государственного реестра изобретений Российской Федерации, Государственного реестра полезных моделей Российской Федерации, Государственного реестра промышленных образцов Российской Федерации, Реестра программ для ЭВМ, Реестра баз данных <5>.
--------------------------------
<5> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 8
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "ЧИСЛО СЛУЧАЕВ РАСПОРЯЖЕНИЯ ПРАВАМИ
НА РЕЗУЛЬТАТЫ ИНТЕЛЛЕКТУАЛЬНОЙ ДЕЯТЕЛЬНОСТИ, СОЗДАННЫХ
ПРИ ВЫПОЛНЕНИИ ПРИКЛАДНЫХ НАУЧНЫХ ИССЛЕДОВАНИЙ В РАМКАХ
ГОСУДАРСТВЕННОГО ЗАДАНИЯ, В ГОД"
1. Настоящая методика применяется для расчета показателя "Число случаев распоряжения правами на результаты интеллектуальной деятельности, созданных при выполнении прикладных научных исследований в рамках государственного задания, в год" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2023 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики к результатам интеллектуальной деятельности относятся изобретения, полезные модели, промышленные образцы, программы для электронных вычислительных машин (программы для ЭВМ), базы данных, топологии интегральных микросхем, секреты производства (ноу-хау), которым предоставлена правовая охрана.
6. Для целей настоящей методики результат интеллектуальной деятельности является созданным при выполнении прикладного научного исследования в рамках государственного задания в случае если результат интеллектуальной деятельности в соответствии со сведениями о состоянии правовой охраны результата интеллектуальной деятельности в единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения <1> (далее - ЕГИСУ НИОКТР) создан в рамках научно-исследовательской, опытно-конструкторской и технологической работы, финансирование которой в соответствии со сведениями о начинаемой научно-исследовательской, опытно-конструкторской и технологической работе гражданского назначения или сведениями о результатах научно-исследовательской, опытно-конструкторской и технологической работы гражданского назначения в ЕГИСУ НИОКТР осуществлялась за счет средств федерального бюджета по коду подраздела классификации расходов бюджетов 0908 "Прикладные научные исследования в области здравоохранения" по кодам вида расходов "611 Субсидии бюджетным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" или "621 Субсидии автономным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ) <2>.
--------------------------------
<1> Постановление Правительства РФ от 12 апреля 2013 г. N 327 "О единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения" (Собрание законодательства Российской Федерации, 2013, N 16, ст. 1956; 2018, N 41, ст. 6260).
<2> Приказ Министерства финансов Российской Федерации от 6 июня 2019 г. N 85н "О Порядке формирования и применения кодов бюджетной классификации Российской Федерации, их структуре и принципах назначения" (зарегистрирован в Министерстве юстиции Российской Федерации 8 июля 2019 г., регистрационный N 55171) с изменениями, внесенными приказами Министерства финансов Российской Федерации Приказов Минфина России от 17 сентября 2019 г. N 148н (зарегистрирован в Министерстве юстиции Российской Федерации 15 октября 2019 г., регистрационный N 56231), от 29 ноября 2019 г. N 206н (зарегистрирован в Министерстве юстиции Российской Федерации 31 января 2020 г., регистрационный N 57388), от 10 марта 2020 г. N 37н (зарегистрирован в Министерстве юстиции Российской Федерации 10 апреля 2020 г., регистрационный N 58044), от 12 мая 2020 г. N 86н (зарегистрирован в Министерстве юстиции Российской Федерации 20 июня 2020 г., регистрационный N 58742) и от 8 июня 2020 г. N 98н (зарегистрирован в Министерстве юстиции Российской Федерации 24 сентября 2020 г., регистрационный N 60018).
7. Для целей настоящей методики распоряжением правами на результаты интеллектуальной деятельности является отчуждение исключительного права на результат интеллектуальной деятельности по договору другому лицу (далее - договор об отчуждении исключительного права) или предоставление другому лицу права использования результата интеллектуальной деятельности в установленных договором пределах (лицензионный договор).
8. Значение Показателя Ni (единиц) для отчетного периода i-го года определяется как количество случаев распоряжения результатами интеллектуальной деятельности, созданных при выполнении прикладного научного исследования в рамках государственного задания, в i-ом году, единиц.
9. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, которым установлено государственное задание на выполнение прикладных научных исследований в области здравоохранения по коду подраздела классификатора расходов бюджетов 0908.
10. Верификация значения Показателя осуществляется на основании сведений, размещенных в ЕГИСУ НИОКТР, сведений Государственного реестра изобретений Российской Федерации, Государственного реестра полезных моделей Российской Федерации, Государственного реестра промышленных образцов Российской Федерации, Реестра программ для ЭВМ, Реестра баз данных <3>.
--------------------------------
<3> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 9
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО РАЗРАБОТАННЫХ
ПЕРСОНАЛИЗИРОВАННЫХ ТЕСТ-СИСТЕМ ДЛЯ ДИАГНОСТИКИ IN VITRO
НА ОСНОВЕ ГЕНЕТИЧЕСКИХ ТЕХНОЛОГИЙ (НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество разработанных персонализированных тест-систем для диагностики in vitro на основе генетических технологий (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2024 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики к персонализированным тест-системам для диагностики in vitro на основе генетических технологий относятся медицинские изделия, которые предназначены для диагностики заболеваний путем проведения исследований образцов биологического материала человека вне его организма, изготовлены в медицинской организации и применяются в медицинской организации, их изготовившей (незарегистрированные медицинские изделия для диагностики in vitro) <1>, относящиеся к реагентам/наборам для определения аналитов для диагностики in vitro (подпункт 5.4 пункта 5 номенклатурной классификации медицинских изделий по видам <2>), аналитом в которых являются нуклеиновые кислоты и (или) их структура, в том числе последовательность.
--------------------------------
<1> Пункт 6 части 5 статьи 38 Федеральный закон от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (Собрание законодательства Российской Федерации, 2011, N 48, ст. 6724; 2021, N 18, ст. 3072).
<2> Утверждена приказом Министерства здравоохранения Российской Федерации от 06 июня 2012 г. N 4н (зарегистрирован в Министерстве юстиции Российской Федерации 9 июля 2012 г., регистрационный N 24852) с изменениями, внесенными приказами Министерства здравоохранения Российской Федерации от 2 сентября 2014 г. N 557н (зарегистрирован в Министерстве юстиции Российской Федерации 17 декабря 2012 г., регистрационный N 35201) и от 7 июля 2020 г. N 686н (зарегистрирован в Министерстве юстиции Российской Федерации 10 августа 2020 г., регистрационный N 59225).
6. Для целей настоящей методики персонализированная тест-система для диагностики in vitro на основе генетических технологий считается разработанной в i-ом году в случае если в i-ом году в реестр разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro внесена запись о предоставлении разрешения на применение соответствующего незарегистрированного медицинского изделий для диагностики in vitro <3>.
--------------------------------
<3> Постановление Правительства Российской Федерации от 24 ноября 2021 г. N 2026 "О незарегистрированных медицинских изделиях для диагностики in vitro" (Собрание законодательства Российской Федерации, 2021, N 49, ст. 8219).
7. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го года, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го года, единиц;
ni - количество персонализированных тест-систем для диагностики in vitro на основе генетических технологий, разработанных в i-ом году, единиц.
8. При расчете Показателя N2023 для отчетного периода 2024 года значение Показателя N2023 рассчитывается для периода с 2022 года по 2023 год.
9. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, осуществляющими деятельность по разработке тест-систем для диагностики in vitro на основе генетических технологий, подведомственными Министерству здравоохранения Российской Федерации, Министерству науки и высшего образования Российской Федерации, Федеральному медико-биологическому агентству, а также научными организациями и образовательными организациями высшего образования, функции и полномочия учредителя которых осуществляет Правительство Российской Федерации.
10. Верификация значения Показателя осуществляется на основании сведений реестра разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro <3>.
Приложение N 10
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО РАЗРАБОТАННЫХ
ГЕНОТЕРАПЕВТИЧЕСКИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
(НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество разработанных генотерапевтических лекарственных препаратов (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2027 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики к генотерапевтическим лекарственным препаратам относятся лекарственные препараты, соответствующие критериям, определенным абзацами вторым и третьим подпункта 17.2.1 приложения N 1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения <1>.
--------------------------------
<1> Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78.
6. Для целей настоящей методики генотерапевтический лекарственный препарат считается разработанным в i-ом году в случае если в i-ом году указанный лекарственный препарат был включен в государственный реестр лекарственных средств <2> и (или) в единый реестр зарегистрированных лекарственных средств Евразийского экономического союза <3> (далее - реестры).
--------------------------------
<2> Статья 33 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; 2019, N 52, ст. 7793).
<3> Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 84 "О порядках формирования и ведения единого реестра зарегистрированных лекарственных средств Евразийского экономического союза и информационных баз данных в сфере обращения лекарственных средств".
7. Для целей настоящей методики учету подлежат генотерапевтические лекарственные препараты, держателями или владельцами регистрационных удостоверений которых в соответствии со сведениями в реестрах являются федеральные государственные учреждения или указанные учреждения передали права, на основании которых третьи лица являются держателями или владельцами регистрационных удостоверений лекарственных препаратов, таким лицам, заключив с ними соответствующие договоры.
8. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го года, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го года, единиц;
ni - количество разработанных в i-ом году генотерапевтических лекарственных препаратов, единиц.
9. При расчете Показателя N2026 для отчетного периода 2027 года значение Показателя N2026 рассчитывается для периода с 2022 года по 2026 год.
10. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, осуществляющими деятельность по разработке генотерапевтических лекарственных препаратов, подведомственными Министерству здравоохранения Российской Федерации, Министерству науки и высшего образования Российской Федерации, Федеральному медико-биологическому агентству, а также научными организациями и образовательными организациями высшего образования, функции и полномочия учредителя которых осуществляет Правительство Российской Федерации.
11. Верификация значения Показателя осуществляется на основании сведений реестров, сведений Государственного реестра изобретений Российской Федерации <4>.
--------------------------------
<4> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 11
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО ДОСТУПНЫХ ДЛЯ ОКАЗАНИЯ
МЕДИЦИНСКОЙ ПОМОЩИ РАЗРАБОТАННЫХ КЛЕТОЧНЫХ ПРОДУКТОВ
(НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество доступных для оказания медицинской помощи разработанных клеточных продуктов (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2027 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики к клеточным продуктам относятся лекарственные препараты на основе соматических клеток и препараты тканевой инженерии в соответствии с указанными понятиями, определенными Правилами регистрации и экспертизы лекарственных средств для медицинского применения <1>.
--------------------------------
<1> Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 78.
6. Для целей настоящей методики клеточный продукт является ставшим доступным для оказания медицинской помощи в i-ом году в случае если лекарственный препарат на основе соматических клеток или препарат тканевой инженерии включен в i-ом году в государственный реестр лекарственных средств <2> и (или) в единый реестр зарегистрированных лекарственных средств Евразийского экономического союза <3> (далее - реестры).
--------------------------------
<2> Статья 33 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; 2019, N 52, ст. 7793).
<3> Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 84 "О порядках формирования и ведения единого реестра зарегистрированных лекарственных средств Евразийского экономического союза и информационных баз данных в сфере обращения лекарственных средств".
7. Для целей настоящей методики учету подлежат клеточные продукты, для которых держателем или владельцем регистрационного удостоверения лекарственного препарата на основе соматических клеток или препарата тканевой инженерии в соответствии со сведениями в реестрах является федеральное государственное учреждение или указанное учреждение передало права, на основании которых третье лицо является держателем или владельцем регистрационного удостоверения лекарственного препарата, такому лицу, заключив с ним соответствующий договор.
8. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го года, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го года, единиц;
ni - количество ставших доступными в i-ом году для оказания медицинской помощи клеточных продуктов, единиц.
9. При расчете Показателя N2027 для отчетного периода 2027 года значение Показателя N2026 рассчитывается для периода с 2022 года по 2026 год.
10. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, осуществляющими деятельность по разработке клеточных продуктов, подведомственными Министерству здравоохранения Российской Федерации, Министерству науки и высшего образования Российской Федерации, Федеральному медико-биологическому агентству, а также научными организациями и образовательными организациями высшего образования, функции и полномочия учредителя которых осуществляет Правительство Российской Федерации.
11. Верификация значения Показателя осуществляется на основании сведений реестров, сведений Государственного реестра изобретений Российской Федерации <4>.
--------------------------------
<4> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 12
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "КОЛИЧЕСТВО ВВЕДЕННЫХ
В ЭКСПЛУАТАЦИЮ ОПЫТНО-ПРОМЫШЛЕННЫХ ПРОИЗВОДСТВ НА БАЗЕ
НАУЧНОГО/НАУЧНО-ОБРАЗОВАТЕЛЬНОГО КОМПЛЕКСА ПОЛНОГО ЦИКЛА
С ИСПОЛЬЗОВАНИЕМ ИННОВАЦИОННЫХ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
(НАРАСТАЮЩИМ ИТОГОМ)"
1. Настоящая методика применяется для расчета показателя "Количество введенных в эксплуатацию опытно-промышленных производств на базе научного/научно-образовательного комплекса полного цикла с использованием инновационных технологических процессов (нарастающим итогом)" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2024 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики под опытно-промышленным производством понимается структурное подразделение подведомственного Министерству здравоохранения Российской Федерации учреждения, входящего в научно-образовательный комплекс полного цикла <1>, которое осуществляет производство активных фармацевтических субстанций и (или) лекарственных препаратов или медицинских изделий с помощью процедуры, полностью отражающей и повторяющей таковую при промышленном производстве.
--------------------------------
<1> Приказ Министерства здравоохранения Российской Федерации от 1 марта 2022 г. N 124 "Об организации работы по созданию научно-образовательных комплексов полного цикла".
6. Значение Показателя Ni (единиц) для отчетного периода i-го года рассчитывается по формуле:
Ni = N(i-1) + ni,
где
Ni - значение Показателя для отчетного периода i-го года, единиц;
N(i-1) - значение Показателя для отчетного периода (i-1)-го года, единиц;
ni - количество введенных в эксплуатацию опытно-промышленных производств на базе научно-образовательного комплекса полного цикла, единиц.
7. При расчете Показателя N2024 для отчетного периода 2024 года значение Показателя N2024 рассчитывается для периода с 2022 года по 2023 год.
8. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, подведомственными Министерству здравоохранения Российской Федерации.
9. Верификация значения Показателя осуществляется на основании копий документов, подтверждающих ввод в эксплуатацию вновь организованного (модернизированного, дооснащенного) экспериментальных опытных производств.
Приложение N 13
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "ДОЛЯ ВНЕДРЕННЫХ В ПРАКТИЧЕСКОЕ
ЗДРАВООХРАНЕНИЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И МЕДИЦИНСКИХ
ИЗДЕЛИЙ, РАЗРАБОТАННЫХ В РАМКАХ ПРИОРИТЕТНЫХ ПРОЕКТОВ"
1. Настоящая методика применяется для расчета показателя "Доля внедренных в практическое здравоохранение лекарственных препаратов и медицинских изделий, разработанных в рамках приоритетных проектов" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2025 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики лекарственный препарат считается разрабатываемым в рамках приоритетного проекта в случае если в соответствии со сведениями о результатах научно-исследовательской, опытно-конструкторской и технологической работы гражданского назначения в единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения <1> (далее - ЕГИСУ НИОКТР) разработка лекарственного препарата осуществлялась федеральным государственным учреждением за счет средств федерального бюджета по коду подраздела классификации расходов бюджетов 0908 "Прикладные научные исследования в области здравоохранения" по кодам вида расходов "611 Субсидии бюджетным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" или "621 Субсидии автономным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ) <2>.
--------------------------------
<1> Постановление Правительства РФ от 12 апреля 2013 г. N 327 "О единой государственной информационной системе учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения" (Собрание законодательства Российской Федерации, 2013, N 16, ст. 1956; 2018, N 41, ст. 6260).
<2> Приказ Министерства финансов Российской Федерации от 6 июня 2019 г. N 85н "О Порядке формирования и применения кодов бюджетной классификации Российской Федерации, их структуре и принципах назначения" (зарегистрирован в Министерстве юстиции Российской Федерации 8 июля 2019 г., регистрационный N 55171) с изменениями, внесенными приказами Министерства финансов Российской Федерации Приказов Минфина России от 17 сентября 2019 г. N 148н (зарегистрирован в Министерстве юстиции Российской Федерации 15 октября 2019 г., регистрационный N 56231), от 29 ноября 2019 г. N 206н (зарегистрирован в Министерстве юстиции Российской Федерации 31 января 2020 г., регистрационный N 57388), от 10 марта 2020 г. N 37н (зарегистрирован в Министерстве юстиции Российской Федерации 10 апреля 2020 г., регистрационный N 58044), от 12 мая 2020 г. N 86н (зарегистрирован в Министерстве юстиции Российской Федерации 20 июня 2020 г., регистрационный N 58742) и от 8 июня 2020 г. N 98н (зарегистрирован в Министерстве юстиции Российской Федерации 24 сентября 2020 г., регистрационный N 60018).
6. Для целей настоящей методики лекарственный препарат является внедренным в i-ом году в случае если на 31 декабря i-го года лекарственный препарат включен в государственный реестр лекарственных средств <3> и (или) в единый реестр зарегистрированных лекарственных средств Евразийского экономического союза <4> (далее - реестры лекарственных средств) и держателем или владельцем регистрационного удостоверения лекарственного препарата в соответствии со сведениями в реестрах лекарственных средств является федеральное государственное учреждение или указанное учреждение передало права, на основании которых третье лицо является держателем или владельцем регистрационного удостоверения лекарственного препарата, такому лицу, заключив с ним соответствующий договор.
--------------------------------
<3> Статья 33 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; 2019, N 52, ст. 7793).
<4> Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 84 "О порядках формирования и ведения единого реестра зарегистрированных лекарственных средств Евразийского экономического союза и информационных баз данных в сфере обращения лекарственных средств".
7. Для целей настоящей методики медицинское изделие считается разрабатываемым в рамках приоритетного проекта в случае если в соответствии со сведениями о результатах научно-исследовательской, опытно-конструкторской и технологической работы гражданского назначения в ЕГИСУ НИОКТР разработка медицинского изделия осуществлялась федеральным государственным учреждением за счет средств федерального бюджета по коду подраздела классификации расходов бюджетов 0908 "Прикладные научные исследования в области здравоохранения" по кодам вида расходов "611 Субсидии бюджетным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ)" или "621 Субсидии автономным учреждениям на финансовое обеспечение государственного (муниципального) задания на оказание государственных (муниципальных) услуг (выполнение работ).
8. Для целей настоящей методики медицинское изделие является внедренным в i-ом году в случае если медицинское изделие включено в i-ом году в государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий <5> и (или) единый реестр медицинских изделий, зарегистрированных в рамках Евразийского экономического союза <6> (далее - реестры медицинских изделий) или в реестр разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro <7> внесена в i-ом году запись о предоставлении разрешения на применение незарегистрированных медицинских изделий для диагностики in vitro и в соответствии со сведениями в реестрах медицинских изделий регистрационное удостоверение на медицинское изделие выдано на имя федерального государственного учреждения или указанное учреждение передало права, на основании которых третье лицо является держателем или владельцем регистрационного удостоверения лекарственного препарата, такому лицу, заключив с ним соответствующий договор, или разрешение на применение незарегистрированного медицинского изделия для диагностики in vitro предоставлено федеральному государственному учреждению.
--------------------------------
<5> Статья 38 Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (Собрание законодательства Российской Федерации, 2011, N 48, ст. 6724; 2022, N 13, ст. 1953).
<6> Решение Совета Евразийской экономической комиссии от 12 февраля 2016 г. N 46 "О Правилах регистрации и экспертизы безопасности, качества и эффективности медицинских изделий".
<7> Постановление Правительства Российской Федерации от 24 ноября 2021 г. N 2026 "О незарегистрированных медицинских изделиях для диагностики in vitro" (Собрание законодательства Российской Федерации, 2021, N 49, ст. 8219).
9. Значение Показателя Ni (процентов) для отчетного периода i-го года рассчитывается по формуле:
Ni = (Bi + Di) / (Ai + Ci) * 100%,
где
Ai - количество разрабатываемых в рамках приоритетного проекта научных исследований лекарственных препаратов, для которых в период с (i-7) года по (i-5) год была завершена II фаза клинических исследований лекарственного и отчет об указанном клиническом исследовании предоставлен в установленном порядке в Министерство здравоохранения Российской Федерации (далее - Препараты), единиц;
Bi - количество зарегистрированных в установленном порядке на конец i-го года лекарственных препаратов из числа Препаратов, единиц;
Ci - количество разрабатываемых в рамках приоритетного проекта научных исследований медицинских изделий, для которых в период с (i-5) года по (i-3) год в соответствии со сведениями о результатах научно-исследовательской, опытно-конструкторской и технологической работы гражданского назначения в ЕГИСУ НИОКТР был получен опытный (экспериментальный) образец (далее - Изделия), единиц;
Di - количество зарегистрированных в установленном порядке на конец i-го года медицинских изделий из числа Изделий, единиц.
10. При расчете Показателя за 2025 год значение Ai принимается равным нулю, значение Ci рассчитывается для 2022 года.
11. При расчете Показателя за 2026 год значение Ai, принимается равным нулю, значение Ci рассчитывается для 2022 и 2023 годов.
12. При расчете Показателя за 2027 год значение Ai рассчитывается для 2022 года.
13. При расчете Показателя за 2028 год значение Ai рассчитывается для 2022 и 2023 годов.
14. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральными государственными учреждениями, которым установлено государственное задание на выполнение прикладных научных исследований в области здравоохранения по коду подраздела классификатора расходов бюджетов 0908.
15. Верификация значения Показателя осуществляется на основании сведений, размещенных в ЕГИСУ НИОКТР, сведений реестров лекарственных средств, реестров медицинских изделий, реестра разрешений на применение незарегистрированных медицинских изделий для диагностики in vitro, сведений Государственного реестра изобретений Российской Федерации <8>, оперативные данные Министерства здравоохранения Российской Федерации.
--------------------------------
<8> Постановление Правительства Российской Федерации от 24 декабря 2015 г. N 1416 "О государственной регистрации распоряжения исключительным правом на изобретение, полезную модель, промышленный образец, товарный знак, знак обслуживания, зарегистрированные топологию интегральной микросхемы, программу для ЭВМ, базу данных по договору и перехода исключительного права на них без договора" (Собрание законодательства Российской Федерации, 2016, N 1, ст. 230; 2020, N 17, ст. 2773).
Приложение N 14
к приказу Министерства здравоохранения
Российской Федерации
от 26 октября 2022 г. N 700
МЕТОДИКА
РАСЧЕТА ПОКАЗАТЕЛЯ "ДОЛЯ ПАЦИЕНТОВ С B-КЛЕТОЧНЫМ ОСТРЫМ
ЛИМФОБЛАСТНЫМ ЛЕЙКОЗОМ, ДЛЯ КОТОРЫХ ПРИМЕНЕНИЕ CAR-T
ТЕРАПИИ ПОЗВОЛИТ ДОСТИЧЬ РЕМИССИИ"
1. Настоящая методика применяется для расчета показателя "Доля пациентов с B-клеточным острым лимфобластным лейкозом, для которых применение CAR-T терапии позволит достичь ремиссии" (далее - Показатель), включенного в перечень показателей федерального проекта "Медицинская наука для человека".
2. Федеральным органом исполнительной власти, ответственным за формирование и предоставление информации по показателю, является Министерство здравоохранения Российской Федерации.
3. Показатель рассчитывается в целом по Российской Федерации.
4. Информация по Показателю формируется и представляется ежегодно на последний календарный день отчетного года начиная с отчета за 2030 год не позднее 31 марта года, следующего за отчетным.
5. Для целей настоящей методики под ремиссией понимается ослабление или исчезновение признаков заболевания.
6. Значение Показателя Ni (процентов) для отчетного периода i-го года рассчитывается по формуле:
Ni = (Bi / Ai) * 100,
где
Ai - число пациентов с диагнозом острый лимфобластный лейкоз (код C91 <1>), которым оказана медицинская помощь с использованием T-клеток с химерным антигенным рецептором в период с 1 января i-го года на отчетную дату и для которых проведена оценка первичного ответа на полученное лечение (далее - Пациенты), человек;
--------------------------------
<1> Международная статистическая классификация болезней и проблем, связанных со здоровьем (10-й пересмотр).
Bi - число пациентов из числа Пациентов, достигших ремиссии заболевания <2> в i-ом году по результатам проведенной оценки первичного ответа на полученное лечение, человек.
--------------------------------
<2> Клинические рекомендации "Острые лимфобластные лейкозы".
7. Источником информации для формирования Показателя являются оперативные данные, предоставляемые федеральным государственным бюджетным учреждением "Национальный медицинский исследовательский центр гематологии" Министерства здравоохранения Российской Федерации, федеральным государственным бюджетным учреждением "Национальный медицинский исследовательский центр имени В.А. Алмазова" Министерства здравоохранения Российской Федерации, федеральным государственным бюджетным учреждением "Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева" Министерства здравоохранения Российской Федерации, федеральным государственным бюджетным учреждением "Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина" Министерства здравоохранения Российской Федерации, федеральным государственным бюджетным учреждением "Национальный медицинский исследовательский центр онкологии имени Н.Н. Петрова" Министерства здравоохранения Российской Федерации.
8. Верификация значения Показателя осуществляется главным внештатным специалистом гематологом Министерства здравоохранения Российской Федерации и главным внештатным детским специалистом онкологом-гематологом Министерства здравоохранения Российской Федерации.