См. Документы Министерства промышленности и торговли Российской Федерации
МИНИСТЕРСТВО ПРОМЫШЛЕННОСТИ И ТОРГОВЛИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 23 октября 2009 г. N 965
ОБ УТВЕРЖДЕНИИ СТРАТЕГИИ
РАЗВИТИЯ ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ
ФЕДЕРАЦИИ НА ПЕРИОД ДО 2020 ГОДА
С целью реализации единой государственной политики в решении проблемы динамичного развития фармацевтической промышленности Российской Федерации на период до 2020 года и в соответствии с поручением Правительства Российской Федерации от 9 октября 2009 года N ВП-П12-45пр приказываю:
1. Утвердить прилагаемую Стратегию развития фармацевтической промышленности на период до 2020 года.
2. Определить ответственным за реализацию Стратегии развития фармацевтической промышленности на период до 2020 года Департамент химико-технологического комплекса и биоинженерных технологий (С.А. Цыб).
3. Контроль за исполнением настоящего Приказа оставляю за собой.
Министр
В.Б.ХРИСТЕНКО
Утверждена
Приказом Минпромторга России
от 23 октября 2009 г. N 965
СТРАТЕГИЯ
РАЗВИТИЯ ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ
ФЕДЕРАЦИИ НА ПЕРИОД ДО 2020 ГОДА
Паспорт
Стратегии развития фармацевтической промышленности
Российской Федерации на период до 2020 года
───────────────────────────────────────────────────────────────────────────
Наименование Стратегия развития фармацевтической промышленности
Российской Федерации на период до 2020 года
───────────────────────────────────────────────────────────────────────────
Основание для 1. Поручение Правительства РФ N ВЗ-П12-1366 от 6 марта
разработки 2008 года о разработке стратегии развития
отечественной фармацевтической промышленности до
2020 года.
2. Протокол совещания у Председателя Правительства
Российской Федерации В.В. Путина от 19 июня 2008
года N ВП-П12-8пр.
Государственный Правительство Российской Федерации.
заказчик
Основной Министерство промышленности и торговли Российской
разработчик Федерации.
Цель Переход на инновационную модель развития
фармацевтической промышленности Российской Федерации.
Задачи 1. Увеличение обеспеченности населения, учреждений
системы здравоохранения и Вооруженных Сил Российской
Федерации, федеральных органов исполнительной
власти, в которых законом предусмотрена военная и
приравненная к ней служба, жизненно необходимыми и
важнейшими лекарственным средствами отечественного
производства, а также лекарственными средствами для
лечения редких заболеваний.
2. Повышение конкурентоспособности отечественной
фармацевтической промышленности путем гармонизации
российских стандартов по разработке и производству
лекарственных средств с международными требованиями.
3. Стимулирование разработки и производства
инновационных лекарственных средств и поддержка
экспорта российских лекарств, в том числе за счет
выработки дополнительных механизмов финансирования
оригинальных разработок.
4. Защита внутреннего рынка от недобросовестной
конкуренции и выравнивание условий доступа на рынок
для отечественных и зарубежных производителей.
5. Осуществление технологического перевооружения
российской фармацевтической отрасли.
6. Совершенствование системы подтверждения соответствия
качества лекарственных средств, включая меры по
устранению избыточных административных барьеров по
регистрации отечественных лекарств и обеспечение
надлежащего контроля за их качеством.
7. Совершенствование системы подготовки специалистов
для фармацевтической промышленности, в том числе
создание новых программ обучения в соответствии с
международными стандартами.
Сроки и этапы 2009 - 2020 годы, в том числе:
реализации - I этап: 2009 - 2012 годы;
- II этап: 2013 - 2017 годы;
- III этап: 2018 - 2020 годы.
───────────────────────────────────────────────────────────────────────────
Перечень основных Стимулирование локализации на территории РФ
мероприятий высокотехнологичных производств лекарственных препаратов.
Стимулирование организации производства
высокотехнологичных химических и биотехнологических
субстанций на территории Российской Федерации.
Стимулирование обязательного перехода отечественных
предприятий фармацевтической промышленности на
стандарты GMP не позднее 2011 года.
Стимулирование разработки и производства аналогов
импортируемых дженериковых и инновационных
лекарственных средств.
Разработка новых и модификация существующих
образовательных программ и программ повышения
квалификации для обеспечения фармацевтической
промышленности кадрами нового типа.
Обеспечение лекарственной безопасности Российской
Федерации.
Исполнители Минпромторг России, Минздравсоцразвития России,
Минэкономразвития России, Минобрнауки России,
Федеральная антимонопольная служба России, Федеральная
таможенная служба России, Федеральная служба по тарифам
России, Министерство внутренних дел России, Федеральная
служба безопасности России, Минобороны России,
Министерство по чрезвычайным ситуациям России,
Министерство иностранных дел России, Федеральная служба
по контролю за оборотом наркотиков России и другие
заинтересованные федеральные агентства, ведомства и
исполнительные органы власти субъектов Российской
Федерации.
Объемы и Всего на 2009 - 2020 годы предусматривается 177 620
источники млн. рублей (в ценах февраля 2009 г.), в том числе:
финансирования по направлению "Повышение квалификации кадров и
создание инфраструктуры":
- 35 220 млн. рублей;
- по направлению "Переход на GMP":
- 36 000 млн. рублей;
- по направлению "Разработка лекарственных средств":
- 106 400 млн. рублей.
Ожидаемые 1. Увеличение доли продукции отечественного
конечные производства в общем объеме потребления на
результаты внутреннем рынке до 50% в стоимостном выражении к
реализации 2020 году.
Стратегии 2. Изменение номенклатуры производства лекарственных
препаратов, произведенных на территории Российской
Федерации, в том числе увеличение доли инновационных
препаратов в портфелях локальных производителей до
60% в стоимостном выражении.
3. Увеличение экспорта фармацевтической продукции в 8
раз по сравнению с 2008 годом.
4. Обеспечение лекарственной безопасности Российской
Федерации согласно перечню жизненно необходимых и
важнейших лекарственных средств.
5. Стимулирование организации производства
фармацевтических субстанций на территории Российской
Федерации в размере, необходимом для обеспечения
выпуска 50% готовых лекарственных форм в денежном
выражении, включая не менее 85% по номенклатуре из
списка стратегических ЛС.
Система Контроль за реализацией осуществляет Минпромторг
организации России.
контроля за
исполнением
───────────────────────────────────────────────────────────────────────────
Введение
Стратегия развития фармацевтической промышленности России на период до 2020 года (далее - Стратегия) разработана на основании:
- протокола совещания у Первого заместителя Председателя Правительства Российской Федерации Д.А. Медведева от 22 марта 2007 года N ДМ-П12-9пр "О мерах по развитию отечественной фармацевтической промышленности";
- послания Президента Российской Федерации В.В. Путина Федеральному Собранию Российской Федерации от 26 апреля 2007 года в части, касающейся демографической ситуации в Российской Федерации и развития высокотехнологичных отраслей промышленности;
- поручения Правительства РФ N ВЗ-П12-1366 от 6 марта 2008 года о разработке стратегии развития отечественной фармацевтической промышленности до 2020 года;
- протокола совещания у Председателя Правительства Российской Федерации В.В. Путина от 19 июня 2008 года N ВП-П12-8пр.
Стратегия предназначена:
- определять приоритетные направления развития фармацевтической промышленности Российской Федерации (далее - фармацевтической промышленности) и пути их реализации;
- быть концептуальной основой для государственно-частного партнерства по вопросам развития фармацевтической промышленности;
- обеспечивать согласованность действий органов государственной власти различных уровней по направлениям развития отрасли в долгосрочной перспективе;
- определять стратегический вектор для разработки и корректировки нормативно-правовой базы фармацевтической промышленности;
- служить основой для принятия решений на государственном уровне по разработке и реализации целевых программ и проектов развития фармацевтической промышленности.
1. Общие положения
1.1. Цели, задачи и приоритеты государственной политики Российской Федерации по развитию национальной фармацевтической промышленности
Основной целью государственной политики Российской Федерации по развитию национальной фармацевтической промышленности на период до 2020 года является создание условий для ее перехода на инновационную модель развития, что должно привести к росту обеспеченности населения, учреждений здравоохранения и Вооруженных Сил Российской Федерации, федеральных органов исполнительной власти, в которых законом предусмотрена военная и приравненная к ней служба, лекарственными средствами отечественного производства, при общем увеличении обеспеченности нуждающихся лекарствами до среднеевропейского уровня как по количественным, так и по качественным показателям.
Основными задачами Стратегии являются:
1. увеличение обеспеченности населения, учреждений системы здравоохранения и Вооруженных Сил Российской Федерации, федеральных органов исполнительной власти, в которых законом предусмотрена военная и приравненная к ней служба, жизненно необходимыми и важнейшими лекарственным средствами отечественного производства, а также лекарственными средствами для лечения редких заболеваний;
2. повышение конкурентоспособности отечественной фармацевтической промышленности путем гармонизации российских стандартов по разработке и производству лекарственных средств с международными требованиями;
3. стимулирование разработки и производства инновационных лекарственных средств;
4. защита внутреннего рынка от недобросовестной конкуренции и выравнивание условий доступа на рынок для отечественных и зарубежных производителей;
5. осуществление технологического перевооружения российской фармацевтической отрасли;
6. совершенствование системы подтверждения соответствия качества лекарственных средств, включая меры по устранению избыточных административных барьеров по регистрации отечественных лекарств;
7. подготовка специалистов для разработки и производства фармацевтической продукции в соответствии с международными стандартами.
Стратегия развития национальной фармацевтической промышленности основывается на следующих приоритетах:
- приоритет инновационной модели развития отрасли;
- приоритет качества, эффективности и безопасности лекарственных средств;
- приоритет национальной фармацевтической отрасли в реализации государственных программ в области обеспечения лекарственными средствами;
- приоритет производства высокотехнологичных фармацевтических субстанций на территории РФ;
- приоритет развития экспортоспособных производств и новых разработок;
- приоритет замещения импортных лекарственных средств отечественными, полный цикл производства которых находится на территории РФ;
- приоритет фармацевтической продукции, произведенной на территории РФ, в закупках по перечню жизненно необходимых и важнейших лекарственных средств, а также при осуществлении поставок лекарств для Вооруженных Сил Российской Федерации, федеральных органов исполнительной власти, в которых законом предусмотрена военная и приравненная к ней служба.
1.2. Ожидаемые результаты реализации Стратегии
Ожидаемым результатом реализации Стратегии развития фармацевтической промышленности Российской Федерации на период до 2020 года должно стать:
- увеличение доли продукции отечественного производства в общем объеме потребления на внутреннем рынке до 50% в стоимостном выражении к 2020 году;
- изменение номенклатуры производства лекарственных препаратов, произведенных на территории Российской Федерации, в том числе увеличение доли инновационных препаратов <*> в портфелях локальных производителей до 60% в стоимостном выражении;
--------------------------------
<*> Инновационный препарат (инновационное лекарственное средство) - лекарственное средство, активная фармацевтическая субстанция которого защищена патентом и/или запатентованы технологии получения готовой лекарственной формы и/или способа доставки.
- увеличение экспорта фармацевтической продукции в 8 раз по сравнению с 2008 годом;
- обеспечение лекарственной безопасности Российской Федерации согласно номенклатуре стратегически важных лекарственных средств и вакцин;
- стимулирование организации производства фармацевтических субстанций на территории Российской Федерации в размере, необходимом для обеспечения выпуска 50% готовых лекарственных форм в денежном выражении, включая не менее 85% по номенклатуре из списка стратегических ЛС.
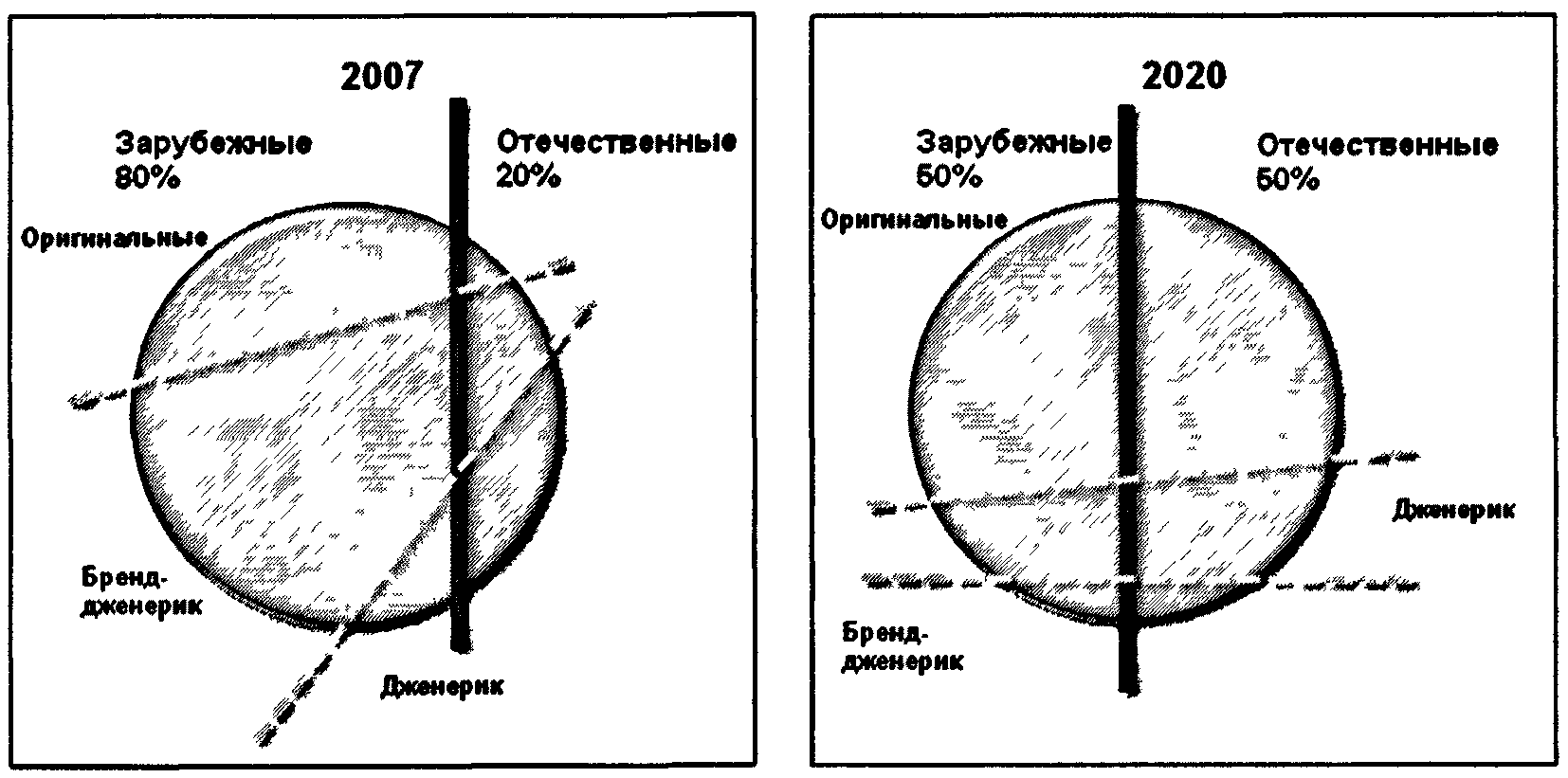
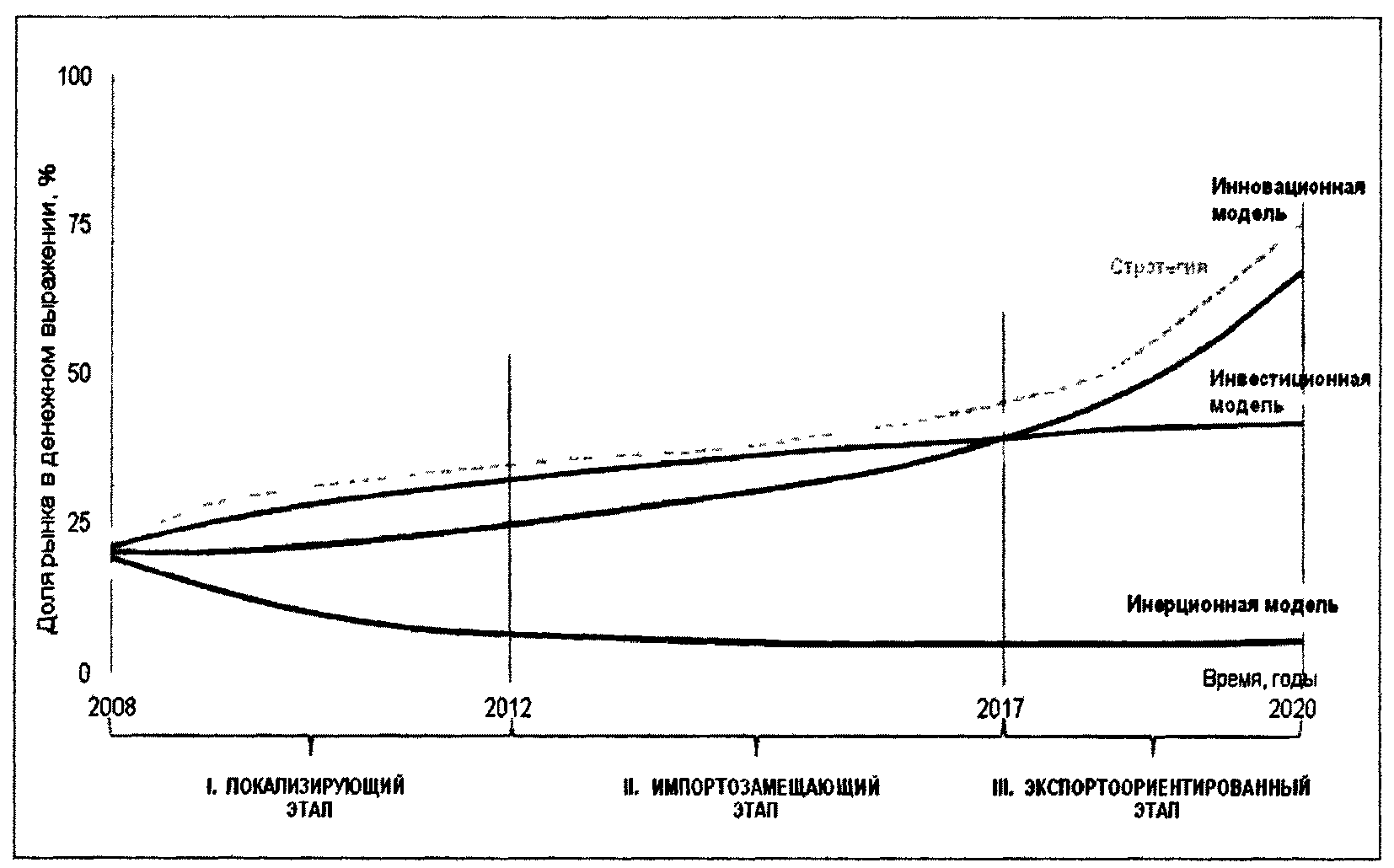
Рисунок 1.1. Доля рынка продукции отечественного
и зарубежного производства в 2007 году и планируемая
Стратегией к 2020 году
2. Анализ состояния фармацевтической промышленности
Российский фармацевтический рынок представляет собой один из наиболее динамичных и быстрорастущих мировых рынков (рисунок 2.1). Продажи фармацевтической продукции в Российской Федерации в 2007 году составили в конечных ценах потребления около 298 млрд. рублей, в 2008 - около 360 млрд. рублей. При этом весьма значительным является потенциал роста рынка: ежегодный рост не менее 10 - 12% в год в рублях с 2003 года. В результате объем рынка с учетом финансово-экономической ситуации достигнет 400 - 500 млрд. рублей к 2011 году и 1000 - 1500 млрд. рублей к 2020 году (конечная стоимость для потребителей). При выполнении государственной задачи достижения среднеевропейского уровня потребления лекарственных средств на душу населения и увеличения численности населения согласно Концепции долгосрочного социально-экономического развития Российской Федерации на период до 2020 г. до 142 - 145 млн. размер фармацевтического рынка достигнет 1,5 трлн. рублей к 2020 г.
Рисунок 2.1. Динамика роста российского фармацевтического
рынка в 2004 - 2007 годах и прогнозы роста до 2020 года
(млрд. рублей, цены конечного потребления, с учетом НДС)
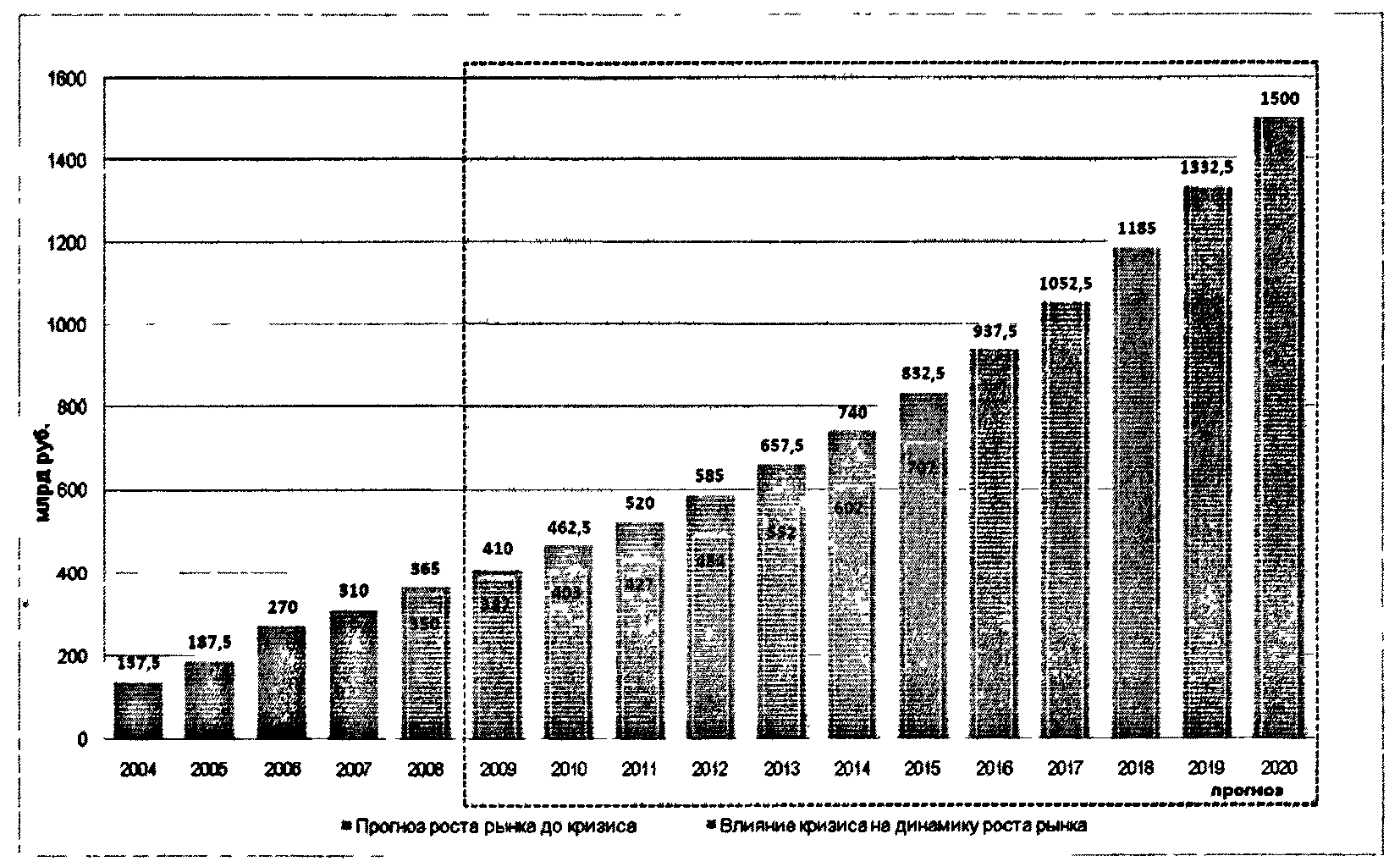
Благодаря государственным программам в течение двух последних лет показатель ежегодного прироста потребления лекарств составляет около 26%. В то же время, потребление готовых лекарственных средств российского производства на фоне роста рынка падают на 1 - 2% в год и в 2008 году составили лишь 19% в денежном выражении.
Структура российского рынка значительно отличается от рынков развитых стран в сторону преобладания "брендированных" дженериков <*>, в основном иностранного производства. Результатом является переплата конечным потребителем (в том числе и государством) за торговые названия препаратов, подчас морально устаревших, что значительно затормаживает рост доступности лекарственных препаратов для населения. В силу недостаточной развитости системы здравоохранения основным покупателем лекарственных препаратов зачастую выступает сам пациент, осуществляющий непрофессиональный выбор, преимущественно под действием рекламы. Сложившаяся система продвижения стимулирует фармпроизводителей вкладывать больше средств в маркетинг и продажи, а не в разработку новых эффективных препаратов, что существенно замедляет развитие отрасли по инновационному сценарию.
--------------------------------
<*> Бренд-дженерик - лекарственное средство, у которого действующее вещество (субстанция) вышло из-под патентной защиты, но активно продвигается торговое наименование.
Российская фармацевтическая отрасль, проигрывая в валовой доходности, тем не менее, в среднем на 68% обеспечивает отечественное здравоохранение лекарственными средствами в натуральных показателях; в госпитальном секторе этот показатель достигает 72%. При этом основную часть продуктовых портфелей отечественных производителей составляют низкорентабельные дженериковые препараты, что не позволяет фармпроизводителям выделять на исследования и разработки более 1 - 2% от своей выручки. Для сравнения, фармпроизводители в США и Западной Европе выделяют 10 - 15%, что позволяет им формировать более половины своих продуктовых портфелей за счет инновационных препаратов.
Рисунок 2.2. Доля рынка продукции отечественного
и зарубежного производства в 2007 году
по патентному статусу

На начало 2008 года в отрасли насчитывалось около 600 предприятий, имеющих лицензии на производство лекарственных средств. При этом на долю 10 наиболее крупных заводов приходилось более 30% всех выпускаемых в России лекарств в денежном выражении. Реальный потенциал потребления лекарственных средств, производимых национальной отраслью, составляет не более 10 - 15% рынка в денежном выражении и не более 50 - 60% - в товарном, что свидетельствует о наличии тенденции к дальнейшему отставанию российской фармацевтической промышленности.
В настоящее время российская фармацевтическая промышленность использует около 8 тысяч условных тонн субстанций в год, из которых около 1,7 - 1,9 тысяч условных тонн производят российские предприятия. Доля высокотехнологичных субстанций (более 6 стадий синтеза) составляет 35% (в том числе 15%, произведенных в РФ) в количественном выражении и 34% (в том числе 5%, произведенных в РФ) в денежном, а доля биотехнологических, соответственно, - 39% в денежном выражении, из которых в РФ производится всего 2%. Образующийся дефицит закрывается импортом субстанций, при этом основными странами, из которых происходят поставки на российский рынок, являются Китай и Индия (суммарно около 70% от всего импорта субстанций в 2007 году). Для сравнения, в 1992 году в России производилось 272 наименования фармацевтических субстанций общим объемом около 17 тысяч условных тонн, при этом удовлетворение потребности производства ГЛС на внутреннем рынке в разных группах составляло от 70% до 100%; кроме того, значительная часть производимых субстанций экспортировалась в страны СЭВ. За период с 1992 по 2008 годы объем производства субстанций в Российской Федерации сократился более чем в 20 раз (рис. 2.3).
Рисунок 2.3. Темпы падения производства
субстанций по годам
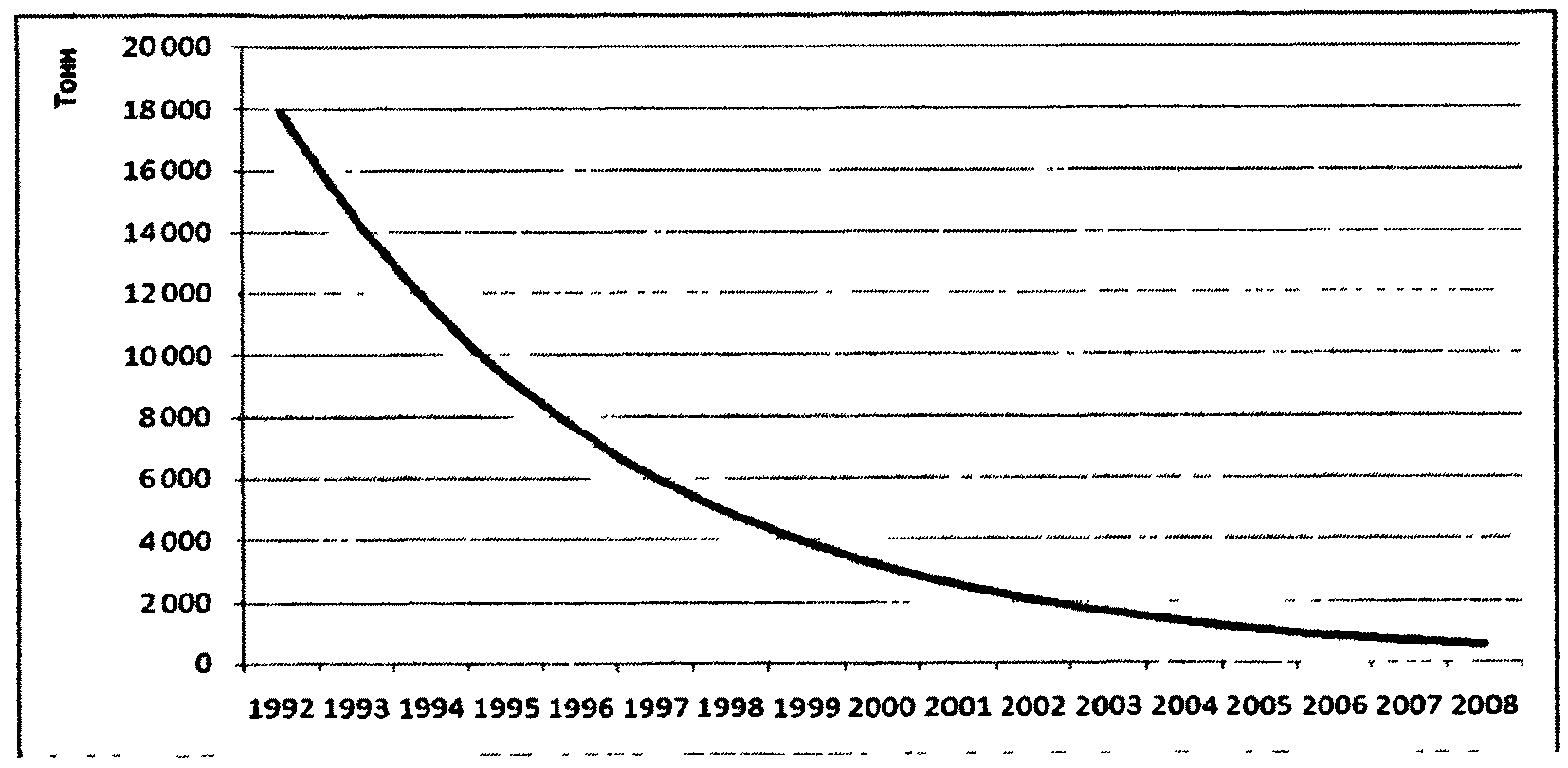
При этом необходимо отметить, что субстанции, произведенные в развитых странах по стандартам GMP <*>, имеют цены, сопоставимые или даже более высокие по сравнению с ценами на субстанции, произведенные в РФ. Конкурировать российским производителям субстанций приходится в основном с теми производствами из развивающихся стран, которые не имеют GMP-сертификации и которые проводят демпинговую политику.
--------------------------------
<*> Стандарт GMP ("Good Manufacturing Practice", Надлежащая производственная практика) - система норм, правил и указаний в отношении производства лекарственных средств, медицинских устройств, изделий диагностического назначения, продуктов питания, пищевых добавок и активных ингредиентов. В отличие от процедуры контроля качества путем исследования выборочных образцов таких продуктов, которая обеспечивает пригодность к использованию лишь самих этих образцов (и, возможно, партий, изготовленных в ближайшее к данной партии время), стандарт GMP отражает целостный подход, поскольку регулирует и оценивает собственно параметры производства и лабораторной проверки. Стандарты GMP приняты как обязательные для исполнения в большинстве развитых стран, например, в США, странах ЕС и Японии.
Российская фармацевтическая отрасль практически не представлена на международных рынках. Экспорт готовых лекарственных средств и фармацевтических субстанций из Российской Федерации в 2007 году составил около 6 млрд. рублей, что составляет менее 0,04% общемирового объема продаж фармацевтической продукции. Учитывая, что российский фармацевтический рынок в ближайшее десятилетие может стать одним из крупнейших в Европе, сложившаяся ситуация выглядит тем более несправедливой.
Во многом экспорту отечественных лекарственных средств мешает отсутствие стандартов, гармонизированных с международными правилами GMP, которые регулируют производство и контроль качества лекарственных средств и являются обязательными для фармацевтической промышленности.
Вопрос о принятии гармонизированной с ЕС национальной Фармакопеи также остается открытым. В настоящее время каждое предприятие использует свои фармакопейные статьи, что вызывает регуляторные проблемы.
3. Проблемы фармацевтической отрасли
3.1. Определение системных проблем
Следует отметить две системные проблемы российской фармацевтической промышленности.
(1) Неспособность обеспечивать население Российской Федерации основной номенклатурой современных лекарственных препаратов, весь цикл производства которых находился бы на территории РФ (неспособность обеспечить в текущий момент времени).
(2) Низкий уровень инноваций и технологий, используемых при разработке и производстве ЛС (неспособность обеспечить в "перспективе"). Эта общая проблема российской экономики особенно актуальна для фармацевтического сектора.
(3) Низкий уровень обеспечения лекарственной безопасности Российской Федерации, в том числе Вооруженных Сил Российской Федерации, по номенклатуре лекарственных средств, используемых в военное время для оказания медицинской помощи и лечения пораженных ионизирующим излучением и боевыми отравляющими веществами.
3.2. Составляющие факторы системных проблем
3.2.1. Дисбаланс регуляторных требований к отечественным и зарубежным предприятиям-производителям
Регуляторные процедуры, предусмотренные законодательством для отечественных и иностранных производителей, в целом различны. Например, процедуры регистрации фармацевтических субстанций в настоящее время являются существенно более сложными и длительными для отечественных производителей по сравнению с зарубежными. Так, порядок выдачи лицензий на производство субстанций отечественным производителям предполагает физический контроль всего производственного цикла (а также проведение последующих проверок на соответствие лицензионных требований и условий каждые 2 года), в то время как зарубежным надлежит только ознакомиться с документацией. Следует отметить, что отдельной процедуры регистрации субстанций в странах ЕС и США вообще не существует.
3.2.2. Экономическая демотивация отечественных производителей
Высокий уровень инфляции, укрепление рубля, высокие ставки процентов по кредитам, рост тарифов на энергоносители, высокая стоимость капитального строительства в силу географического расположения, демпинговая политика азиатских государств - все эти факторы изначально ставили локального производителя в неравные конкурентные условия с зарубежным и, по экспертным оценкам, снижали конкурентную способность отечественных фармпроизводителей до 50%. Однако вызванное общемировым кризисом ослабление рубля в настоящий момент отчасти снимает данные проблемы и создает предпосылки для более ускоренного импортозамещения.
Без учета НДС и подоходного налога на заработную плату российские компании выплачивают по налогам 12 - 14% от объема продаж; зарубежные компании, не имеющие представительств в России, оплачивают только незначительный таможенный сбор (от 0 до 10%).
Система преференций для малого бизнеса в государственных закупках лекарственных средств в отличие от других развитых стран реализуется неэффективно.
3.2.3. Дефицит высококвалифицированных кадров для фармацевтической отрасли
Из-за отсутствия масштабного спроса со стороны индустрии в России практически отсутствует подготовка высококвалифицированных кадров для современного фармпроизводства и индустриальной науки. Налаживание опережающей подготовки и переподготовки таких специалистов является ключевым условием успешной реализации настоящей Стратегии. Эта задача приобретает особую актуальность, учитывая ситуативное, связанное с кризисным периодом, высвобождение трудовых ресурсов, которые могут быть задействованы в фармацевтическом производстве.
Одной из важнейших проблем подготовки кадров для отечественной фарминдустрии является чрезвычайно низкий уровень оплаты труда профессорско-преподавательского состава ВУЗов. Все это приводит к оттоку квалифицированных кадров в другие сферы деятельности и за границу, к утрате традиций и уровня преподавания из-за ухода пожилых преподавателей, не имеющих возможности передавать свою квалификацию молодой смене.
Серьезной проблемой является недостаточная практическая подготовка выпускников - следствие как неразвитой материально-технической базы ВУЗов, так и недоработок в содержательном аспекте базовой программы. Эти же проблемы характерны для послевузовского и дополнительного этапов образования. Следствием оттока молодых преподавателей в другие области хозяйства является низкая ориентированность ВУЗов на восприятие к обучению новым направлениям науки и технологии, постоянно появляющимся в мире.
3.2.4. Отсутствие механизмов финансирования разработок лекарственных средств
Без наличия достаточного объема высокорентабельных инновационных препаратов в своих продуктовых портфелях российские фармацевтические производители вынуждены конкурировать за счет цены и рекламы, что, соответственно, снижает объемы средств на разработку новой продукции.
В сложившейся ситуации российская фарминдустрия не сможет выжить, будучи зажата между западными транснациональными корпорациями, диктующими правила игры в сфере технологий и интеллектуальной собственности, и производителями из Индии и Китая с их беспрецедентным ценовым давлением. Ни зарождающиеся отечественные компании-разработчики лекарств, ни создаваемые венчурные фонды пока не готовы финансировать долгосрочные и рискованные по своей природе разработки инновационных фармацевтических препаратов. Существующий частный бизнес и венчурные инвесторы участвуют в развитии лишь тех подсекторов, которые дают прибыль в короткие сроки и не требуют крупных рискованных инвестиций (аптечные сети, фабрики по производству готовых лекарственных форм, биологически активных добавок и др.). Фактически речь идет о разрывах в критических цепочках взаимодействий, обеспечивающих непрерывное функционирование инновационной системы по созданию новых отечественных препаратов. Более того, недофинансирование ранних стадий разработки новых лекарств в виде грантов и посевного финансирования приводит к фактическому отсутствию отраслевой науки. Однако необходимо отметить, что идущий мировой кризис создает дополнительные возможности для российской фарминдустрии по трансферу в Россию западных разработок, остановленных из-за недофинансирования, на очень выгодных условиях. Эти возможности могут быть реализованы только при комплексной (финансовой и организационной) поддержке со стороны государства и привлечению ключевых институтов развития, таких как ГК "Роснанотех" и ОАО "РВК" (создание корпоративных венчурных фондов), ГК "Банк развития и внешнеэкономической деятельности (Внешэкономбанк)" (инвестиционное финансирование) и ГК "Ростехнологии" (содействие разработке и производству).
3.2.5. Недостаточный уровень российского патентного законодательства и законоприменительной практики относительно международных стандартов
Несмотря на отмечаемые многими экспертами улучшения в области защиты интеллектуальной собственности, российские организации и институты, работающие в этой сфере, пока не готовы адекватно отвечать на требования времени.
3.2.6. Отсутствие обязательных для исполнения правил производства и контроля качества лекарственных средств, идентичных международным правилам GMP
Несмотря на то, что Госстандартом России утвержден национальный стандарт ГОСТ Р 52249-2004 "Правила производства и контроля качества лекарственных средств" (стандарт является идентичным переводом Правил GMP Европейского союза), до сих пор вопрос об обязательности правил GMP, идентичных международным, остается открытым, что тормозит не только выпуск более качественной продукции для отечественного потребителя, но и ее выход на международные рынки.
3.3. Выводы
Указанные проблемы ведут к тому, что при нынешнем инерционном сценарии развития, несмотря на имеющиеся позитивные предпосылки, включая повышение конкурентоспособности отечественных производителей за счет ослабления рубля, в России в обозримом будущем могут перестать существовать как базовый производственный сектор, производящий лекарственные субстанции, так и сопряженный с ним научно-технологический сектор.
4. Альтернативные сценарии развития
В рамках Стратегии рассматриваются и моделируются два сценария развития фармацевтической отрасли - инерционный и инновационный. Исходные показатели для макроэкономического моделирования взяты из утвержденной Концепции долгосрочного социально-экономического развития Российской Федерации и Концепции демографической политики Российской Федерации на период до 2025 г.
Во внимание принято влияние международного финансово-экономического кризиса. В ближнесрочной перспективе реакция на кризисные явления ставит вопрос о повышении эффективности государственных расходов на здравоохранение и лекарственное обеспечение, в том числе в части переориентации государственных закупок на продукцию отечественных производителей. Возможно значительное уменьшение коммерческого сектора в долларовом эквиваленте (и увеличение в рублевом) за счет ослабления рубля и высокой доли продукции импортных производителей. Однако следует учесть, что лекарственные средства являются товарами неэластичного спроса, в связи с чем прогнозируется их стабильное потребление даже с учетом уменьшения доходов населения (см. рис. 4.1).
Рисунок 4.1. Прогноз потребления лекарственных препаратов
на душу населения

4.1. Инерционный сценарий
Инерционный сценарий соответствует пассивной стратегии государства по отношению к фармацевтической отрасли. Данный сценарий является прогнозом развития отрасли без учета государственных инвестиций и увеличения государственных закупок продукции отечественных производителей и базируется на предположении об активном развитии деятельности международных фармацевтических компаний на рынке РФ. Объем рынка и его структура при инерционном сценарии развития до кризиса и с учетом последствий кризиса отражены на рисунках 4.2 - 4.3.
Рисунок 4.2. Прогноз развития фармацевтического рынка РФ
в случае инерционного сценария

Рисунок 4.3. Доли рынка отечественных и зарубежных
лекарственных средств в случае инерционного сценария
(в денежном выражении)

Основываясь на долгосрочных прогнозах роста ВВП РФ и доходов населения, можно прогнозировать, что объем российского рынка лекарственных средств, несмотря на инерционный сценарий развития и замедление темпов роста в ближайшие три года, к 2020 году увеличится более чем в 2,5 раза, существенно повысится доля препаратов доказательной медицины, инновационных препаратов и высококачественных дженериков. Однако следует отметить, что указанный рост будет происходить в основном за счет импорта, а доля низкорентабельной, дешевой и менее эффективной отечественной продукции будет неуклонно снижаться. В случае инерционного сценария развития потребность в оригинальных ЛС будет покрыта на 100% за счет импорта. В целом можно констатировать, что доля импорта лекарственных препаратов составит более 85% от общего количества потребляемых лекарственных препаратов (рисунок 4.3). Локальное фармацевтическое производство и связанная с ним прикладная наука практически прекратят свое существование.
4.2. Инновационный сценарий
Инвестиционная модель соответствует умеренному участию государства в развитии и стимулировании фармацевтической отрасли, базируется, в том числе, на осуществлении регуляторных мероприятий по локализации производства современных дженериковых и инновационных препаратов на территории РФ и стимулировании лицензионного производства препаратов, не имеющих дженериковых аналогов и доказавших свою клиническую эффективность. Эта модель развития отечественной фармацевтической промышленности приведет к увеличению доли и конкурентоспособности локальной продукции на внутреннем рынке, но не приведет к созданию собственных прорывных технологий и продуктов, обладающих значительным экспортным потенциалом.
Инновационная модель развития отрасли возможна при условии, что государство возьмет на себя основную нагрузку по запуску инновационного цикла в отрасли с последующим нарастающим рефинансированием исследований и разработок за счет средств индустрии. Залогом успеха реализации данной модели является:
- решение кадрового вопроса;
- создание рынка инновационных проектов (слоя малых инновационных предприятий между наукой и производством);
- масштабный рост государственных и частных инвестиций в ориентированные на импортозамещение НИР и НИОКР;
- масштабная технологическая модернизация и развитие производства в соответствии с международными стандартами;
- возрастание инновационной активности индустрии;
- использование зарубежного научно-технического и производственно-технологического потенциала путем привлечения прямых иностранных инвестиций в производство и разработку лекарственных средств.
Основные количественные оценки объемов рынка и его структуры по патентному статусу приведены на рисунках 4.4 - 4.5.
Рис. 4.4. Прогноз развития фармацевтического рынка РФ
в случае инновационного сценария
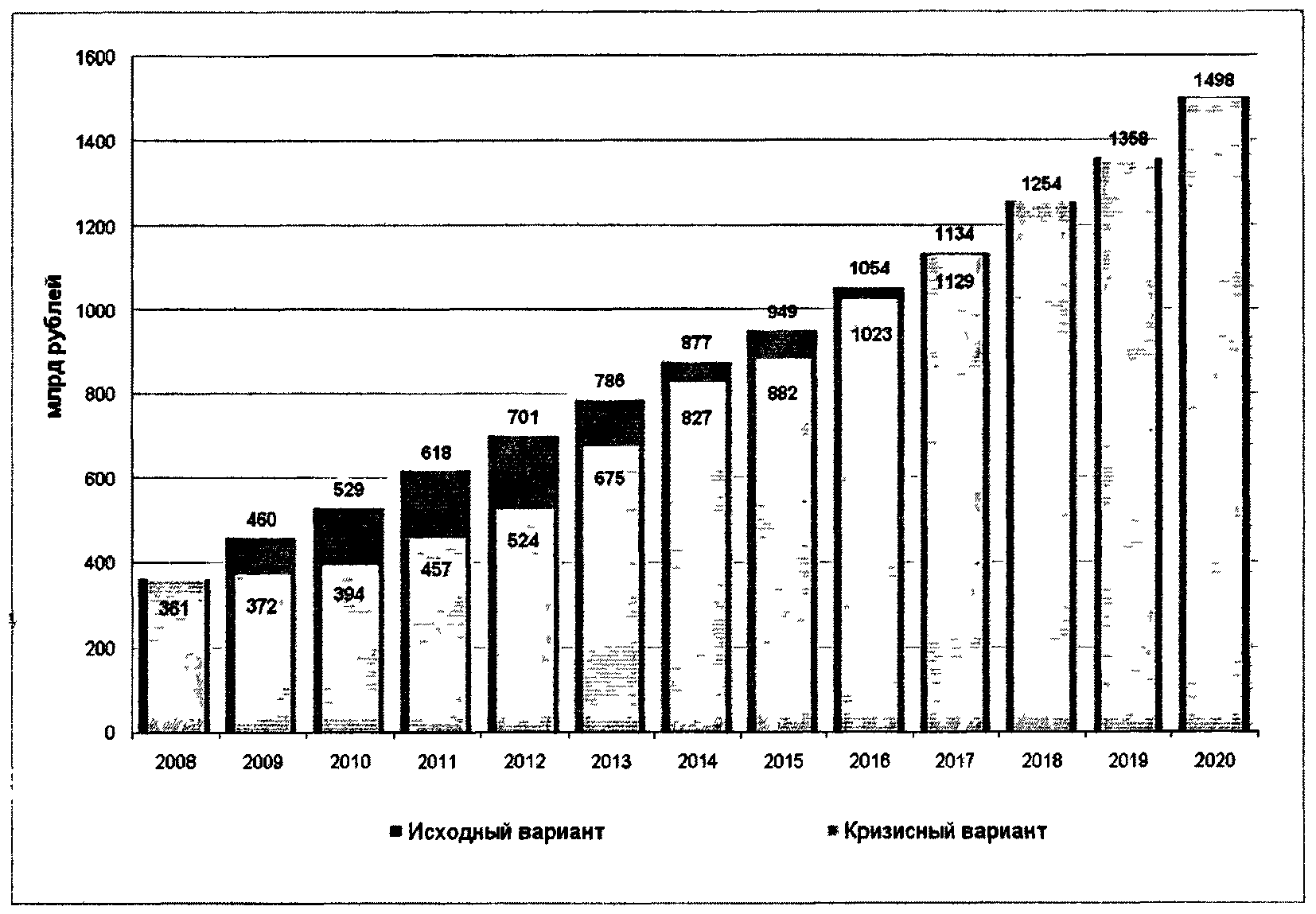
Рис. 4.5. Доля рынка отечественных и зарубежных
лекарственных средств в случае инновационного сценария

4.3. Выбор способа решения проблемы и ожидаемый результат реализации Стратегии
Инерционный сценарий приведет уже в 2011 - 2012 годах к стагнации российского фармацевтического производства, вытеснению отечественных компаний с внутреннего и внешнего рынков, углублению производственно-технологического и научно-технического отставания от мирового уровня, утрате отечественного научного потенциала и полной потере лекарственной независимости. Очевидно, что такой сценарий является неприемлемым для российского государства и промышленности, особенно в свете заметного опережающего роста российского рынка лекарственных препаратов.
Инвестиционная модель позволит в кратчайшие сроки локализовать производство лекарственных препаратов на территории РФ, привлечь инвестиции в модернизацию существующих производственных активов и строительство новых предприятий. Результатом такой модели развития станет преобладание локального производителя в секторе качественных дженериков и небольшая доля (до 10 - 20%) в секторе инновационных препаратов. Однако потенциал развития отрасли по данной модели будет исчерпан ориентировочно к 2017 году и потребуется собственная инновационная продукция, создание которой может занять до 7 - 10 лет.
Инновационная модель позволит инициировать в России разработку и производство высокотехнологичной фармацевтической продукции, повысить уровень отечественной фармацевтики до мирового и успешно конкурировать с зарубежными производителями как на внутреннем, так и на внешнем рынках. Новый импульс к развитию получит российская прикладная наука и инженерия.
Оптимальной стратегией для решения поставленных задач представляется реализация Инновационного сценария развития отрасли:
- на первом этапе будут реализованы мероприятия "Инвестиционной модели" с параллельным запуском отраслевого инновационного цикла (рисунки 4.6 - 4.7);
- это позволит на втором этапе масштабно локализовать высокотехнологическое производство и разработку;
- что даст возможность на третьем этапе, когда будет исчерпан потенциал развития за счет инвестиционной модели, перейти на инновационную модель развития отрасли, внедряя разработанный к тому моменту портфель собственной инновационной продукции.
Рисунок 4.6. Дорожная карта развития фармацевтической
промышленности до 2020 года
Необходимо отметить, что мировой кризис может отложить запуск инновационного цикла со стороны государства на несколько лет, однако эти инвестиционные потери могут частично быть компенсированы за счет более активного привлечения лицензий на незавершенные западные разработки, а также за счет более быстрого наращивания финансовых ресурсов отечественной индустрией в силу ускоренной кризисом локализации производств.
Рисунок 4.7. Основные группы мероприятий
для реализации Стратегии
2008 2012 2017 2020
│ │ │
┌──────┬───────────────────────────┼──┐ │ │
│Группа│┌─────────────────────────┐│ │ │ │
│меро- ││I.1. Размещение высоко- ││ │ │ │
│прия- ││технологичных производств>│ > │ │
│тий ││на территории РФ ││ │ │ │
│N 1 │└─────────────────────────┘│ │ │ │
└──────┼───────────────────────────┼──┘ │ │
│ │ │ │
┌──────┼───────────────────────────┼──────────────────────────────┼──┐ │
│ │┌────────────────────────────────────────────────────────┐│ │ │
│ ││II.1. "Дженериковое" импортозамещение >│ │ │
│Группа│└──────────────────────────┬─────────────────────────────┘│ │ │
│меро- │┌──────────────────────────┴─────────────────────────────┐│ │ │
│прия- ││II.2. Покупка лицензий >│ > │
│тий │└──────────────────────────┬─────────────────────────────┘│ │ │
│N 2 │┌──────────────────────────┴─────────────────────────────┐│ │ │
│ ││II.3. Обеспечение национальной лекарственной >│ │ │
│ ││независимости ││ │ │
│ │└──────────────────────────┬─────────────────────────────┘│ │ │
└──────┼───────────────────────────┼──────────────────────────────┼──┘ │
│ │ │ │
│ │ │ │
┌──────┼───────────────────────────┼──────────────────────────────┼────┼──┐
│ │┌──────────────────────────┴──────────────────────────────┴───┐│ │
│Группа││III.1. Разработка инновационных препаратов, аналогов, >│ │
│меро- ││находящихся под патентом ││ │
│прия- │└──────────────────────────┬──────────────────────────────┬───┘│ >
│тий │┌──────────────────────────┴──────────────────────────────┴───┐│ │
│N 3 ││III.2. Разработка инновационных препаратов, не имеющих >│ │
│ ││аналогов ││ │
│ │└──────────────────────────┬──────────────────────────────┬───┘│ │
└──────┼───────────────────────────┼──────────────────────────────┼────┼──┘
5. Оценка рисков
Реализация Стратегии развития фармацевтической промышленности Российской Федерации на период до 2020 года сопряжена с рисками, которые могут препятствовать достижению запланированных результатов.
Инфраструктурные риски. Отсутствие достаточного количества современных предприятий и научно-исследовательских центров и выстроенной системы кооперации науки и бизнеса.
Техногенные и экологические риски. С учетом того, что степень износа основных фондов составляет 60%, велика вероятность техногенных аварий и нанесения ущерба окружающей среде.
Недостаточный уровень финансирования научных исследований. Недофинансирование НИР и НИОКР будет сдерживать разработку и внедрение новых продуктов и технологий.
Законодательные риски. Несовершенства в законодательной сфере ограничивают способность хозяйствующих структур эффективно реагировать на меняющуюся рыночную ситуацию с учетом перспектив, возможностей и потребностей развития.
Кадровые риски. Решение задач Стратегии потребует притока высококвалифицированных кадров и переподготовки имеющихся специалистов. Недостаточно эффективное решение этих задач способно воспрепятствовать реализации настоящей Стратегии.
Макроэкономические риски. Снижение темпов роста экономики и уровня инвестиционной активности, высокий уровень инфляции или чрезмерное укрепление курса национальной валюты, возможность ухудшения внутренней и внешней конъюнктуры цен на сырье и технологии, последствия мирового финансово-экономического кризиса.
Глобальные риски. Настоящая Стратегия в целом исходит из того, что модель мирового развития фарминдустрии вообще и Российской промышленности в частности будет носить линейный характер до 2020 года и останется одной из самых инновационно емких отраслей мировой экономики.
6. Основные мероприятия и ожидаемые результаты реализации Стратегии
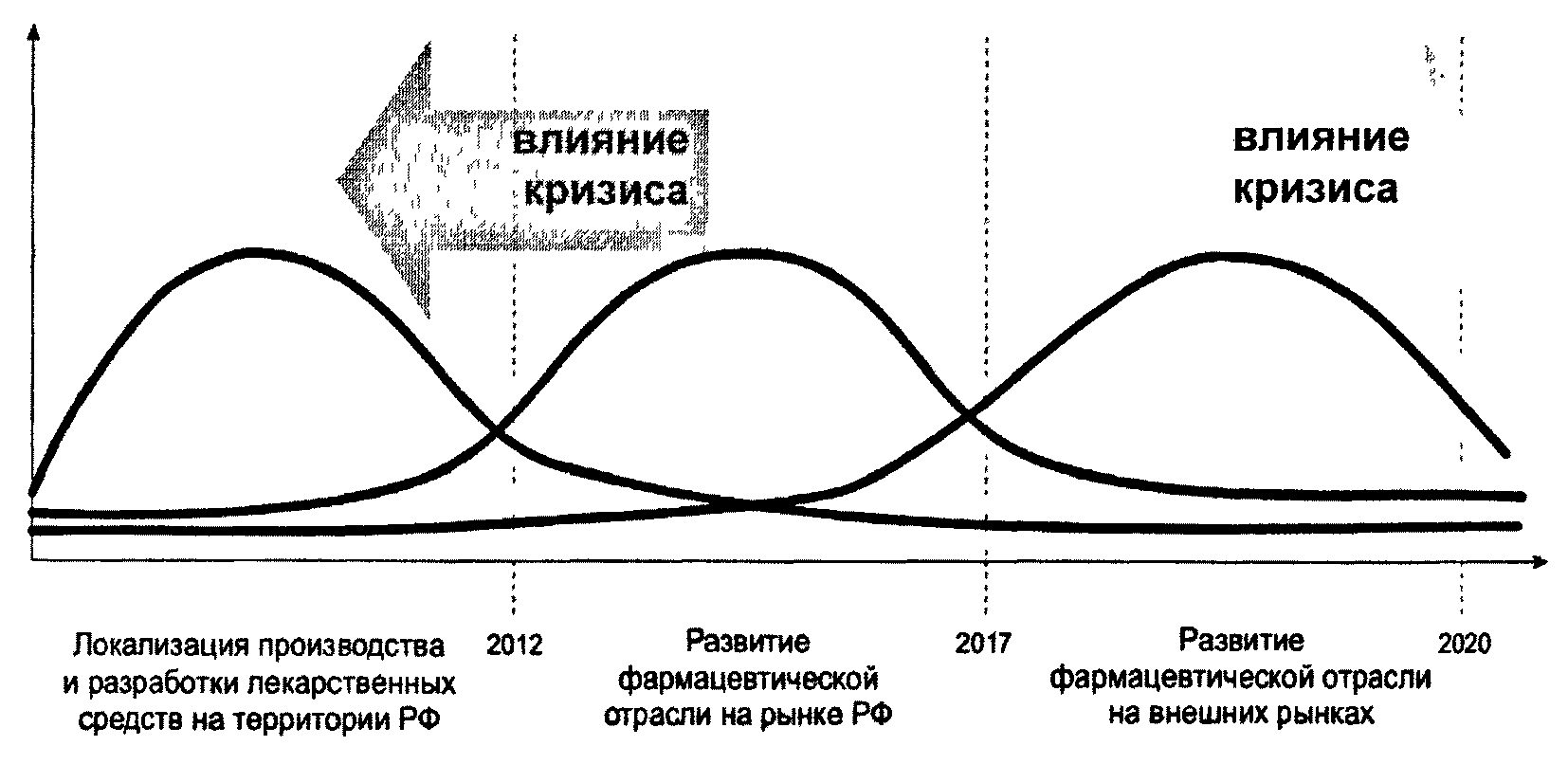
Настоящая Стратегия предусматривает реализацию трех основных этапов:
I этап - "Локализация производства и разработки лекарственных средств на территории РФ".
II этап - "Развитие фармацевтической отрасли на рынке РФ".
III этап - "Развитие фармацевтической отрасли на внешних рынках".
Для большинства мероприятий необходимо проведение предварительных действий, а также последующих мониторинговых шагов после их реализации. Отнесение мероприятий к тому или иному этапу означает проявление максимального внимания в этом интервале и получение соответствующего эффекта. Условно мощность и действия по мероприятиям отражены на рисунке 6.1.
Рисунок 6.1. Основные этапы реализации Стратегии
6.1. Первый этап: локализация производства и разработки лекарственных средств на территории РФ
Основная цель первого этапа заключается в создании системы современного фармацевтического производства и разработки ЛС на территории РФ.
Основной задачей является развитие современной производственной базы (в том числе с помощью локализации высокотехнологичных производств и исследовательских центров на территории РФ), соответствующей стандартам GMP, позволяющей с высокой эффективностью производить лекарственные субстанции и готовые лекарственные формы на их основе.
Для реализации первого этапа будут приняты меры, направленные на преодоление основных негативных тенденций в национальной фармацевтической промышленности:
- устранение существующего конкурентного неравенства между локальными и зарубежными фармацевтическими производителями в Российской Федерации, в том числе в нормативно-правовом поле;
- внедрение обязательных требований к правилам производства лекарственных средств (GMP), гармонизированных с международными;
- разработка механизма прямых компенсаций затрат фармацевтическим предприятиям, перешедшим на правила GMP;
- модернизация и утверждение Фармакопеи РФ, гармонизированной с Европейской Фармакопеей;
- исключение требования обязательного утверждения и регистрации Фармакопейных статей предприятия;
- замена требования проведения предрегистрационной экспертизы качества лекарственных препаратов экспертизой в рамках процедуры предварительного государственного контроля качества;
- введение требования предоставления регистрационного досье на лекарственный препарат в формате CTD (Common Technical Document);
- ограничение срока действия регистрационного удостоверения на ЛС пятью годами при первичной регистрации; при последующей перерегистрации - получение бессрочного удостоверения;
- принятие документов, регламентирующих разработку лекарственных средств в соответствии с международными стандартами надлежащей лабораторной и клинической практики (GLP и GCP);
- модернизация системы подготовки высококвалифицированных специалистов в области разработки и производства лекарственных средств;
- разработка и принятие необходимых изменений в законодательстве Российской Федерации и соответствующих нормативно-правовых актов, развитие государственных программ Российской Федерации в области лекарственного обеспечения;
- организация функционирования федеральных лабораторий для осуществления государственного контроля качества и безопасности ЛС;
- введение для производителей ЛС института уполномоченных лиц, отвечающих за качество и безопасность производимой продукции, несущих наравне с руководителем административную и уголовную ответственность за качество и безопасность продукции, выпускаемой предприятием;
- проведение комплекса мероприятий, направленных на борьбу с коррупцией в вопросах лекарственного обеспечения;
- проведение комплекса мероприятий, направленных на обеспечение лекарственной безопасности по лекарственным средствам военного назначения.
Особенности и специфические мероприятия:
- рассмотрение возможности установления повышенных ставок ввозных таможенных пошлин с учетом действующего уровня указанных ставок на все лекарственные препараты, субстанции которых вышли из-под действия патента при условии полного обеспечения потребности внутреннего рынка отечественными аналогами и при уровне их качества, не уступающем импортным лекарственным средствам;
- рассмотрение возможности установления повышенных ставок ввозных таможенных пошлин с учетом действующего уровня указанных ставок на импортируемые субстанции, в том числе химические реактивы, структурная формула и CAS-индекс которых совпадает с субстанциями, не находящимися под патентной защитой при условии полного обеспечения потребности внутреннего рынка отечественными аналогами и при уровне их качества, не уступающем импортным аналогам;
- оптимизация сроков и процедуры регистрации лекарственных средств для обеспечения ускоренного режима регистрации препаратов, разработанных и произведенных на территории РФ;
- обеспечение населения и учреждений здравоохранения антибиотиками российского производства, иммунобиологическими препаратами для обеспечения национального календаря прививок.
6.2. Второй этап: развитие фармацевтической отрасли за счет рынка РФ
Основная цель второго этапа заключается в создании отлаженной системы по:
- производству и выводу на рынок дженериковых ЛС (6.2.1);
- размещению лицензионных производств высокоэффективных инновационных препаратов, не имеющих дженериковых аналогов (6.2.2);
- обеспечению лекарственной независимости РФ (6.2.3).
Основной задачей является формирование эффективного рыночного механизма по высокотехнологичному импортозамещению лекарственных средств.
Особенности и специфические мероприятия п. 6.2.1
(Организация производства и вывода на рынок современных дженериковых ЛС)
Необходимо реализовать две группы специфических мероприятий: (1) мероприятия по поддержке отечественных предприятий - производителей фармацевтических субстанций и (2) мероприятия по поддержке отечественных предприятий - производителей готовых лекарственных форм (ГЛФ). Необходимость разделения этих групп мероприятий связана с наличием в отрасли ярко выраженной системы разделения труда, при которой одна часть предприятий производит лекарственные субстанции, а другая часть - ГЛФ. При этом как практические задачи, так и экономические интересы этих групп зачастую существенно отличаются.
Мероприятия по поддержке отечественных предприятий - производителей фармацевтических субстанций:
- внесение в законодательные акты дополнений, гарантирующих при организации закупок для государственных нужд приоритетность отечественных производителей с целью локализации производств;
- внесение в нормативно-правовое регулирование в сфере обращения лекарственных средств дополнений, выравнивающих требования для отечественных и зарубежных фармпроизводителей в части порядка контроля качества субстанций; для этого предусмотреть аудит производителей импортных субстанций государственными экспертными организациями.
Мероприятия по поддержке отечественных предприятий - производителей готовых лекарственных средств:
- продолжение создания и внедрения в практику преференций при участии в конкурсе государственных закупок ЛС для локальных производителей;
- формирование Минздравсоцразвития и Минпромторгом РФ перечня лекарственных средств российского производства, рекомендуемых для государственных и региональных закупок (в т.ч. по программе обеспечения необходимыми лекарственными средствами);
- отмена регистрации субстанций при ужесточении контроля качества ГЛФ, в том числе путем обеспечения выездных инспекций и аккредитации в регуляторных органах РФ всех зарубежных производителей фармацевтических субстанций и ГЛФ, поступающих на рынок РФ;
- поддержка деятельности отечественных фармацевтических компаний на внешних фармацевтических рынках в рамках мер, предусмотренных для экспортеров промышленной продукции (стран СНГ, ближнего и дальнего зарубежья);
- отмена требования регистрации ЛС, произведенного исключительно для экспорта;
- внесение изменений в Постановление Правительства РФ от 16 июля 2005 года N 438, разрешающих ввоз зарегистрированных активных фармацевтических субстанций предприятием - производителем лекарственных средств для собственного производства на основании регистрационных удостоверений на лекарственный препарат и активную фармацевтическую субстанцию.
Особенности и специфические мероприятия п. 6.2.2
(Размещение лицензионных производств высокоэффективных инновационных препаратов, не имеющих дженериковых аналогов)
Не для всех терапевтических областей существуют эффективные препараты-дженерики. В таких случаях при отсутствии эффективных отечественных инновационных препаратов, предназначенных для удовлетворения нужд здравоохранения, предпочтительно размещение лицензионных производств зарубежных инновационных препаратов соответствующей группы на территории РФ.
Специфические мероприятия:
- стимулирование клинических испытаний, проводимых совместно отечественным и зарубежным производителем, при которых лицензия на инновационный препарат в РФ остается у российского партнера;
- стимулирование освоения новых технологий производства субстанций, включая биотехнологии (терапевтические белки, антитела и т.п.);
- стимулирование отечественных фармпроизводителей к созданию за рубежом центров трансфера технологий;
- поддержка приглашения в РФ западных специалистов, в первую очередь российского происхождения, имеющих современный индустриальный опыт разработки и производства ЛС;
- стимулирование доклинических исследований со стороны иностранных производителей, располагающих свои предприятия на территории РФ;
- разработка программы приобретения государственных прав на использование патентов на наиболее инновационные продукты и технологии с предоставлением отечественным предприятиям прав на их использование на конкурсной основе.
Специфические мероприятия п. 6.2.3
(Обеспечение лекарственной независимости РФ)
- Формирование стратегического перечня лекарственных средств и обеспечение полного цикла их производства на территории РФ; совершенствование механизма государственных закупок в рамках этого перечня, в том числе через систему предварительных закупок.
6.3. Третий этап: развитие фармацевтической отрасли за счет внешних рынков
Третья группа мероприятий предусматривает реализацию мер, направленных на развитие конкурентных преимуществ национальной фармацевтической отрасли и осуществление ее перехода на инновационную модель развития.
Основными целями данных мероприятий являются:
6.3.1. разработка и производство отечественных инновационных препаратов для импортозамещения лекарственных средств, находящихся под патентом на локальном рынке;
6.3.2. разработка и производство отечественных инновационных препаратов, экспортоспособных на мировых рынках.
Основная задача состоит в создании инфраструктуры для разработки инновационных препаратов с применением последних достижений науки и техники и использовании современных технологических платформ.
Особенности и специфические мероприятия п. 6.3.1
(Разработка и производство отечественных импортозамещающих инновационных лекарственных препаратов)
Целью является разработка и производство по актуальным фармацевтическим направлениям отечественных патентоспособных препаратов, которые имеют известные зарубежные прототипы и показали клиническую эффективность. Фактически речь идет об оригинальных лекарственных препаратах, имеющих тот же механизм действия и не меньшую эффективность, чем зарубежные прототипы, но обладающих дополнительными полезными свойствами, такими как пониженная токсичность, повышенная биодоступность и т.п.
Специфические мероприятия:
- поддержка НИР и НИОКР, направленных на создание импортозамещающих ЛС и ГЛФ, в том числе путем использования потенциала государственных научных учреждений и регулярного проведения конкурсов среди малых научных фирм на разработку новых ЛС с последующей приоритетной закупкой государством созданных препаратов;
- выделение в рамках государственных институтов развития средств на создание специализированных финансовых инструментов, в том числе корпоративных и посевных фондов, для финансирования разработки инновационных лекарственных препаратов и фармацевтических субстанций (стр. 38), а также приоритетное финансирование проектов по разработке импортозамещающих лекарственных препаратов по направлению "Живые системы" Федеральным агентством по науке и инновациям (Роснауки) в рамках действующих и будущих ФЦП;
- стимулирование внедрения современных исследовательских технологий, в том числе на основе высокопроизводительных лабораторных испытаний;
- стимулирование эффективных патентных исследований и мониторинга международных рынков;
- совершенствование процедур, регламентирующих проведение доклинических и клинических испытаний;
- стимулирование нанобиотехнологий для решения вопросов эффективной доставки в организм человека известных ЛС и создания инновационных ГЛФ;
- создание системы выделения грантов для малых научных предприятий, связанных с разработкой лекарств;
- создание масштабной программы поддержки кооперационных проектов, объединяющих организации разных форм собственности и отраслевой принадлежности, работающие в сфере разработки и производства ЛС и ГЛФ;
- формирование спроса и стимулирование подготовки исследовательских кадров нового поколения, в том числе с участием государственных академий наук.
Особенности и специфические мероприятия п. 6.3.2
(Разработка и производство отечественных инновационных лекарственных препаратов, конкурентоспособных на мировом рынке)
Результатом реализации этого комплекса мероприятий в рамках настоящей Стратегии станет появление к 2020 году значительного числа отечественных разработок, позволяющих наладить реализацию готовой продукции или получение лицензий на ее производство за рубежом. Существенным отличием инновационных препаратов от патентоспособных структурно-модифицированных аналогов является реализация полного цикла разработки лекарств с нуля с использованием передовых научно-исследовательских подходов. Только такой подход позволяет в полной мере реализовать достижения "геномной эры" и создавать препараты нового поколения, отличающиеся высокой эффективностью, низким уровнем побочных эффектов и высокой рентабельностью производства.
Специфические мероприятия:
- создание эффективной схемы финансирования разработки инновационных ЛС на всех ее этапах, включающей гранты, венчурное финансирование и финансирование фарминдустрией;
- стимулирование внедрения в практику разработки ЛС передовых технологий, основанных на достижениях "постгеномной эры";
- формирование научно-исследовательских центров и кластеров по разработке инновационных лекарственных средств, таких как Национальный центр биологического скрининга;
- выход на зарубежные рынки за счет приобретения иностранных активов;
- стимулировать приобретение передовых зарубежных разработок лекарств на доклинической и клинической фазах с последующим доведением их в РФ до стадии готового продукта и коммерциализацией на мировом рынке;
- упрощение процедуры получения разрешений на экспорт ГЛФ, произведенных, в том числе, по контракту.
7. Объем и источники финансирования мероприятий Стратегии
7.1. Источники финансирования
Источниками финансирования расходов на реализацию мероприятий Стратегии развития фармацевтической промышленности Российской Федерации на период до 2020 года являются федеральный бюджет, средства коммерческих и общественных организаций и иные внебюджетные средства.
Важными механизмами финансирования разработки новых лекарственных средств на этапе доклинических испытаний и при прохождении первой и второй фаз клинических испытаний должны стать существующие академические учреждения <*>, венчурные фонды и фонды посевного финансирования. Следует также осуществлять финансирование таких проектов в рамках федеральных целевых программ (ФЦП) <**> и необходимо использовать имеющиеся возможности банков по выделению кредитов, в том числе для перевода отраслевых производств на стандарты GMP, а также стимулировать фармпроизводителей к инвестиционной активности в области разработки новых лекарств, в том числе за счет созданий корпоративных венчурных фондов.
--------------------------------
<*> В том числе в рамках Программы фундаментальных научных исследований государственных академий наук на 2008 - 2012 гг., утвержденной распоряжением Правительства РФ от 27 февраля 2008 г. N 233-р.
<**> В том числе в рамках ФЦП "Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007 - 2012 годы", утвержденной Правительства РФ от 7 октября 2006 г. N 613.
Общая схема источников финансирования до 2017 - 2018 годов представлена на рисунке 7.1.
Рисунок 7.1. Источники инвестирования в рискованные проекты
разработки новых лекарств
более 60% - государственная поддержка
┌───────────────────────/\────────────────────┐
│ │
──────────\ ┌───┐ ┌─────────┐ ┌────────────┐ /────────────────
НАУКА \ │МОН│ │ОАО "РВК"│ │ ГК │ / ИНДУСТРИЯ
\ └───┘ │Посевные │ │"Роснанотех"│ /
\ │ фонды │ │ Спец. фонд │ / ┌──────────────┐
\ └─────────┘ └────────────┘ / │ Кредиты ВЭБ │
\ ┌─────────────┐ ┌─────────┐ / │на переход GMP│
\ │ ОАО "РВК" │ │Индустрия│ / └──────────────┘
\ │Корпоративные│ │и венчур │ /
\ │ фонды │ └─────────┘ /
\ └─────────────┘ /
\ ┌────────────┐ /
\ │Другие формы│ /
\ │господдержки│ /
\ └────────────┘ /
─────────────────────
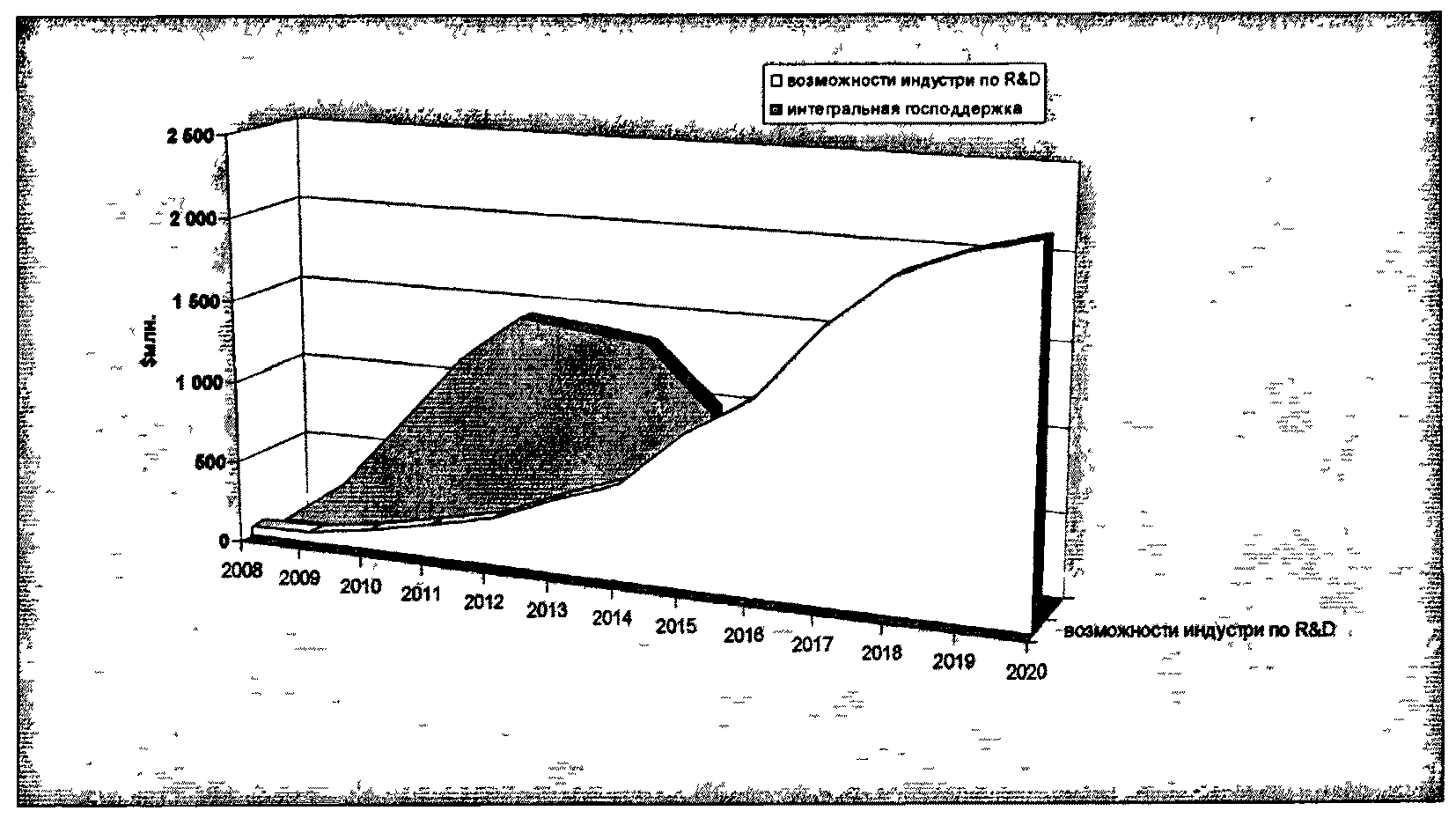
На первом этапе запуска "отраслевого инновационного цикла" фарминдустрии потребуется до 75% от всех средств со стороны государственных источников. Государственное финансирование впоследствии будет полностью замещено внебюджетными источниками со стороны фарминдустрии и венчурных фондов на этапе коммерциализации ранее разработанной интеллектуальной собственности (рисунок 7.2). При этом дальнейшее финансирование новых разработок в отрасли будет осуществляться уже за счет внебюджетных источников, так как значительный объем инновационных препаратов в портфелях отечественных производителей позволит им выделять до 15% своего годового оборота на новые разработки, как это принято в развитых странах.
Рисунок 7.2. Источники финансирования НИОКР в области
разработки лекарственных средств на разных этапах
реализации Стратегии
7.2. Объем финансирования
Объем финансирования был рассчитан исходя из основной задачи Стратегии по достижению отечественной промышленностью к 2020 году не менее 50% доли рынка в денежном выражении. Решением этой задачи является комплекс мер, в том числе финансовое стимулирование дженерикового импортозамещения и разработки отечественных инновационных лекарственных средств. В рамках решения этой задачи необходимо также финансовое стимулирование перехода отрасли на современные стандарты производства и контроля качества лекарственных средств.
Финансирование разработки лекарственных средств
Количественный и качественный анализ лекарственных средств, не выпускаемых отечественными производителями (более 200 из 463 проанализированных МНН, где данные 463 МНН представляют более 90% рынка ДЛО и Госпитальных закупок в денежном выражении), позволил выделить следующие группы ЛС: по патентному статусу - инновационные или дженериковые; по происхождению субстанции - получаемые химическим синтезом или биотехнологическим путем. Данные приведены на рисунке 7.3.
Рисунок 7.3. Анализ 463 МНН из ДЛО и Госпитальных закупок
(до 90% сегментов в денежном выражении): статистика
по инновационности и суммарные продажи за 2007 год
2007 год
┌───────────┐ ┌───────────────────────────────────────────────────────────┐
│ ├>│ Только РФ: 31 МНН 75 млн. долл. │
│ │ └───────────────────────────────────────────────────────────┘
│ │
│ 463 МНН │ ┌────────────────┐ ┌────────────────────────────────────────┐
│ │ │ РФ и иностр. ├>│ РФ - 251 МНН 462 млн. долл. │
│ 3,500 ├>│ 251 МНН │ └────────────────────────────────────────┘
│ млн. долл.│ │1,794 млн. долл.│ ┌────────────────────────────────────────┐
│ │ └────────────────┴>│ Иностранные: 251 МНН 1,332 млн. долл. │
│ │ └────────────────────────────────────────┘
│ │
└──────┬────┘ ┌────────────────┐ ┌────────────────────────────────────────┐
│ │ Только ├>│ Химдженерики 31 МНН 477 млн. долл. │
└─────>│ иностранные │ └────────────────────────────────────────┘
│ 181 МНН │ ┌────────────────────────────────────────┐
│1,542 млн. долл.├>│ Биодженерики 30 МНН 457 млн. долл. │
└────────────────┤ └────────────────────────────────────────┘
│ ┌────────────────────────────────────────┐
└>│ Инновационные 70 МНН 606 млн. долл. │
├┬┬──────────────────────────────────────┘
│││ ┌───────────────────────────────────┐
││└─>│ до 2013 г. 20 МНН 126 млн. долл. │
││ └───────────────────────────────────┘
││ ┌───────────────────────────────────┐
│└──>│после 2013 г. 28 МНН 370 млн. долл.│
│ └───────────────────────────────────┘
│ ┌───────────────────────────────────┐
└───>│ нет патента 22 МНН 112 млн. долл. │
└───────────────────────────────────┘
Таким образом, показано, что основные ЛС, закупаемые в рамках бюджетных закупок, представлены инновационными ЛС (38% в денежном выражении) и дженериками, закупаемыми как у отечественных, так и у западных производителей (32% в денежном выражении). Из данной таблицы видно, что более 53% МНН в количественном выражении и до 50% в денежном выражении могут полностью закупаться за счет уже локализованного в РФ производства при условии обеспечения соответствующих стандартов качества, а из 40% МНН, закупаемых только у зарубежных производителей, всего 26% являются инновационными и могут служить прототипами для разработки отечественных препаратов, действующих на те же биомишени. При этом остальные 14% ЛС, закупаемых только у зарубежных производителей, могут быть замещены отечественными дженериками, за исключением некоторых био-дженериков, воспроизводство которых "впрямую" затруднено в РФ технологически и требует закупки производственных лицензий или разработки собственной производственной технологии.
Исходя из международной статистики и опыта разработки лекарственных препаратов в России, приведены расчеты необходимого количества лекарственных препаратов, разработку и производство которых необходимо вести на разных этапах, чтобы достичь целей Стратегии.
Таблица 7.1. Перечень МНН лекарственных средств, не производящихся на территории Российской Федерации
┌────────────────────────┬────────────────────┬───────────────────────────┐ │ Инновационные │Каспофунгин │ Химдженерики │ │ лекарственные средства │ │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Абакавир │Кветиапин │Алпростадил │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Алемтузумаб │Ламивудин │Аминокислоты для │ │ │ │парентерального │ │ │ │питания + прочие препараты │ │ │ │[жировые эмульсии + │ │ │ │декстроза + минералы] │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Алтеплаза │Ламивудин + │Гексопреналин │ │ │зидовудин │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Аминокислоты для │Лапатиниб │Глимепирид │ │парентерального │ │ │ │питания + прочие │ │ │ │препараты [декстроза + │ │ │ │минеральные соли] │ │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Амисульприд │Леводопа + │Десмопрессин │ │ │бенсеразид │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Арипипразол │Левосимендан │Децитабин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Атазанавир │Ленограстим │Железа [III] гидроксид │ │ │ │полиизомальтозат │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Атракурия безилат │Линезолид │Железа [III] гидроксид │ │ │ │сахарозный комплекс │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Базиликсимаб │Лопинавир + │Железа сульфат + │ │ │ритонавир │аскорбиновая кислота │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Бевацизумаб │Моксифлоксацин │Изофлуран │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Бортезомиб │Надропарин кальция │Йоверсол │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Будесонид + формотерол │Оланзапин │Кетоаналоги аминокислот │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Валганцикловир │Омализумаб │Кломипрамин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Вориконазол │Палиперидон │Левомепромазин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гадобутрол │Перициазин │Лорноксикам │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гадодиамид │Пэгинтерферон альфа-│Мемантин │ │ │2альфа │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гадопентетовая кислота │Пэгинтерферон альфа-│Метилпреднизолон │ │ │2бета │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Ганцикловир │Пэгфилграстим │Метформин + глибенкламид │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гефитиниб │Рабепразол │Мидазолам │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гидроксизин │Ритуксимаб │Микофеноловая кислота │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гозерелин │Рокурония бромид │Нимесулид │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Гранисетрон │Ропивакаин │Нимодипин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Даклизумаб │Салметерол + │Орнитин │ │ │флутиказон │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Дарбэпоэтин альфа │Севофлуран │Прокарбазин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Диданозин │Сертиндол │Пропофол │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Динопрост │Сиролимус │Рисперидон │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Дорназа альфа │Сорафениб │Силибинин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Дротрекогин альфа │Такролимус │Сультамициллин │ │[активированный] │ │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Зипрасидон │Темозоломид │Троксерутин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Зуклопентиксол │Тенектеплаза │Фенотерол │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Иматиниб │Тиотропия бромид │Фосфокреатин │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Имиглюцераза │Топотекан │Фулвестрант │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Иммуноглобулин │Трастузумаб │Хлорпротиксен │ │человеческий нормальный │ │ │ │[IgG + IgA + IgM] │ │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Инсулин аспарт │Фактор свертывания │Эсмолол │ │ │крови VIII + фактор │ │ │ │виллебранда │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Инсулин аспарт │Флумазенил │ │ │двухфазный │ │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Инсулин гларгин │Флупентиксол │ Биодженерики │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Инсулин детемир │Формотерол │Глатирамера ацетат │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Инсулин лизпро │Цетуксимаб │Далтепарин натрия │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Интерферон бета-1альфа │Цисатракурия безилат│Интерферон альфа-2альфа │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Интерферон бета-1бета │Эноксапарин натрия │Лактулоза │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Инфликсимаб │Эптаког альфа │Октоког альфа │ │ │[активированный] │ │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Ипратропия │Эрлотиниб │Соевых бобов масло + │ │бромид + фенотерол │ │триглицериды │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Йогексол │Эртапенем │Факторы свертывания крови │ │ │ │II, IX и X в комбинации │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Йопромид │Эсциталопрам │Флутиказон │ ├────────────────────────┼────────────────────┼───────────────────────────┤ │Капецитабин │Эфавиренз │ │ └────────────────────────┴────────────────────┴───────────────────────────┘
Таблица 7.2. Оценка размеров финансирования разработки отечественных дженериковых и инновационных лекарственных средств
─────────────────────────────────┬────────┬───────────┬───────┬─────┬──────────────────────────────┐
Мероприятие │ Кол-во │ Средняя │ Общая │Срок,│ Результат │
│проектов│ стоимость │ сумма │годы │ │
│ │ проекта │ (млн. │ │ │
│ │(млн. руб.)│ руб.) │ │ │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.1. Научно-исследовательские и │ 3 000 │ 14,4 │43 200 │ 5 │Патенты на биологически │
опытно-конструкторские работы по│ │ │ │ │активные вещества (более 400),│
доклинической разработке │ │ │ │ │возникновения малых │
отечественных инновационных │ │ │ │ │инновационных предприятий │
препаратов │ │ │ │ │(более 200), регистрация │
│ │ │ │ │доклинических испытаний │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.2. Научно-исследовательские и │ 400 │ 54 │21 600 │ 5 │Капитализация "стартапов". │
опытно-конструкторские работы по│ │ │ │ │Привлечение посевных и │
клиническим испытаниям (1 - 2 │ │ │ │ │венчурных фондов, до 200 │
фазы) отечественных │ │ │ │ │клинических кандидатов │
инновационных препаратов │ │ │ │ │перейдут на 3 фазы КИ, запуск │
│ │ │ │ │производства новых ЛС │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.3. Организация производства │ 40 │ 375 │15 000 │ 3 │Более 40 инновационных │
субстанций и ГЛФ, а также │ │ │ │ │синтетических препаратов, │
приобретение лицензий на │ │ │ │ │производимых в РФ по лицензии │
синтетические инновационные │ │ │ │ │ │
препараты │ │ │ │ │ │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.4. Разработка и организация │ 150 │ 36 │ 5 400 │ 3 │Зарегистрированные │
производства субстанции и ГЛФ │ │ │ │ │отечественные синтетические │
синтетических дженериков │ │ │ │ │дженерики и старапы с │
│ │ │ │ │дженериковыми портфелями и │
│ │ │ │ │малотоннажным производством │
│ │ │ │ │(до 150 МНН) │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.5. Разработка и организация │ 30 │ 180 │ 5 400 │ 5 │Зарегистрированные │
производства субстанции и ГЛФ │ │ │ │ │отечественные био-дженерики и │
био-дженериков │ │ │ │ │стар-ап компании с │
│ │ │ │ │биодженериковыми портфелями │
│ │ │ │ │(до 30 МНН) │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.6. Строительство заводов и │ 10 │ 1 080 │10 800 │ 5 │До 10 современных заводов, │
приобретение лицензий для │ │ │ │ │способных покрыть внутренний │
производства высокотехнологичных│ │ │ │ │спрос по всем │
био-дженериков │ │ │ │ │биотехнологическим препаратам │
─────────────────────────────────┼────────┼───────────┼───────┼─────┼──────────────────────────────┤
1.7. Прочие расходы │ │ │ 5 000 │ 5 │Мониторинг и управление │
│ │ │ │ │проектами │
─────────────────────────────────┴────────┼───────────┼───────┼─────┴──────────────────────────────┘
│ ИТОГО │106 400│
└───────────┴───────┘
Финансирование исследовательской инфраструктуры и повышения квалификации кадров
Ключевым элементом для реализации необходимого количества проектов, указанных в предыдущем разделе, является наличие подготовленных кадров и соответствующей научно-исследовательской инфраструктуры. На сегодняшний день, по экспертным оценкам, имеется не более 10% кадрового ресурса необходимой квалификации, в связи с чем встает первоочередная задача подготовки и переподготовки кадров для запуска "инновационного цикла" в фармотрасли РФ. Именно нехваткой кадрового ресурса продиктована необходимость покупки лицензий на инновационные препараты на первых двух этапах реализации данной Стратегии.
На данный момент в отрасли задействовано более 65 000 специалистов. По расчетам экспертов, необходимо инициировать процесс подготовки и переподготовки более 10 000 человек, занятых на разных этапах создания фармацевтической продукции, и подготовить необходимую инфраструктуру. Нерешение этой задачи может привести к невозможности перехода отрасли на инновационную модель развития. Финансовое обеспечение этих мероприятий отражено в табл. 7.3.
Таблица 7.3. Финансовое обеспечение мероприятий по повышению квалификации кадров и созданию исследовательской инфраструктуры для фармацевтической отрасли
┌───────────────┬───────┬────────┬────────────────────────────────────────┐ │ Тип кадров │Необхо-│ Сумма, │ Примечание │ │ │димое │ млн. │ │ │ │коли- │ руб. │ │ │ │чество │ │ │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Научные │ 3 500 │ 12 600 │Создание новых специальностей и │ │исследователи │ │ │специализаций в ВУЗах, предусматривающих│ │(химики, │ │ │получение необходимых знаний в области │ │биологи) │ │ │фундаментальной медицины, оснащение │ │ │ │ │кафедр и лабораторий современным │ │ │ │ │оборудованием, обновление научно- │ │ │ │ │методической базы, повышение │ │ │ │ │квалификации научно-преподавательского │ │ │ │ │состава. Повышение оплаты труда молодым │ │ │ │ │ученым до международного уровня, │ │ │ │ │введение дополнительных выплат студентам│ │ │ │ │и аспирантам. Разработка программ │ │ │ │ │обучения и переподготовки коллективов │ │ │ │ │научных школ совместно с РАН, РАМН, │ │ │ │ │профильными ВУЗами │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Индустриальные │ 450 │ 1 620 │Привлечение в область разработки новых │ │научные │ │ │ЛС специалистов, имеющих опыт работы │ │специалисты │ │ │в индустриальной науке на международном │ │ │ │ │уровне, привлечение западных │ │ │ │ │специалистов, возврат соотечественников,│ │ │ │ │эмигрировавших и работающих в │ │ │ │ │иностранных фармацевтических компаниях │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Фармакологи │ 800 │ 1 920 │Повышение качества образовательных │ │ │ │ │программ, организация стажировок. │ │ │ │ │Повышение оплаты труда │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Клиницисты │ 750 │ 2 880 │Повышение качества образовательных │ │ │ │ │программ, организация стажировок и │ │ │ │ │курсов повышения квалификации, │ │ │ │ │осуществление непрерывной системы │ │ │ │ │образования, повышение оплаты труда │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Технологи │ 2 000 │ 7 200 │Создание специальных научно- │ │(высококвалифи-│ │ │образовательных программ, переоснащение │ │цированные, │ │ │лабораторий и кафедр, организация │ │GMP) │ │ │экспериментальных и опытно- │ │ │ │ │производственных участков, повышение │ │ │ │ │квалификации преподавательского состава,│ │ │ │ │международные стажировки, │ │ │ │ │образовательные курсы переподготовки │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Управленцы │ 2 000 │ 720 │Привлечение международных экспертов в │ │ │ │ │области фармацевтики и биотехнологий для│ │ │ │ │проведения семинаров, консультация на │ │ │ │ │профильных кафедрах ВУЗов, стажировки │ │ │ │ │менеджеров на иностранные │ │ │ │ │фармацевтические производства и научно- │ │ │ │ │исследовательские лаборатории │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Инновационные │ 1 500 │ 1 080 │Создание систем отбора активной молодежи│ │менеджеры в │ │ │в ВУЗах, организация небольших грантов │ │фармацевтичес- │ │ │для поддержки малого бизнеса и │ │кой отрасли │ │ │предпринимательства │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Повышение │ │ 7 200 │Компенсация выплат процентов по │ │мобильности │ │ │ипотечным кредитам для сотрудников │ │ученых с учетом│ │ │коммерческих лабораторий. Служебные │ │кластерного │ │ │общежития и квартиры для сотрудников │ │развития │ │ │государственных научно-исследовательских│ │ │ │ │центров и институтов, социальные пакеты,│ │ │ │ │соответствующие международному уровню │ ├───────────────┼───────┼────────┼────────────────────────────────────────┤ │Всего │ │ 35 220 │ │ └───────────────┴───────┴────────┴────────────────────────────────────────┘
Финансирование перехода отрасли на международные стандарты GMP
Для перехода отрасли на правила работы по международным стандартам GMP необходимо профинансировать строительство около 200 тысяч квадратных метров помещений для производства стерильной и нестерильной продукции.
Основные затраты, связанные с переходом на стандарты GMP, включают в себя расходы на:
- технологическое оборудование;
- чистые или контролируемые помещения (при производстве нестерильных ЛС чистые помещения не обязательны);
- неконтролируемые по чистоте помещения;
- здание (стоимость здания при новом строительстве или стоимость реконструкции существующего здания);
- инфраструктура (инженерные коммуникации, энергетическое хозяйство, мероприятия по охране окружающей среды, благоустройство территории и пр.);
- проект производства, испытания (аттестация, валидация) оборудования и процессов.
Ниже приведены оценки расходов на строительство и реконструкцию фармацевтических производств в соответствии со стандартами GMP.
Таблица 7.4. Затраты на создание производства нестерильных ЛС (суммарной площадью 3000 кв. м, объемом выпуска - 1 млрд. таблеток в год)
┌───┬────────────────────────────────────────────┬───────────┬────────────┐ │ N │ Статья расходов │Сумма, млн.│ % от общей │ │ │ │ руб. │ суммы │ │ │ │ │ расходов │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 1 │Технологическое оборудование │ 188 │ 29 │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 2 │Чистые или контролируемые помещения <*> │ 65,8 │ 10 │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 3 │Неконтролируемые по чистоте помещения <*> │ 94 │ 15 │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 4 │Здание (строительство или реконструкция) │ 141 │ 22 │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 5 │Инфраструктура │ 94 │ 15 │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 6 │Проект │ 47 │ 7 │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ 7 │Испытания оборудования и процессов │ 14,1 │ 2 │ │ │(валидация) │ │ │ ├───┼────────────────────────────────────────────┼───────────┼────────────┤ │ │Всего: │ 643,9 │ 100 │ └───┴────────────────────────────────────────────┴───────────┴────────────┘
Таблица 7.5. Затраты на строительство помещений производств нестерильных ЛС (в готовом здании)
┌────┬───────────────────────────────────────┬────────┬─────────┬─────────┐ │ N │ Наименование │Площадь,│ Цена, │ Сумма, │ │ │ │ кв. м │тыс. руб.│млн. руб.│ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ 1 │Производственные помещения, в том │ 1000 │ │ │ │ │числе: │ │ │ │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ │ - чистые и контролируемые помещения, │ 500 │ 94 │ 47 │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ │ - неконтролируемые помещения │ 500 │ 47 │ 23,5 │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ 2 │Вспомогательные помещения, в том числе:│ 1000 │ │ │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ │ - чистые и контролируемые помещения │ 200 │ 94 │ 18,8 │ │ │ (прачечная, лаборатория и пр.), │ │ │ │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ │ - неконтролируемые помещения │ 800 │ 47 │ 37,6 │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ 3 │Склады │ 1000 │ 32,9 │ 32,9 │ ├────┼───────────────────────────────────────┼────────┼─────────┼─────────┤ │ │Итого │ │ │ 159,8 │ └────┴───────────────────────────────────────┴────────┴─────────┴─────────┘
Таблица 7.6. Затраты на создание производства стерильных ЛС (суммарной площадью 3,000 кв. м, объемом выпуска 160 млн. ампул в год)
┌────┬───────────────────────────────────────────┬──────────┬─────────────┐ │ N │ Статья расходов │ Сумма, │ % от общей │ │ │ │млн. руб. │ суммы │ │ │ │ │ расходов │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 1 │Технологическое оборудование │ 329 │ 38 │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 2 │Чистые или контролируемые помещения │ 112,8 │ 13 │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 3 │Неконтролируемые по чистоте помещения │ 94 │ 11 │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 4 │Здание (строительство или реконструкция) │ 141 │ 16 │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 5 │Инфраструктура │ 94 │ 11 │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 6 │Проект │ 70,5 │ 8 │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ 7 │Испытания оборудования и процессов │ 23,5 │ 3 │ │ │(валидация) │ │ │ ├────┼───────────────────────────────────────────┼──────────┼─────────────┤ │ │Всего │ 864,8 │ 100 │ └────┴───────────────────────────────────────────┴──────────┴─────────────┘
Таблица 7.7. Затраты на строительство помещений производств стерильных ЛС (в готовом здании)
┌───┬───────────────────────────────────┬──────────┬───────────┬──────────┐ │ N │ Наименование │ Площадь, │ Цена, │ Сумма, │ │ │ │ кв. м │ тыс. руб. │млн. руб. │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │1 │Производственные помещения, в том │ 1000 │ │ │ │ │числе: │ │ │ │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │ │ - чистые помещения с зонами: │ 10 │ 376 │ 3,76 │ │ │ -- A │ 210 │ 188 │ 39,48 │ │ │ -- B/C │ 280 │ 117,5 │ 32,9 │ │ │ -- D │ 500 │ │ 76,14 │ │ │Итого по чистым помещениям │ │ │ │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │ │ - неконтролируемые помещения │ 500 │ 47 │ 23,5 │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │2 │Вспомогательные помещения, в том │ 1000 │ │ │ │ │числе: │ │ │ │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │ │ - чистые и контролируемые │ 400 │ 94 │ 37,6 │ │ │ помещения (прачечная, │ │ │ │ │ │ лаборатория и пр.), │ │ │ │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │ │ - неконтролируемые помещения │ 800 │ 47 │ 37,6 │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │3 │Склады │ 1000 │ 32,9 │ 32,9 │ ├───┼───────────────────────────────────┼──────────┼───────────┼──────────┤ │ │Итого │ │ │ 207,74 │ └───┴───────────────────────────────────┴──────────┴───────────┴──────────┘
Исходя из размера российского рынка в упаковках (4,38 млрд. упаковок в 2007 году, что соответствует порядку 40 млрд. таблеток) и ампулах (более 2 млрд. ампул в 2007 году), стоимость перехода отрасли на правила GMP оценивается в 36 000 млн. рублей в случае строительства нового производства и в 9 000 - 15 000 млн. рублей в случае организации производства в существующих зданиях. Однако ввиду технического состояния имеющихся помещений и морально устаревшего оборудования более эффективна и целесообразна организация производств ЛС в новых помещениях и на новом оборудовании с нуля. Таким образом, общая сумма финансирования перехода отрасли на стандарты GMP оценивается в 36 000 млн. рублей в текущих ценах. Данные затраты планируется произвести за счет собственных и кредитных средств организаций производителей фармацевтической продукции. Также предполагается использование механизма компенсации процентных ставок по кредитам, полученным в российских кредитных организациях на цели технологического перевооружения.
* * *
Общие затраты на мероприятия по реализации Стратегии до 2020 года должны составить 177 620 млн. рублей в ценах февраля 2009 года. Реализация инновационного сценария развития отечественной фармацевтической отрасли позволит начать "возвращать" инвестиции в отрасль уже к 2017 году за счет дисконтов на дженериковые и инновационные препараты отечественного производства, поставляемые в рамках закупок за счет бюджетных средств, а также за счет дополнительных налоговых поступлений от доходов локальных фармпроизводителей.
Таблица 7.8. Количественные оценки мероприятий и проектов, необходимых для реализации целей Стратегии
┌───────────────┬──────────────────────────────┬───────────────────────────┬──────────────────────────────────┬────────────────────┐ │ Направления │ Мероприятия │ Этап I │ Этап II │ Этап III │ │ │ ├──────┬──────┬──────┬──────┼──────┬──────┬──────┬──────┬──────┼──────┬──────┬──────┤ │ │ │ 2009 │ 2010 │ 2011 │ 2012 │ 2013 │ 2014 │ 2015 │ 2016 │ 2017 │ 2018 │ 2019 │ 2020 │ ├───────────────┼──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │Повышение │Количество специалистов │ │ │ │ │ │ │ │ │ │ │ │ │ │квалификации │(чел.) │ │ │ │ │ │ │ │ │ │ │ │ │ │кадров и ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │инфраструктуры │Для разработки ЛС: │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Научные сотрудники (химики, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │биологи, фармакологи) │ 200│ 700│ 700│ 700│ 600│ 300│ 300│ 200│ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Врачи-клиницисты │ 50│ 140│ 150│ 120│ 100│ 90│ 20│ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Научные руководители (с │ │ │ │ │ │ │ │ │ │ │ │ │ │ │индустриальным опытом) │ 30│ 75│ 80│ 60│ 25│ 20│ 7│ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Для производства ЛС: │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Технологи │ 300│ 550│ 500│ 450│ 200│ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Эффективные менеджеры и │ │ │ │ │ │ │ │ │ │ │ │ │ │ │управленцы │ 200│ 200│ 200│ 200│ 200│ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Для малого бизнеса: │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Инновационные предприниматели │ 175│ 250│ 200│ 200│ 125│ │ │ │ │ │ │ │ ├───────────────┼──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├───────────────┼──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │Переход на GMP │Производственные помещения, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │которые необходимо привести к │ │ │ │ │ │ │ │ │ │ │ │ │ │ │стандарту GMP (кв. м) │85 000│55 000│40 000│12 000│ │ │ │ │ │ │ │ │ ├───────────────┼──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├───────────────┼──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │Разработка ЛС │Государственные контракты на │ │ │ │ │ │ │ │ │ │ │ │ │ │ │доклинические исследования, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │в том числе для малых научных │ │ │ │ │ │ │ │ │ │ │ │ │ │ │организаций │ 500│ 950│ 1 300│ 1 400│ 1 500│ 1 250│ 950│ 700│ 650│ 550│ 500│ 500│ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Софинансирование лицензионного│ │ │ │ │ │ │ │ │ │ │ │ │ │ │производства │ 20│ 15│ 5│ │ │ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Государственные контракты на │ │ │ │ │ │ │ │ │ │ │ │ │ │ │разработку субстанций и ГЛФ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │био-дженериков │ 4│ 12│ 10│ 4│ │ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Государственные контракты на │ │ │ │ │ │ │ │ │ │ │ │ │ │ │разработку субстанций и ГЛФ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │химдженериков │ 50│ 75│ 25│ │ │ │ │ │ │ │ │ │ │ ├──────────────────────────────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┼──────┤ │ │Заводы для высокотехнологичных│ │ │ │ │ │ │ │ │ │ │ │ │ │ │биопрепаратов │ 1│ 2│ 5│ 1│ 1│ │ │ │ │ │ │ │ └───────────────┴──────────────────────────────┴──────┴──────┴──────┴──────┴──────┴──────┴──────┴──────┴──────┴──────┴──────┴──────┘
8. Региональные факторы развития фармацевтической промышленности
В настоящее время предприятия фармацевтической промышленности разной направленности находятся практически во всех субъектах Российской Федерации, большая часть которых сосредоточена в Нижегородской, Курской, Курганской, Пензенской областях, Алтайском крае, республике Башкортостан, Татарстан, в Западной Сибири с центрами в городах Новосибирске, Томске и Омске. В целом фармацевтическая промышленность обеспечивает 60 тысяч рабочих мест.
Следует выделить Московский, Новосибирский и Санкт-Петербургский регионы как области с большой концентрацией научных центров и высокотехнологичных научно-производственных компаний, специализирующихся в биотехнологической и фармацевтической областях.
Рисунок 8.1. Территориальное расположение предприятий
фармацевтической промышленности
Локализация в одном регионе производственных, научно-образовательных, финансовых, управленческих, инфраструктурных центров позволяет использовать хорошо зарекомендовавшую себя за рубежом кластерную политику развития фармацевтической отрасли.
Фармацевтический кластер - это группа географически локализованных взаимосвязанных инновационных фирм - разработчиков лекарств, производственных компаний; поставщиков оборудования, комплектующих, специализированных услуг; объектов инфраструктуры: научно-исследовательских институтов, вузов, технопарков, бизнес-инкубаторов и других организаций, дополняющих друг друга и усиливающих конкурентные преимущества отдельных компаний и кластера в целом. Отличительным признаком эффективно действующих кластеров является выход инновационной продукции.
Стратегия развития инновационных фармацевтических кластеров в РФ должна опираться на крупные университеты как основные источники инновационных предпринимателей и состоять из трех основных элементов:
1. улучшение рамочных условий;
2. развитие ключевых факторов успеха;
3. запуск кластерных инициатив.
В рамках первого элемента, улучшения рамочных условий, можно выделить пять тематических групп рекомендаций, а именно: (1) вопросы интеллектуальной собственности; (2) вопросы регистрации, сертификации и контроля качества биофармацевтической продукции; (3) вопросы внешнеторгового регулирования; (4) условия конкуренции; (5) вопросы государственных закупок. Общая цель первого элемента состоит в том, чтобы снизить уровень административных и иных барьеров для развития отрасли и кластеров в РФ.
Второй элемент стратегии развития фармацевтических кластеров может состоять в комплексном улучшении ключевых факторов успеха для развития кластеров путем создания: национальных грантов, фондов, программ посевного финансирования разработок; стартапов, инкубаторов, технопарков и др.; центров компетенции/передового опыта/ (Center of Excellence) различных организационно-правовых форм в области биотехнологических НИОКР; центров по продвижению отечественных лекарственных средств в федеральных округах; двусторонних международных фондов для финансирования биотехнологических НИОКР. Цель второго элемента стратегии можно определить как создание потенциала для развития фармацевтических кластеров в РФ.
Третий элемент стратегии развития фармацевтических кластеров - запуск кластерных инициатив - состоит в том, чтобы стимулировать и поддерживать проекты по разработке и реализации бизнес-планов развития отдельных потенциальных фармацевтических кластеров РФ. С учетом анализа международного опыта и лучшей практики можно выделить четыре варианта инициирования кластерных инициатив: (1) провести конкурс между несколькими регионами на разработку бизнес-планов и программ ускорения развития фармацевтических кластеров; (2) инициировать и поддержать разработку бизнес-планов развития для нескольких пилотных кластеров; (3) сконцентрировать усилия на разработке и реализации бизнес-плана для одного пилотного, потенциального кластера; (4) инициировать выпуск лекарственных средств, входящих в стратегический перечень, региональными фармацевтическими кластерами.
Основными параметрами для мониторинга работы инновационного кластера должны стать:
- общее количество предприятий и количество малых предприятий, входящих в кластер;
- количество занятых в кластере человек, средний возраст работников, средний доход работников;
- количество выданных патентов;
- сумма привлеченных средств разных форм инвестиций (гранты, венчурные и т.п.), в том числе международных;
- сумма произведенных товаров и услуг (из них предназначенных для экспорта).
Наиболее эффективными для развития отрасли с точки зрения размещения предприятий являются федеральные округа (ФО), имеющие крупные университетские центры, такие как Уральский ФО, Приволжский ФО, Сибирский ФО и Центральный ФО. Отдельно следует отметить высокий потенциал развития фармацевтической промышленности в Дальневосточном и Южном ФО, а также потенциал развития Москвы и Московской области, Ярославской, Пензенской, Калужской, Белгородской областей, Алтайского края и Санкт-Петербургской агломерации согласно проекту Концепции совершенствования региональной политики в Российской Федерации. Следует учитывать региональные стратегии развития при реализации мероприятий настоящей Стратегии.
9. Мониторинг и контроль реализации Стратегии
Мониторинг и контроль реализации Стратегии будет осуществлять Минпромторг России с участием других органов власти и государственных структур, а также коммерческих участников фармацевтического рынка.
В том числе необходима совместная работа с:
- Минздравсоцразвития - по сбору данных о проводимых клинических испытаниях и регистрации новых ЛС;
- Минэкономразвития - по сбору макроэкономических показателей;
- Минобрнауки, ПС "Роснанотех", ОАО "РВК", ГК "Внешторгбанк" - по сбору информации о профинансированных проектах в области живых систем;
- Минфином - по сбору информации о налоговых поступлениях со стороны фармпроизводителей;
- аналитическими компаниями - по сбору статистики производства и продаж лекарственных средств;
- ФИПС - по сбору статистики о патентном статусе лекарственных средств;
- ГК "Ростехнологии" - по сбору информации по вопросам трансфера технологий, привлечения инвестиций, а также ходу выполнения мероприятий Стратегии с участием государственных предприятий и НИИ.
Основные индикаторы реализации Стратегии и их количественные плановые показатели приведены в таблице 9.1.
Таблица 9.1. Основные индикаторы для мониторинга реализации Стратегии в случае инновационного сценария <*>
┌─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┐ │ Наименование индикаторов │ Единицы │2007 │2008 │ 2009 │2010 │2011 │2012│2013 │2014 │2015 │2016 │2017│2018 │2019 │ 2020 │ │ │измерения │ │ │(оценка) │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Рынок РФ │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │Общий объем рынка лекарственных │ млн. │ 313 │ 361 │ 372 │ 394 │ 457 │524 │ 675 │ 827 │ 882 │1023 │1129│1254 │1358 │ 1498 │ │средств в денежном выражении │ руб. │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │в ценах конечного потребления │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │(2, 3) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Локальное производство │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │Доля лекарственных средств │ % │ 19 │18,5 │ 23 │ 24 │ 27 │ 30 │ 32 │ 35 │ 37 │ 39 │ 40 │ 43 │ 46 │ 50 │ │локального производства от │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │суммарного потребления в │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │денежном выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля лекарственных средств │ % │ 70 │ 67 │ 68 │ 67 │ 66 │ 65 │ 64 │ 63 │ 62 │ 61 │ 60 │ 58 │ 56 │ 55 │ │локального производства от │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │суммарного потребления в │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │натуральном выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля отечественных лекарственных │ % │ 5 │ 7 │ 9 │ 11 │ 13 │ 15 │ 17 │ 18 │ 20 │ 22 │ 24 │ 26 │ 28 │ 30 │ │средств, выпускаемых из │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │субстанций отечественного │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │производства (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Экспорт фармацевтической │ млрд. │ 5 │ 5,2 │ 7 │ 9 │ 11 │ 12 │ 14 │ 16 │ 18 │ 19 │ 20 │ 25 │ 32 │ 40 │ │продукции (2, 3) │ руб. │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Импортное производство │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля лекарственных средств │ % │ 81 │81,5 │ 77 │ 76 │ 73 │ 70 │ 68 │ 65 │ 63 │ 61 │ 60 │ 57 │ 54 │ 50 │ │импортного производства от всех │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │реализуемых в денежном выражении │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │(4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля лекарственных средств │ % │ 30 │ 33 │ 32 │ 33 │ 34 │ 35 │ 36 │ 37 │ 38 │ 39 │ 40 │ 42 │ 44 │ 45 │ │импортного производства от всех │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │реализуемых в натуральном │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Уровень инновационности │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │Доля инновационных лекарственных │ % │ 35 │ 37 │ 36 │ 37 │ 39 │ 40 │ 43 │ 45 │ 49 │ 53 │ 55 │ 57 │ 59 │ 60 │ │средств в денежном выражении, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │из них (3) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля инновационных лекарственных │ % │ 1 │ 1 │ 4 │ 5 │ 7 │ 10 │ 15 │ 24 │ 30 │ 36 │ 40 │ 44 │ 48 │ 50 │ │средств локального производства │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │в денежном выражении (3) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Производство │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │Доля производства лекарственных │ % │ <1 │ <1 │ <1 │ <1 │ <1 │ 1 │ 1,1 │ 1,2 │ 1,3 │ 1,4 │1,5 │ 1,7 │ 1,9 │2 - 3 │ │средств в объеме ВВП РФ (2, 3, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │5) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Количество фармацевтических │ шт. │ 350 │ 340 │ 325 │ 300 │ 265 │250 │ 220 │ 205 │ 185 │ 165 │150 │ 140 │ 125 │ 100 │ │предприятий-производителей (2, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │3, 5, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Количество малых инновационных │ шт. │ <100│<100 │ <100 │ 100 │ 150 │230 │ 350 │ 440 │ 580 │ 650 │700 │ 770 │ 800 │ 825 │ │предприятий (2, 3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля производственных мощностей, │ % │ 9 │ 16 │ 17 │ 55 │ 100 │100 │ 100 │ 100 │ 100 │ 100 │100 │ 100 │ 100 │ 100 │ │соответствующих GMP (5) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Разработка ЛС │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │Количество отечественных проектов│ шт. │ <100│<100 │ <100 │ 800 │ 900 │1100│1150 │1200 │1250 │1275 │1300│1050 │ 780 │ 590 │ │на фазе доклинических │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │исследований (3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Количество отечественных проектов│ шт. │ <10│ <10 │ 15 │ 20 │ 32 │ 45 │ 55 │ 63 │ 68 │ 70 │ 72 │ 90 │ 120 │ 212 │ │на 1 - 2 фазах клинических │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │испытаний (3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Число отечественных инновационных│ шт. │ <5 │ <10 │ <10 │ 20 │ 28 │ 40 │ 55 │ 70 │ 95 │ 120 │ 167│ 175 │ 196 │ 217 │ │препаратов, выведенных на рынок, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │в том числе (3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │для лечения социально значимых │ │ 0 │ <2 │ <4 │ 4 │ 7 │ 10 │ 12 │ 17 │ 22 │ 29 │ 53 │ 40 │ 43 │ 45 │ │заболеваний (1, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┼──────────┼─────┼─────┼─────────┼─────┼─────┼────┼─────┼─────┼─────┼─────┼────┼─────┼─────┼──────┤ │Доля обеспечения лекарственными │ % │ - │ 10 │ 15 │ 30 │ 40 │ 50 │ 55 │ 65 │ 70 │ 75 │ 85 │ 85 │ 85 │ 85 │ │средствами локального │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │производства из стратегического │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │списка (1) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┤ │ Мировой рынок │ ├─────────────────────────────────┬──────────┬─────┬─────┬─────────┬─────┬─────┬────┬─────┬─────┬─────┬─────┬────┬─────┬─────┬──────┤ │Доля РФ в мировом рынке │ % │<0,02│<0,02│ <0,02 │<0,02│<0,02│0,02│0,02 │0,022│0,025│0,027│0,03│0,35 │ 0,5 │ 1 │ │производства ЛС (2, 3, 5, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ └─────────────────────────────────┴──────────┴─────┴─────┴─────────┴─────┴─────┴────┴─────┴─────┴─────┴─────┴────┴─────┴─────┴──────┘
--------------------------------
<*> Индикаторы соответствуют выполнению задач:
(1) Увеличение обеспеченности населения, учреждений системы здравоохранения и Вооруженных Сил Российской Федерации, федеральных органов исполнительной власти, в которых законом предусмотрена военная и приравненная к ней служба, лекарственными средствами отечественного производства.
(2) Повышение конкурентоспособности отечественной фармацевтической промышленности путем гармонизации российских стандартов по разработке и производству лекарственных средств с международными требованиями.
(3) Стимулирование разработки и производства инновационных лекарственных средств и поддержка экспорта российских лекарств, в том числе за счет выработки дополнительных механизмов финансирования оригинальных разработок.
(4) Защита внутреннего рынка от недобросовестной конкуренции и выравнивание условий доступа на рынок для отечественных и зарубежных производителей.
(5) Осуществление технологического перевооружения российской фармацевтической отрасли.
(6) Совершенствование системы подтверждения соответствия качества лекарственных средств, включая меры по устранению избыточных административных барьеров по регистрации отечественных лекарств и обеспечение надлежащего контроля за их качеством.
(7) Совершенствование системы подготовки специалистов для фармацевтической промышленности, в том числе создание новых программ обучения в соответствии с международными стандартами.
Таблица 9.2. Основные индикаторы для мониторинга реализации Стратегии в случае инерционного сценария
┌─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┐ │ Наименование индикаторов │ Единицы │2007 │ 2008 │ 2009 │ 2010 │ 2011 │2012 │ 2013 │ 2014 │ 2015 │ 2016 │2017│2018 │2019 │2020 │ │ │измерения │ │ │(оценка) │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Рынок РФ │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Общий объем рынка │млн. руб. │ 313 │ 361 │ 372 │ 371 │ 384 │ 469 │ 583 │ 675 │ 706 │ 762 │792 │ 885 │ 958 │1076 │ │ лекарственных средств │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в денежном выражении │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в ценах конечного │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ потребления (2, 3) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Локальное производство │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Доля лекарственных средств │ % │ 19 │ 18,5 │ 23 │ 19,5 │ 19 │18,8 │ 17,6 │ 16,4 │ 16 │ 15,9 │15,7│15,4 │15,2 │ 15 │ │ локального производства │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в денежном выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Доля лекарственных средств │ % │ 70 │ 67 │ 68 │ 69,5 │ 69 │ 67 │ 58 │ 50 │ 48 │ 47 │ 44 │ 42 │ 41 │ 40 │ │ локального производства │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в натуральном выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Доля отечественных │ % │ 5,0 │ 4,8 │ 4,7 │ 4,5 │ 4,4 │ 4,2 │ 4,1 │ 3,9 │ 3,8 │ 3,6 │3,5 │ 3,3 │ 3,2 │ 3,0 │ │ лекарственных средств, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ выпускаемых из субстанций │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ отечественного │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ производства (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Экспорт фармацевтической │ млрд. │ 5 │ 5,2 │ 7 │ 5,8 │ 6,2 │ 6,5 │ 6,8 │ 7,1 │ 7,3 │ 7,4 │7,6 │ 7,8 │ 7,9 │ 8 │ │ продукции (2, 3) │ руб. │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Импортное производство │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Доля лекарственных │ % │ 81 │ 81,5 │ 77 │ 80,5 │ 81 │81,2 │ 82,4 │ 83,6 │ 84 │ 84,1 │84,3│84,6 │84,8 │ 85 │ │ средств импортного │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ производства от всех │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ реализуемых в денежном │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Доля лекарственных средств │ % │ 30 │ 33 │ 32 │ 30,5 │ 31 │ 33 │ 42 │ 50 │ 52 │ 53 │ 56 │ 58 │ 59 │ 60 │ │ импортного производства │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ от всех реализуемых │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в натуральном выражении (4) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Уровень инновационности │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Доля инновационных │ % │ 35 │ 37 │ 36 │ 42 │ 45 │ 47 │ 50 │ 51 │ 52 │ 53 │ 53 │ 54 │ 55 │ 56 │ │ лекарственных средств │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в денежном выражении, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ из их (3) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Доля инновационных │ % │ 1 │ 1 │ 4 │ 1 │ 1 │ 1 │ 1 │ 1 │ 1 │ 1 │ 1 │ 1 │ 1 │ 1 │ │ лекарственных средств │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ локального производства │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в денежном выражении (3) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Производство │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Доля производства │ % │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ <1 │ │ лекарственных средств │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в объеме ВВП РФ (2, 3, 5) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Количество фармацевтических │ шт. │ 350 │ 340 │ 325 │ 300 │ 265 │ 250 │ 220 │ 205 │ 185 │ 165 │150 │ 140 │ 125 │ 100 │ │ предприятий-производителей │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ (2, 3, 5, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Количество малых │ шт. │<100 │ <100 │ <100 │ <100 │ <100 │<100 │ <100 │ <100 │ <100 │ <100 │<100│<100 │<100 │<100 │ │ инновационных предприятий │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ (2, 3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Доля производственных │ % │ 9 │ 16 │ 17 │ 23 │ 55 │ 100 │ 100 │ 100 │ 100 │ 100 │100 │ 100 │ 100 │ 100 │ │ мощностей, соответствующих │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ GMP (5) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Разработка ЛС │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Количество отечественных │ шт. │<100 │ <100 │ <100 │ <100 │ <100 │<100 │ <100 │ <100 │ <100 │ <100 │<100│<100 │<100 │<100 │ │ проектов на фазе │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ доклинических исследований │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ (3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Количество отечественных │ шт. │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │<10 │ <10 │ <10 │ <10 │ │ проектов на 1 - 2 фазах │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ клинических испытаний │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ (3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Число отечественных │ шт. │ 5 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │ <10 │<10 │ <10 │ <10 │ <10 │ │ инновационных препаратов, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ выведенных на рынок, │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ в том числе (3, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ для лечения социально │ │ 0 │ <2 │ <4 │ <5 │ <5 │ <5 │ <5 │ <5 │ <5 │ <5 │ <5 │ <5 │ <5 │ <5 │ │ значимых заболеваний (1, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┼──────────┼─────┼──────┼─────────┼──────┼──────┼─────┼──────┼──────┼──────┼──────┼────┼─────┼─────┼─────┤ │ Доля обеспечения │ % │ - │ 10 │ 15 │ 20 │ 25 │ 30 │ 40 │ 45 │ 50 │ 55 │ 60 │ 65 │ 70 │ 75 │ │ лекарственными средствами │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ локального производства │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ из стратегического │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ списка (1) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ ├─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┤ │ Мировой рынок │ ├─────────────────────────────┬──────────┬─────┬──────┬─────────┬──────┬──────┬─────┬──────┬──────┬──────┬──────┬────┬─────┬─────┬─────┤ │ Доля РФ в мировом рынке │ % │<0,02│<0,02 │ <0,02 │<0,02 │<0,02 │<0,02│<0,02 │<0,02 │<0,02 │<0,02 │0,02│0,02 │0,02 │0,02 │ │производства ЛС (2, 3, 5, 7) │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ └─────────────────────────────┴──────────┴─────┴──────┴─────────┴──────┴──────┴─────┴──────┴──────┴──────┴──────┴────┴─────┴─────┴─────┘
Заключение
Фармацевтическая индустрия, являющаяся одним из важнейших элементов системы здравоохранения, стоит на пороге коренных изменений. В наибольшей степени эти изменения должны быть связаны с формированием инновационной составляющей, развитием импортозамещения и ростом производительности труда. Инновационный сценарий развития событий предполагает разработку и принятие Стратегии развития фармацевтической промышленности России, призванной решить проблему лекарственного обеспечения населения России в существующих условиях и на долгосрочную перспективу. Конечной целью всех этих инициатив является создание устойчивой национальной индустрии, способной обеспечить население Российской Федерации доступными, эффективными и безопасными лекарствами в необходимых количествах. Важнейшим элементом Стратегии должна быть направленность на создание нового поколения инновационных лекарств.
Настоящая Стратегия отражает стратегические цели, принципы и задачи развития фармацевтической промышленности, ситуацию в отрасли, проблемы отрасли, способы и пути решения указанных проблем.
Приложение
КОМПЛЕКС МЕРОПРИЯТИЙ
ПО РЕАЛИЗАЦИИ I ЭТАПА СТРАТЕГИИ РАЗВИТИЯ ФАРМАЦЕВТИЧЕСКОЙ
ПРОМЫШЛЕННОСТИ РОССИЙСКОЙ ФЕДЕРАЦИИ ДО 2020 ГОДА
┌──┬───────────────────────────────────┬───────────────┬────────┬──────────────────────────┐ │N │ Мероприятия │ Вид документа │ Сроки │Ответственные исполнители │ │ │ │ (действий) │ │ │ ├──┼───────────────────────────────────┼───────────────┼────────┼──────────────────────────┤ │1 │Внесение изменений в Федеральный │Проект │август │Минздравсоцразвития России│ │ │закон "О лекарственных средствах", │федерального │2009 г. │Минпромторг России │ │ │предусматривающих, в том числе, │закона │ │Минэкономразвития России │ │ │отмену государственной регистрации │ │ │ │ │ │субстанций │ │ │ │ ├──┼───────────────────────────────────┼───────────────┼────────┼──────────────────────────┤ │2 │Доработка проекта технического │Проект │декабрь │Минздравсоцразвития России│ │ │регламента "О безопасности │технического │2009 г. │Минпромторг России │ │ │лекарственных средств", │регламента │ │ │ │ │предусматривающего, в том числе, │ │ │ │ │ │введение обязательных требований к │ │ │ │ │ │производству и контролю качества │ │ │ │ │ │лекарственных средств │ │ │ │ ├──┼───────────────────────────────────┼───────────────┼────────┼──────────────────────────┤ │3 │Подготовка предложений по │Проект │декабрь │Минэкономразвития России │ │ │временному снижению ставок ввозных │постановления │2009 г. │Минпромторг России │ │ │таможенных пошлин на │Правительства │ │Минфин России │ │ │фармацевтические субстанции, не │Российской │ │ │ │ │производимые на территории │Федерации │ │ │ │ │Российской Федерации │ │ │ │ ├──┼───────────────────────────────────┼───────────────┼────────┼──────────────────────────┤ │4 │Подготовка предложений по │Проект │декабрь │Минздравсоцразвития России│ │ │совершенствованию ценообразования │постановления │2009 г. │Федеральная служба по │ │ │на лекарственные средства, │Правительства │ │тарифам России │ │ │предусматривающих, в том числе, │Российской │ │Минпромторг России │ │ │разработку методик по установлению │Федерации, │ │ │ │ │предельных отпускных цен на │ведомственные │ │ │ │ │жизненно необходимые и важнейшие │нормативные │ │ │ │ │лекарственные средства и по │правовые акты │ │ │ │ │установлению органами │ │ │ │ │ │исполнительной власти субъектов │ │ │ │ │ │Российской Федерации предельных │ │ │ │ │ │оптовых и розничных надбавок к │ │ │ │ │ │зарегистрированным ценам на │ │ │ │ │ │лекарственные средства │ │ │ │ ├──┼───────────────────────────────────┼───────────────┼────────┼──────────────────────────┤ │5 │Подготовка предложений по изменению│Проект │декабрь │Минздравсоцразвития России│ │ │процедуры вывоза лекарственных │постановления │2009 г. │Минпромторг России │ │ │средств, не предназначенных для │Правительства │ │Минэкономразвития России │ │ │медицинского применения на │Российской │ │ │ │ │территории Российской Федерации │Федерации │ │ │ ├──┼───────────────────────────────────┼───────────────┼────────┼──────────────────────────┤ │6 │Подготовка предложений по │Доклад в │октябрь │Минпромторг России │ │ │организации отечественного │Правительство │2009 г. │Минздравсоцразвития России│ │ │производства воспроизведенных │Российской │ │Минэкономразвития России │ │ │лекарственных средств, в том числе │Федерации │ │Минобрнауки России │ │ │для замещения дорогостоящих │ │ │ │ │ │лекарственных средств, закупаемых │ │ │ │ │ │для государственных и муниципальных│ │ │ │ │ │нужд │ │ │ │ └──┴───────────────────────────────────┴───────────────┴────────┴──────────────────────────┘