МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЮНОШЕСКИЙ АРТРИТ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: M08.0, M08.3, M08.4, M08.1
Год утверждения (частота пересмотра): 2025 Пересмотр не позднее: 2027
ID: 477_2
Возрастная категория: Дети
Специальность:
Разработчик клинической рекомендации Ассоциация детских ревматологов
Одобрено Научно-практическим Советом Минздрава России
Список сокращений
АКР - Американская коллегия ревматологов
АКРпеди - Педиатрические критерии Американской коллегии ревматологов
АЛТ - Аланинаминотрансфераза
АНФ - Антинуклеарный фактор
АНЦА - Антинейтрофильные цитоплазматические антитела (антитела к цитоплазме нейтрофилов)
АС - анкилозирующий спондилит
АСТ - Аспартатаминотрансфераза
АЦЦП - Антитела к циклическому цитруллинсодержащему пептиду
ВАШ - Визуальная аналоговая шкала
ВЗК - Воспалительные заболевания кишечника
ВВИГ - Иммуноглобулин человека нормальный** (Код АТХ: J06BA - иммуноглобулины нормальные человеческие)
ГИБП - Генно-инженерные биологические препараты (Коды АТХ: L04AB - ингибиторы фактора некроза опухоли альфа, L01XC - моноклональные антитела, L04AC - ингибиторы интерлейкина)
ГК - Глюкокортикоиды
ГГТ - Гамма-глютамилтрансфераза
ГФС - Гемофагоцитарный синдром
ДНК - Дезоксирибонуклеиновая кислота
ЖКТ - Желудочно-кишечный тракт
ИЛ - Интерлейкин
Ингибитор янус-киназ - ингибитор янус-ассоциированной киназы (JAK)
КТ - Компьютерная томография
КК - Креатинкиназа
ЛФК - Лечебная физкультура
ЛДГ - Лактатдегидрогеназа
ЛФК - Лечебная физкультура
МКБ - Международная статистическая классификация болезней и проблем, связанных со здоровьем
МРТ - Магнитно-резонансная томография
НПВП - Нестероидные противовоспалительные и противоревматические препараты (Код АТХ M01A)
ОПП - Острое почечное повреждение
ОРИ - Острая респираторная инфекция
ПЭТ - Позитронная эмиссионная томография
РДС - Респираторный дистресс-синдром
РФ - Ревматоидный фактор
РФП - Радиофармпрепарат (Код АТХ V09: Диагностические радиофармацевтические средства, V10: Терапевтические радиофармацевтические средства)
СОЭ - Скорость оседания эритроцитов
CРБ - C-реактивный белок
СФМ - Система фагоцитирующих мононуклеаров
сЮИА - Системный ювенильный идиопатический артрит
сЮА - Системный юношеский артрит (юношеский артрит с системным началом)
УДД - уровень достоверности рекомендаций
УЗИ - Ультразвуковое исследование
УУР - уровень убедительности рекомендаций
ФК - Функциональный класс
ФНО - Фактор некроза опухоли
ЦМВ - Цитомегаловирус
ЩФ - щелочная фосфатаза
ЭГДС - Эзофагогастродуоденоскопия
ЭКГ - Электрокардиография
ЭхоКГ - Эхокардиография
ЮА - Юношеский артрит
CINCA - Младенческое мультисистемное воспалительное заболевание
FCAS - Семейная холодовая крапивница
FMF - Семейная средиземноморская лихорадка
HLA-B27 - Антиген B27 главного комплекса гистосовместимости 1 класса
Ig G, M, A - Иммуноглобулин G, M, A
ILAR - International League of Associations for Rheumatology (Международная Лига Ревматологических Ассоциаций)
MKD - Мевалоновая ацидурия
MWS - Синдром Макла-Уэлса
PAPA - Синдром PFAPA (Periodic Fever, Aphthous stomatitis, Pharyngitis and Adenitis)
Per os - Через рот, перорально
Scl-70 - Негистонный хромосомный белок Scl-70, который представляет собой фермент топоизомеразу I с молекулярной массой 70 кДа
Th - T лимфоциты хелперы
TRAPS - Периодический синдром, ассоциированный с мутацией рецептора фактора некроза опухолей
Расшифровка примечаний
...** - лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения
...# - "сведения о способе применения лекарственного препарата и дозе, длительности его приема с указанием ссылок на клинические исследования эффективности и безопасности применяемого режима дозирования при данном заболевании либо ссылок на соответствующие источники литературы в случае если тезис-рекомендация относится к лекарственному препарату для медицинского применения, используемому в не соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата" (off label).
Термины и определения
Ювенильный [лат. 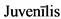 - молодой, юный] - свойственный молодежи; молодой, юношеский.
- молодой, юный] - свойственный молодежи; молодой, юношеский.
Идиопатический [idiopathicus; идио- + греч. pathos страдание, болезнь] - возникающий без видимых причин, характеризующийся неясным происхождением.
Интерлейкины (ИЛ) - группа цитокинов, опосредующих активацию и взаимодействие иммунокомпетентных клеток в процессе иммунного ответа, а также регулирующих процессы миело- и эритропоэза.
Антинуклеарный фактор (АНФ) - аутоантитела, направленные против растворимых компонентов клеточного ядра (рибонуклеопротеинов), составляют целое семейство (более 200 разновидностей) антинуклеарных (антиядерных) антител (АНА).
Ревматоидный фактор (РФ) - аутоантитела, реагирующие в качестве аутоантигена с собственными иммуноглобулинами G, подвергшимися изменениям под влиянием какого-либо агента (например, вируса)
Антинейтрофильные Цитоплазматические Антитела (АНЦА, англ. - ANCA) - аутоантитела к компонентам цитоплазмы нейтрофилов. Встречаются при так называемых АНЦА-ассоциированных заболеваниях, в том числе при АНЦА-ассоциированных васкулитах.
Антитела к циклическому цитруллинсодержащему пептиду (АЦЦП, синонимы - анти-ЦЦП-АТ, анти-ЦЦП, анти-ССР) - гетерогенная группа IgG-аутоантител, которые распознают антигенные детерминанты филаггрина и других белков, содержащих атипичную аминокислоту цитруллин.
Антитела к Scl-70 - антисклеродермальные антитела к негистоновому хромосомному белку Scl-70, который представляет собой фермент топоизомеразы I с молекулярной массой 70 кДа, антитела к топоизомеразе I.
HLA (Human Leukocyte Antigens) - человеческие лейкоцитарные антигены, или система тканевой совместимости человека - группа антигенов гистосовместимости, главный комплекс гистосовместимости у людей.
Молекулы главного комплекса гистосовместимости I класса (A, B, C) - представляют пептиды из цитоплазмы на поверхности клетки (включая вирусные пептиды при их наличии). Эти пептиды представляют собой фрагменты белков, разрушенных в протеасомах. Длина пептидов в среднем около 9 аминокислот. Чужеродные антигены привлекают T-киллеры (также называемые CD8-положительными или цитотоксическими T-клетками), которые уничтожают клетку-носитель антигена. Молекулы этого класса присутствуют на поверхности всех типов клеток, кроме эритроцитов и клеток трофобласта.
Молекулы главного комплекса гистосовместимости II класса (DP, DM, DOA, DOB, DQ, DR) - представляют антигены из пространства вне клетки T-лимфоцитам. Некоторые антигены стимулируют деление T-хелперов, которые затем стимулируют B-клетки для производства антител к данному антигену. Молекулы этого класса находятся на поверхности антигенпредставляющих клеток: дендритных клеток, макрофагов, B-лимфоцитов. Молекулы главного комплекса гистосовместимости III класса кодируют компоненты системы комплемента, белков, присутствующих в крови.
Анкилозирующий спондилит (АС) - хроническое воспалительное заболевание из группы спондилоартритов, характеризующееся обязательным поражением крестцово-подвздошных суставов и/или позвоночника с потенциальным исходом их в анкилоз, с частым вовлечением в патологический процесс энтезисов и периферических суставов
Увеит - воспалительное заболевание сосудистой оболочки глаза.
Увеит передний (иридоциклит) - воспалительное поражение передних отделов увеального тракта.
Энтезит - воспаление entheses, в определенной точке, где сухожилия и связки прикрепляются к кости.
Синдром Рейтера - заболевание, характеризующееся воспалительным поражением мочеполового тракта, суставов и глаз. Синдром Рейтера относится к группе реактивных артритов - негнойных "стерильных" воспалительных заболеваний опорно-двигательного аппарата, спровоцированных внесуставным инфекционным процессом, главным образом мочеполового или кишечного тракта.
Нестероидные противовоспалительные и противоревматические препараты (НПВП) (Код АТХ M01A) - группа лекарственных препаратов, обладающих обезболивающим, жаропонижающим и противовоспалительным эффектами. Подразделяются на селективные (с-НПВП) и неселективные (н-НПВП) ингибиторы фермента циклооксигеназы.
Генно-инженерные биологические препараты (ГИБП) (Код АТХ L04AB - ингибиторы фактора некроза опухоли альфа (фно-альфа), L01XC - моноклональные антитела, L04AC - ингибиторы интерлейкина) - группа лекарственных средств биологического происхождения, в том моноклональные антитела (химерные, гуманизированные, полностью человеческие) и рекомбинантные белки (обычно включают Fc фрагмента IgG человека), полученные с помощью методов генной инженерии, характеризующиеся селективным действием на определенные механизмы развития хронического воспаления, специфически подавляющие иммуновоспалительный процесс и замедляющие прогрессирование деструкции суставов.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Юношеский артрит (син.: ювенильный артрит (ЮА), ювенильный идиопатический артрит (ЮИА)) - артрит неустановленной причины, длительностью более 6 недель, развивающийся у детей в возрасте не старше 16 лет при исключении другой патологии суставов [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Юношеский артрит - генетически детерменированное, мультифакторное заболевание.
Триггерные факторы развития ЮА включают: вирус Эпштейна-Барр, парвовирус B, вирус краснухи, вирус гепатита B, бактерии Salmonella spp., Shigella spp., Campylobacter spp., S. pyogenes, B. Henselae, M. Pneumoniae, Chlamydophila pneumonia), травмы, инсоляцию, психическе травмы.
Фактором риска развития заболевания является курение матери во время беременности, которое увеличивает вероятность иммунного дисбаланса во время развития плода [2].
Юношеский артрит - заболевание с иммуноагрессивным патогенезом. Чужеродный антиген поглощается и перерабатывается антиген-презентирующими клетками (дендритными, макрофагами, B лимфоцитами и др.), которые, в свою очередь, презентируют его T-лимфоцитам (или информацию о нем). Взаимодействие антиген-презентирующей клетки с CD4+-лимфоцитами стимулирует синтез ими соответствующих цитокинов. Интерлейкин 2 (ИЛ 2), вырабатывающийся при активации Th1, взаимодействует со специфическими ИЛ 2-рецепторами, что вызывает клональную экспансию T-лимфоцитов и стимулирует рост B-лимфоцитов. Последнее приводит к массированному синтезу иммуноглобулина (Ig) G плазматическими клетками, повышает активность натуральных киллеров (NK) и активирует макрофаги. ИЛ 4, синтезирующийся Th2-клетками, вызывает активацию гуморального звена иммунитета (что проявляется возрастающим синтезом антител), стимуляцию эозинофилов и тучных клеток, а также развитие аллергических реакций. Активированные клетки (макрофаги, T, B лимфоциты и др.) синтезируют провоспалительные цитокины ИЛ 1, ИЛ 6, ИЛ 8, ИЛ 17, фактор некроза опухолей 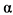 (ФНО
(ФНО 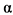 ) и др. Гиперпродукция провоспалительных цитокинов лежит в основе неоангиогенеза; повреждения синовиальной оболочки сустава, хряща (а впоследствии и кости), также в основе развития системных проявлений болезни и трансформации острого иммунного воспаления (свойственного ранней стадии ювенильного артрита) в хроническое с развитием паннуса и необратимым разрушением суставных структур [1, 2].
) и др. Гиперпродукция провоспалительных цитокинов лежит в основе неоангиогенеза; повреждения синовиальной оболочки сустава, хряща (а впоследствии и кости), также в основе развития системных проявлений болезни и трансформации острого иммунного воспаления (свойственного ранней стадии ювенильного артрита) в хроническое с развитием паннуса и необратимым разрушением суставных структур [1, 2].
Юношеский анкилозирующий спондилит - особая форма ЮА, у 90% пациентов ассоциируется с HLA-B27, который кодируется одноименным геном [4 - 6]. HLA-B27 кодирует молекулу главного комплекса гистосовместимости (MHC) класса I, которая участвует в обработке и презентации антигена. Предполагается, что HLA-B27 управляет патогенезом спондилоартропатий посредством трех механизмов: (1) презентации пока еще не идентифицированного артритогенного пептида, который вызывает активацию лимфоцитов, (2) димеризации на поверхности антигенпрезентирующих клеток, вызывающей активацию CD4-лимфоцитов, или (3) индукции стресса эндоплазматического ретикулума, приводящего к секреции цитокинов IL-23 и IL-17, которые в дальнейшем также вызывают активацию T-хелперов 17 (Th17) [4 - 6].
Клетки врожденного иммунитета играют важную роль в патогенезе ЮАС. У пациентов со спондилоартритом макрофаги проникают в синовиальную оболочку пораженных суставов, где продуцируют провоспалительные цитокины, такие как фактор некроза опухоли альфа (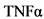 ) [7]. Также у части пациентов с ЮАС наблюдается клинически выраженное или субклиническое воспаление слизистой оболочки кишечника вследствие активации гамма/дельта T-лимфоцитов (
) [7]. Также у части пациентов с ЮАС наблюдается клинически выраженное или субклиническое воспаление слизистой оболочки кишечника вследствие активации гамма/дельта T-лимфоцитов (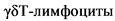 ) или врожденных лимфоидных клеток 3-го типа (ILC3), а также Th17, которые продуцируют цитокины IL-17 и IL-23. В синовиальной жидкости пациентов с ЮАС отмечается преобладание T-хелперов 1 типа [8].
) или врожденных лимфоидных клеток 3-го типа (ILC3), а также Th17, которые продуцируют цитокины IL-17 и IL-23. В синовиальной жидкости пациентов с ЮАС отмечается преобладание T-хелперов 1 типа [8].
Хотя в классическом понимании патогенеза спондилоартрита роль B-лимфоцитов не очевидна, некоторые исследования показывают, что аутоантитела к CD74 (рецептору фактора, ингибирующего миграцию макрофагов (MIF)) могут присутствовать в сыворотке крови пациентов с ЮАС [9]. Во многих актуальных исследованиях изучается роль изменений микробиома кишечника в развитии спондилоартрита, т.к. у детей с ЮАС отмечается уменьшение разнообразия микробиома кишечника и нарушение метаболизма триптофана. Однако попытки нормализовать микробиом кишечника с помощью пробиотиков не способствуют снижению активности заболевания у детей с ЮАС [10].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Юношеский артрит - одно из наиболее частых и самых инвалидизирующих ревматических заболеваний, встречающихся у детей. Заболеваемость ЮА составляет от 1,6 до 23 случаев на 100 тыс. детского населения в возрасте до 16 лет. Распространенность ЮА в разных странах колеблется от 3,8 до 400 случаев на 100 тыс. детей [11 - 13].
Пауциартикулярный (олигоартикулярный) ЮА - составляет от 50 до 80% в структуре ЮИА в Северной Америке и в Европе, 25% - в Восточной Индии, 26% - среди Индейского населения Северной Америки и 31% - в других этнических группах. Пик заболеваемости приходится на возраст 1 - 2 г. Часть детей заболевает после 2-х лет. Но в этих случаях высока вероятность развития других заболеваний - энтезит-ассоциированного артрита, ювенильного анкилозирующего спондилита, псориатического артрита или полиартрита. В Северной Америке и Европе олигоартритом преимущественно болеют девочки, соотношение девочек/мальчиков составляет 3:1. У детей с увеитом соотношение девочки: мальчики больше - от 5:1 до 6,6:1. В Азии олигоартритом чаще болеют мальчики, а увеит развивается редко [1, 3, 11].
Заболеваемость серонегативным полиартритом составляет 1 - 4 на 100 тыс., распространенность - 21 - 37 на 100 тыс. детского населения. Полиартрит составляет 20% в структуре ЮИА. Серонегативный полиартрит может дебютировать в возрасте от 0 до 18 лет. Первый пик заболеваемости приходится на возраст 1 - 3 года; второй - на подростковый возраст. Девочки болеют в 4 раза чаще чем мальчики. Соотношение девочек и мальчиков, заболевших в раннем возрасте, составляет 3:1, в подростковом возрасте - 10:1 [1, 3, 11].
В Европейской популяции примерно у 15% пациентов с полиартритом выявляется ревматоидный фактор (РФ). Серопозитивный ЮА составляет примерно 3% в структуре ЮИА. Частота серопозитивного полиартрита составляет от 51% у детей канадских индейцев; 17% - в восточной Индии; 14% - у афроамериканцев; 12,5% - в Японии; 0,2 - 0,5% - в Европе; 1% - в США. Примерная заболеваемость составляет 0,3 - 0,5 на 100 000 пациенто-лет, распространенность - 0 - 6,7 на 100 000 детей в Европе. Средний возраст дебюта - 9 - 11 лет (1,5 - 15 лет). Девочки болеют значительно чаще, чем мальчики. Соотношение девочки/мальчики составляет от 4:1 до 13:1 [13].
В связи с наличием разногласий в отношении определения и классификационных критериев ЮАС, данных об истинной распространенности заболевания нет. В исследованиях, проведенных в США и Канаде, уровень заболеваемости ЮАС колеблется в пределах от 2,1 до 24,0 случаев на 100 тыс населения. Относительная частота ЮАС среди детей с ЮИА варьирует от 10% до 37,4% в различных популяциях. От 30 до 50% мексиканцев, индийцев и некоторых азиатов заболевают ЮАС в возрасте до 16 лет [14].
По состоянию на 2023 год, на территории Российской Федерации распространенность ЮА у детей до 18 лет достигает 100,3 на 100 тыс. детского населения, первичная заболеваемость - 21,2 на 100 тыс., в том числе у подростков, соответственно, 168,6 на 100 тыс. детского населения и 38,3 100 тыс. детского населения, у детей до 14 лет - 87,2 на 100 тыс. детского населения и 17,9 на 100 тыс. детского населения.
Чаще болеют девочки. Смертность - в пределах 0,5 - 1% [3].
Увеит - преимущественно заболевание взрослых, дети составляют примерно 5 - 10%. Общая заболеваемость увеитом в педиатрической популяции, по данным исследования, проведенного в Финляндии, составила 4,3 человека 100 тыс./год и распространенность - 27,9 на 100 тыс. Сочетание увеита и ЮА встречается у 15 - 67% пациентов. Увеит может предшествовать развитию артрита в 3 - 7% случаев. Увеит, развившийся на фоне суставного синдрома, выявляется у 11,6 - 30,0% детей, в среднем через 1,8 лет от дебюта суставного синдрома. Максимальная частота развития увеита наблюдается при дебюте ЮА в возрасте 1 - 2 лет - 47%; при манифестации артрита в возрасте > 7 лет, увеит развивается в < 10% случаев; манифестация ЮА ассоциированного увеита возможна в любом возрасте [15 - 17].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
В МКБ Юношеский артрит кодируется в разделе "Болезни костно-мышечной системы и соединительной ткани (M00 - M99)".
M08.0 - Юношеский (ювенильный) ревматоидный артрит (РФ+).
M08.1 - Юношеский анкилозирующий спондилит
M08.3 - Юношеский (ювенильный) полиартрит (серонегативный).
M08.4 - Пауциартикулярный юношеский (ювенильный) артрит.
В соответствии с МКБ-10 устанавливается диагноз "Юношеский ревматоидный артрит" или "Юношеский артрит, с активным/неактивным артритом (олиго-/полиартрит)", или "Юношеский анкилозирующий спондилит". При формулировании диагноза обязательно указываются следующие данные:
- степень активности заболевания (0 - 3) на фоне терапии/без терапии, отсутствие/наличие нарушения функции разной степени выраженности (функциональный класс [ФК] 1 - 4);
- рентгенологическая стадия (1 - 4), отсутствие/наличие прогрессирования заболевания; отсутствие/наличие обострений заболевания (число обострений в год);
- необходимость коррекции терапии, возможность достижения ремиссии только при применении иммуносупрессивной терапии препаратами нескольких (2 и более) фармакотерапевтических групп (за исключением нестероидных противовоспалительных препаратов [НПВП]), в том числе генно-инженерными биологическими препаратами (ГИБП);
- наличие осложнений заболевания, осложнений от проводимой медикаментозной терапии.
Примеры диагнозов:
1. Пауциартикулярный юношеский артрит (M08.4) с незначительным нарушением функции суставов; рентгенологическая стадия I, отсутствие прогрессирования заболевания; с отсутствием или наличием обострений (не более 1 раза в год), 0 или I степень активности воспалительного процесса на фоне терапии; ФК I; отсутствие осложнений заболевания от проводимой медикаментозной терапии (НПВП).
2. Юношеский полиартрит, серонегативный (M08.3) с умеренным нарушением функции суставов (ФК II степени); рентгенологическая стадия II; прогрессирующее течение заболевания: обострения 2 - 4 раза в год, сохраняющаяся активность воспалительного процесса I или II степени на фоне иммуносупрессивной терапии; необходимость коррекции терапии, возможность достижения ремиссии только при применении иммуносупрессивной терапии препаратами нескольких (2 и более) фармакотерапевтических групп (за исключением НПВП), в том числе ГИБП; наличие осложнений заболевания и проводимой медикаментозной терапии.
3. Юношеский полиартрит, серонегативный (M08.3) с выраженным нарушением статодинамической функции, вследствие поражения суставов; рентгенологическая стадия II или III, прогрессирующее течение заболевания; частые длительные обострения (более 4 раз в год), ФК II или III; сохраняющаяся активность воспалительного процесса 2 или 3 степени на фоне иммуносупрессивной терапии; возможность достижения ремиссии только при применении иммуносупрессивной терапии препаратами нескольких (2 и более) фармакотерапевтических групп (за исключением НПВП); в том числе ГИБП; наличие осложнений заболевания и проводимой медикаментозной терапии.
4. Ювенильный ревматоидный артрит, серопозитивный (M08.0) со значительно выраженными нарушениями статодинамических функций, обусловленные поражением суставов; рентгенологическая стадия III или IV; быстро прогрессирующее течение заболевания; активность воспалительного процесса 3 степени; ФК III или IV; низкая эффективность или резистентность к проводимой иммуносупрессивной терапии препаратами нескольких фармакотерапевтических групп (2 и более, включая ГИБП); наличие необратимых осложнений заболевания и проводимой медикаментозной терапии.
5. Юношеский анкилозирующий спондилит (M08.1) с отсутствием или незначительным нарушением функции суставов; рентгенологическая стадия I, отсутствие прогрессирования заболевания; с отсутствием или наличием обострений (не более 1 раза в год), 0 или I степень активности воспалительного процесса на фоне терапии; ФК I; отсутствие осложнений заболевания от проводимой медикаментозной терапии (НПВП).
6. Юношеский анкилозирующий спондилит (M08.1) с выраженным нарушением статодинамической функции, вследствие поражения суставов; рентгенологическая стадия II или III, прогрессирующее течение заболевания; частые длительные обострения (более 4 раз в год), ФК II или III; сохраняющаяся активность воспалительного процесса 2 или 3 степени на фоне иммуносупрессивной терапии; возможность достижения ремиссии только при применении иммуносупрессивной терапии препаратами нескольких (2 и более) фармакотерапевтических групп (за исключением НПВП); в том числе ГИБП; наличие осложнений заболевания и проводимой медикаментозной терапии.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Помимо кодирования по МКБ-10, Международной лигой ревматологических ассоциаций (ILAR) разработана классификация ювенильного идиопатического артрита (ЮИА), в соответствии с которой различают следующие варианты ЮИА без системных проявлений, соответствующие МКБ-10 [18]:
- Олигоартрит - M08.4 - Пауциартикулярный юношеский (ювенильный) артрит.
- олигоартрит персистирующий
- олигоартрит прогрессирующий
- Полиартрит, РФ-негативный - M08.3 - Юношеский (ювенильный) полиартрит (серонегативный).
- Полиартрит, РФ-позитивный M08.0 - Юношеский (ювенильный) ревматоидный артрит (РФ+).
- Артрит, ассоциированный с энтезитом - M08.1 - Юношеский анкилозирующий спондилит
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Основным клиническим проявлением всех вариантов ЮА является артрит.
M08.4 - Пауциартикулярный юношеский (ювенильный) артрит (олигоартикулярный ЮИА)
Определение. Артрит с поражением 1 - 4 суставов в течение первых 6 месяцев болезни [18].
Имеются 2 субварианта:
1. Олигоартикулярный персистирующий: артрит с поражением 1 - 4 суставов в течение всей болезни.
2. Олигоартикулярный распространившийся: поражение 5 и более суставов после 6 месяцев болезни.
Критерии исключения:
1) псориаз у ребенка или родственников первой линии;
2) артрит, ассоциированный с HLA B27 антигеном, у мальчиков старше 6 лет;
3) анкилозирующий спондилит, артрит, ассоциированный с энтезитом, сакроилеит при наличии воспалительных заболеваний кишечника, синдром Рейтера, передний увеит у родственников первой степени родства;
4) наличие ревматоидного фактора не менее чем в двух анализах в течение 3 месяцев;
5) наличие системного артрита.
M08.3 - Юношеский (ювенильный) полиартрит (серонегативный) (полиартикулярный ЮИА, РФ-негативный (серонегативный)
Определение. Артрит с поражением 5 или более суставов в течение первых 6 месяцев болезни, тест на РФ - отрицательный [18].
Критерии исключения:
1) псориаз у ребенка или родственников первой линии;
2) артрит, ассоциированный с HLA B27 антигеном, у мальчиков старше 6 лет;
3) анкилозирующий спондилит, артрит, ассоциированный с энтезитом, сакроилеит при наличии воспалительных заболеваний кишечника, синдром Рейтера, передний увеит у родственников первой степени родства;
4) наличие ревматоидного фактора не менее чем в двух анализах в течение 3 мес.;
5) наличие системного артрита.
M08.0 - Юношеский (ювенильный) ревматоидный артрит (РФ+) (полиартикулярный ЮИА, РФ-позитивный (серопозитивный)
Определение. Артрит с поражением 5 или более суставов в течение первых 6 месяцев болезни, ассоциированный с положительным РФ в двух тестах в течение 3 месяцев [18].
Критерии исключения:
1) псориаз у ребенка или родственников первой линии;
2) артрит, ассоциированный с HLA B27, у мальчиков старше 6 лет;
3) анкилозирующий спондилит, артрит, ассоциированный с энтезитом, сакроилеит при наличии воспалительных заболеваний кишечника, синдром Рейтера, передний увеит у родственников первой степени родства;
4) наличие системного артрита.
Полиартикулярный РФ позитивный вариант фактически по клиническому фенотипу, лабораторным иммуногенетическим показателям является разновидностью РФ+ ревматоидного артрита взрослых. Оба заболевания могут развиться в одной семье [1, 4].
M08.1 - Юношеский анкилозирующий спондилит (артрит, ассоциированный с энтезитом)
Определение. Это артрит и энтезит, или артрит или энтезит в сочетании по меньшей мере с 2 из следующих признаков [18]:.
Критерии исключения:
1) псориаз у ребенка или родственников первой линии;
2) наличие системного артрита.
Общие проявления. Лихорадка - как правило субфебрильная. В ряде случаев может наблюдаться острый дебют, похожий на дебют и течение юношеского артрита с системным началом с фебрильной лихорадкой, пятнистой, пятнисто-папулезной сыпью, выраженной интоксикацией, артралгией, миалгией [1]. У большинства пациентов периодические артралгии, миалгии и скованность в периферических суставах развиваются вместе с энтезитом, преимущественно в коленных, голеностопных суставах и суставах стопы. Поражение позвоночника (спондилит) и крестцово-подвздошных сочленений (сакроилеит) - как правило, по мере прогрессирования заболевания [19, 20].
Периферический артрит. Периферический артрит при ЮАС характеризуется асимметричным поражением в основном крупных суставов нижних конечностей - коленных, тазобедренных, голеностопных. Как правило развивается асимметричный олигоартрит, но также может наблюдаться и полиартит с вовлечение в процесс мелких суставов стоп, пальцев стопы, а также грудинно-ключичного сочленения [20, 21]. В отличие от других подтипов ЮА, поражение тазобедренного сустава при ЮАС встречается относительно часто [22], а поражение мелких суставов кистей, наоборот, редко [1].
Энтезит. Энтезит - воспаление энтезиса, который представляет собой участок прикрепления связочно-сухожильного компонента сустава к кости. Характеризуется болью и отеком, преимущественно в области коленного сустава, стопы или пятки. Наличие энтезита помогает отличить ЮАС от других подтипов ЮИА. Однако болезненность в области энтезисов может возникать и при других ревматических заболеваниях, включая другие подтипы ЮИА, и даже у детей без каких-либо заболеваний [23]. Кроме того, следует исключить болезнь Осгуда-Шлаттера и фибромиалгию, поскольку эти состояния также сопровождаются сходными симптомами [24].
Поражение осевого скелета. Поражение позвоночника и крестцово-подвздошных сочленений встречается относительно редко в дебюте ЮАС, но может развиться через несколько лет после его начала [25]. Поражение осевого скелета не редко протекает бессимптомно [26 - 28], но также может проявляться болью, особенно в нижней части спины и ягодичных областях, или скованностью и ограничением движений в позвоночнике. Длительные периоды отсутствия физической нагрузки могут усугубить эти симптомы. Физикальное обследование позволяет выявить болезненность при пальпации в области крестцово-подвздошных сочленений, боль при сгибании, отведении и наружной ротации бедра (тест Патрика или FABER-тест), ограничение подвижности позвоночника в поясничном отделе в сагиттальной плоскости при наклонах вперед (тест Шобера). Также встречается поражение шейного отдела позвоночника [29].
Увеит, ассоциированный с юношеским артритом.
Увеит наиболее часто развивается при пауциартикулярном юношеском артрите, серонегативном полиартрите и юношеском анкилозирующем спондилите. Для увеита, развивающегося у пациентов с поли- и пауциартикулярным характерно асимптомное, хроническое течение, верификация диагноза уже при значительном снижении у ребенка остроты зрения. Для увеита, развивающегося ЮАС характерно острое течение со слезотечением, светобоязнью, болью и покраснением глаз, ухудшением зрения, головной болью.
Факторы риска развития увеита у пациентов с ЮА: моно/олигоартрит; возраст дебюта суставного синдрома до 4 лет (по некоторым данным до 6 лет); женский пол (75 - 80%); циркулирующие антинуклеарные антитела (ANA) (выявляются в 66 - 92% случаев при сочетании ЮИА с увеитом, без увеита (30 - 42%)); HLA фенотип (HLA-B27, HLA-DR5, HLA-DRB1*13); анти-гистоновые антитела; повышенное СОЭ [16, 17, 30, 31].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Обследование пациентов с подозрением на юношеский артрит
- Рекомендуется проведение диагностики, в том числе дифференциальной диагностики, в условиях ревматологического стационара, всем пациентам с подозрением на ЮА с целью его подтверждения/исключения [1, 3, 32]. (УДД 5, УУР C)
2.1 Жалобы и анамнез
- Рекомендуется проведение анализа жалоб всем пациентам с целью выявления клинических проявлений ЮА [1, 3, 4]. (УДД 5, УУР C)
Комментарии: жалобы при олиго-, полиартрите: на утреннюю скованность или скованность в суставах, которая развивается после состояния покоя длительностью от нескольких минут до нескольких часов; боль и/или припухлость, и/или ограничение движений в суставах, нарушение походки; повышение температуры тела, как правило до суфебрильных зачений, слабость, усталость, быструю утомляемость [1, 4, 32]. При ЮАС - на боль в ягодицах, области паха, бедрах, пятках, вокруг плечевых суставов, реже (примерно у 24% пациентов) на боль, скованность или ограничение функции в пояснично-крестцовом отделе позвоночника или крестцово-подвздошных сочленениях. Боль может спонтанно проходить, что затрудняет постановку диагноза на ранних стадиях. У детей реже, чем у взрослых с АС, в дебюте болезни поражается осевой скелет: Дебют ЮАС может быть постепенным (иногда острым) и характеризоваться непостоянной болью в мышцах, суставах и связках, скованностью или воспалительными изменениями, преимущественно в периферических суставах. Артрит, как правило, сочетается с энтезитами в одном или более локусах: чаще в области коленного сустава или стопы. Заболевание может дебютировать также с изолированного поражения тазобедренного сустава. Симптомы поражения позвоночника в дебюте у подростков обычно отсутствуют, но могут появиться в ходе болезни [1, 3, 4].
Для всех вариантов ЮИА характерно развитие увеита, коьоры может носить острый, подострый и хронический характер (вялотекущий или рецидивирующий). Хронический увеит развивается примерно у 15% пациентов с РФ-полиартритом и у 20% - с олигоартритом [1, 2, 6], дети как правило жалоб не предъявляют, увеит развивается исподволь и выявляется на этапе снижения остроты зрения и появления деформации зрачка. При ЮАС в большинстве случаев развивается острый увеит, который сопровождается раздражением глаз, болевым синдромом в глазном яблоке, снижением и (или) затуманивание зрения, появлением плавающих пятен перед глазами, покраснением глаз, светобоязнью, слезотечением.
По локализации увеит может быть передним (ирит, передний циклит, иридоциклит) - воспаление радужной оболочки и (или) цилиарного тела; периферическим (задний циклит) с вовлечением цилиарного тела, периферических отделов собственно сосудистой оболочки; задним (хориоидит, хориоретинит) - воспаление собственно сосудистой оболочки. В ряде случаев развиться панувеит.
В зависимости от числа пораженных глаз - односторонним и двусторонним [1, 2, 6, 7, 11].
- Рекомендуется проведение анализа гинекологического и акушерского анамнеза матерей всех пациентов с подозрением на ЮА с целью выявления факторов, предрасполагающих к развитию заболевания [1, 3, 4]. (УДД 5, УУР C)
Комментарии: выяснение наличия урогенитальных и других инфекций (хламидийной, микоплазменной, цитомегаловирусной, герпетической, вируса Эпштейна-Барр и др.), которые могут быть триггерами ЮА у ребенка, до и во время беременности. Данные о течении предыдущих беременностей. Необходимо выяснить, имели ли место внутриутробная гибель плода, хроническое невынашивание беременности, преждевременные роды, первичное или вторичное бесплодие. Все эти патологии могут быть следствием внутриутробного инфицирования плода, в частности вирусной и бактериальной инфекцией. Данные о течении настоящей беременности (вредности, с которыми мать имела дело во время беременности, гестозы первой и второй половины, угрозы прерывания на ранних и поздних сроках, анемия беременных, перенесенные заболевания во время беременности). Данные о течении родов (своевременность родов, длительность безводного промежутка, длительность первого и второго периодов родов, характер околоплодных вод, своевременность отделения плаценты и ее качество).
- Рекомендуется проведение анализа анамнеза жизни всем пациентам с целью выявления факторов, предрасполагающих к развитию заболевания [1, 3, 4, 32, 33]. (УДД 5, УУР C)
Комментарии: особое внимание необходимо обратить на клинические проявления инфекций: конъюнктивит, омфалит, баланит, баланопостит, инфицированные синехии крайней плоти (у мальчиков), цистит, вульвовагинит, вульвит, асимптомная лейкоцитурия, дизурические явления, цистит (у девочек), частые отиты, бронхиты, пневмонии, наличие герпетических высыпаний на лице, частые ОРИ, кишечные инфекции. Необходимо обратить внимание на наличие аллергических реакций, а также реакций на профилактические прививки, наличие животных, птиц в доме.
- Рекомендуется проведение анализа наследственного анамнеза всем пациентам с целью выявления факторов, предрасполагающих к развитию заболевания [1, 3, 4]. (УДД 5, УУР C)
Комментарии: необходимо установить, есть ли у пациента родственники первой или второй линии родства, страдающие следующими заболеваниями: ревматоидным артритом, острой ревматической лихорадкой, системной красной волчанкой, дерматомиозитом, склеродермией и др., болезнью Рейтера, болезнью Бехтерева, болезнью Крона, язвенным колитом, псориазом, увеитом.
- Рекомендуется проведение анализа анамнеза заболевания всем пациентам с целью выявления особенностей течения патологического процесса [1, 3, 4]. (УДД 5, УУР C)
Комментарии: оценить характер дебюта (острый или подострый, с поражением или без поражения глаз). Необходимо выяснить, что предшествовало развитию болезни (травма, ОРИ, бактериальная инфекция, прививка, инсоляция, психологическая травма, урогенитальная, кишечная инфекция, конъюнктивит, бронхолегочная инфекция, отит), получал ли пациент антибактериальные препараты и/или глюкокортикоидные гормоны: какие, какова была их доза и продолжительность приема.
Дебют серонегативного полиартрита может быть острым, но чаще подострый, с постепенным вовлечением в процесс новых суставов.
Дебют ЮАС может быть острым или подострым, с поражением или без поражения суставов, позвоночника, глаз.
2.2 Физикальное обследование
- Рекомендуется проведение термометрии общей всем пациентам с целью оценки выраженности и характера лихорадки [1, 3, 4]. (УДД 5, УУР C)
Комментарии: Повышение температуры тела не характерно для ЮА без системных проявлений. Однако лихорадка может наблюдаться при полиартикулярном ЮА, особенно при серопозитивном ЮА, ЮАС. Температура, как правило, субфебрильная, редко фебрильная.
- Рекомендуется проведение оценки общего состояния всем пациентам с целью последующего динамического мониторинга [1, 3, 32]. (УДД 5, УУР C)
Комментарии: общее состояние, как правило, средней тяжести, иногда тяжелое, в периоды ремиссии - удовлетворительное. Часто пациенты отмечают утреннюю скованность, которая может длиться несколько часов, дети не могут ходить и себя обслуживать. У пациентов с полиартритом на высоте лихорадки может отмечаться нарастание болевого синдрома в суставах и мышцах. При снижении температуры тела самочувствие нормализуется, ребенок становится активным.
- Рекомендуется проведение осмотра кожных покровов всем пациентам с целью выявления сыпи и признаков васкулита [1, 3, 4]. (УДД 5, УУР C)
Комментарии: высыпания не характерны для ЮА без системных проявлений. Могут быть выявлены ревматоидные узелки. Наиболее часто они формируются при серопозитивном полиартрите (у 30% пациентов), реже при РФ негативном полиартрите - менее чем у 1% пациентов.
Узелки обычно локализуются дистальнее олекранона и других костных выступах, в зоне давления. Узелки при пальпации подвижные, безболезненные, но надавливание может вызвать боль. Ревматоидные узелки - факторы неблагоприятного прогноза у пациентов с РФ позитивным полиартритом. Иногда узелки бывают следствием лечения метотрексатом** (МТ). В этом случае они множественные, развиваются в короткое время; локализуются на руках и быстро исчезают при прекращении лечения МТ.
Ревматоидные узелки необходимо дифференцировать с подкожными узелками при острой ревматической лихорадке, которые меньше в размере и не ассоциируются с хроническим артритом.
Кожный васкулит очень редкое проявление ЮА без системных проявлений и чаще всего развивается у детей старшего возраста с РФ позитивным полиартритом.
- Рекомендуется проведение осмотра и пальпации лимфатических узлов всем пациентам с целью выявления лимфаденопатии [1, 3, 4]. (УДД 5, УУР C)
Комментарии: лимфаденопатия не характерна для ЮА без системных проявлений, но может наблюдаться при РФ негативном ЮА. Лимфатические узлы, как правило, подвижные, безболезненные, не спаянные между собой и с подлежащими тканями, мягко- или плотноэластической консистенции.
- Рекомендуется проведение анализа жалоб, анамнеза, осмотра, перкуссии, пальпации и аускультации органов сердечно-сосудистой системы всем пациентам с целью выявления физикальных признаков поражения сердца и сосудов [1, 3, 4, 34, 35]. (УДД 3, УУР C)
Комментарии: поражение сердца крайне редко развивается при олиго- и РФ негативном полиартрите. При РФ позитивном полиартрите редко, но может поражаться аортальный клапан. Развивается аортальная недостаточность, и, возможно, острая сердечная недостаточность. Как правило, поражение сердца манифестирует через 4 - 17 лет после начала РФ позитивного полиартрита, но патологические шумы в сердце могут выслушиваться уже через год после дебюта заболевания.
Поражение сердечно-сосудистой системы при ЮАС наблюдается редко, развиваются: аортит (поражение восходящей части аорты, преимущественно ее корня); поражение створок аортального клапана с развитием его недостаточности; поражение мембранозной части межжелудочковой перегородки с нарушением атриовентрикулярной и внутрижелудочковой проводимости. Аортальная недостаточность, блокада проводимости развиваются примерно у 5% пациентов в среднем через 15 лет после дебюта заболевания. В редких случаях поражение сердца предшествует развитию сакроилеита. В случае поражения аортального клапана при аускультации могут выслушиваться шумы.
- Рекомендуется проведение анализа жалоб, анамнеза, осмотра перкуссии, аускультации легких всем пациентам с целью выявления физикальных признаков ее поражения [1, 3, 4, 36]. (УДД 3, УУР B)
Комментарии: в ряде случаев ребенок может жаловаться на кашель, затруднение дыхания, одышку. Поражение легких у детей с олигоартритом и РФ негативным полиартритом наблюдается редко. При РФ позитивном полиартрите поражение легких также редкое проявление, но может протекать в двух вариантах, как лимфоидный интерстициальный пневмонит или облитерирующий бронхиолит. Поражение легких может развиваться в детском, подростковом или взрослом возрасте через 10 - 20 лет после дебюта ЮА. Визуально при осмотре пациента признаки поражения легких могут не выявляться, в ряде случаев развивается дыхательная недостаточность, проявляющаяся одышкой, втяжением уступчивых мест грудной клетки, эпигастральной области, мест прикрепления диафрагмы к реберной дуге; цианозом. Перкуторный звук может быть нормальным, с коробочным оттенком; с притуплением в задненижних отделах легких; при аускультации могут выявляться разнокалиберные влажные и крепитирующие хрипы, шум трения плевры, ослабление дыхания в задненижних отделах легких.
При ЮАС поражение паренхимы легких наблюдается редко. Может наблюдаться фиброз верхушек легких.
- Рекомендуется проведение анализа жалоб, анамнеза, осмотра, перкуссии и пальпации органов пищеварительной системы всем пациентам с целью выявления физикальных признаков ее поражения [1, 3, 32]. (УДД 5, УУР C)
Комментарии: пациенты с ЮА часто жалуются на боли в эпигастральной области, диспепсические явления. Боли в околопупочной области могут быть связаны с увеличением мезентериальных лимфатических узлов. При осмотре могут выявляться дефицит массы тела, обложенность языка, вздутие живота; при перкуссии брюшной полости - увеличение размеров печени и селезенки (увеличение печени и селезенки при ЮА без системных проявлений наблюдается редко, чаще при РФ позитивном полиартрите). Значительное увеличение селезенки, сопровождающееся нейтропенией и инфекциями характерно для синдрома Фелти, который у детей развивается очень редко. Прогрессирующее увеличение размеров печени характерно для вторичного амилоидоза. При пальпации может выявляться болезненность в эпигастрии в точках проекции желчного пузыря, 12-перстной кишки, поджелудочной железы, увеличение размеров печени и селезенки; при поражении кишечника - болезненность в илеоцекальном углу, а также по ходу толстой кишки.
У большинства детей с ЮА развивается воспаление верхних отделов желудочно-кишечного тракта (ЖКТ), связанное с применением НПВП.
- Рекомендуется проведение осмотра суставов всем пациентам с целью выявления активного артрита [1, 3, 4]. (УДД 5, УУР C)
Комментарии: необходимо обследовать суставы на наличие припухлости. Следует оценить температуру кожи над суставами, а затем - разницу температур симметричных участков кожи.
При РФ негативном полиартрите наиболее часто поражаются коленные, лучезапястные, голеностопные и мелкие суставы кистей рук и стоп как в дебюте заболевания, так и на всем протяжении болезни. Наиболее часто поражаются 2 и 3 метакарпофаланговые и проксимальные межфаланговые суставы. Дистальные межфаланговые суставы у детей в начале болезни поражаются крайне редко. Височно-нижнечелюстные суставы при РФ-полиартрите поражаются значительно чаще, чем при РФ+ полиартрите. Формируется "птичья" челюсть. Шейный отдел позвоночника в дебюте РФ- полиартрита поражается редко, но с течением заболевания наблюдается ограничение движений (разгибания) в шейном отделе позвоночника. На поздних стадиях может развиться анкилоз апофизальных суставов 2 и 3 позвонков. При полиартикулярном РФ негативном варианте ЮА число пораженных суставов меньше, а характер суставного синдрома более асимметричный, чем при серопозитивном варианте заболевания; запястья и мелкие суставы кистей рук поражаются реже; тазобедренные суставы в дебюте вовлекаются в процесс у 20% пациентов; с течением болезни в них прогрессируют деструктивные изменения. При полиартикулярном РФ негативном ЮА более выражено нарушение роста, чем при серопозитивном полиартрите. У некоторых больных РФ негативным полиартритом отсутствует выпот в суставах и гипертрофия синовиальной оболочки, в то же время у этих пациентов прогрессируют контрактуры в суставах, что сопровождается повышением лабораторных показателей воспаления. Этот вид полиартрита получил название "сухой синовит".
При полиартикулярном РФ позитивном варианте ЮА поражаются крупные и мелкие суставы верхних и нижних конечностей, шейный отдел позвоночника, височно-нижнечелюстные суставы. Типично развитие симметричного артрита с поражением пястно-фаланговых и межфаланговых суставов, суставов запястья, мелких суставов стоп и проксимальных межфаланговых суставов стоп. В отличие от РФ негативного полиартрита при РФ позитивном варианте болезни при поражении височно-нижнечелюстных суставов не развивается микрогнатия из-из более позднего дебюта, В лучезапястных суставах очень быстро развивается нарушение функции и деформации: ульнарная девиация запястья и метакарпофаланговых суставов, деформация по типу бутоньерки и шеи лебедя в пальцах рук. Также развиваются деформации в суставах ног: hallus valgus - деформация в первых метататарзофаланговых суставах, деформации по типу камертона и др.
При олигоартрите первые 6 мес. болезни характеризуются воспалительными изменениями в 4-х и менее суставах. У ребенка отсутствуют системные проявления, за исключением хронического увеита. Поражаются преимущественно суставы нижних конечностей - коленные (у 89%), голеностопные (у 36%), мелкие суставы пальцев рук и стоп (у 6%). Локтевые, тазобедренные, лучезапястные, челюстно-височные суставы поражаются у 3% пациентов. У 50% развивается моноартрит с поражением коленного сустава. Суставы при олигоартрите, как правило, припухшие, теплые, но не очень болезненные и никогда не бывают красными.
При ЮАС суставной синдром, как правило, асимметричный. Периферические суставы поражаются у 82% больных, суставы верхних конечностей - у 16%, дистальные суставы поражаются чаще, чем проксимальные. У 75% больных развивается олигоартрит, у 25% - полиартрит. Характерны вовлечение в процесс одного или обоих коленных суставов, голеностопных суставов, мелких суставов стоп и пальцев ног; развитие тарзита, сопровождающегося болью, скованностью, нарушением функции; поражение I метатарзофалангового сустава с формированием hallux valgus. Часто в процесс вовлекаются плечевые, челюстно-височные и грудино-ключичные суставы, редко - тазобедренные, крайне редко - мелкие суставы кистей рук. Боль в грудино-ключичных и ключично-акромиальных суставах в сочетании с болью в ключице может приводить к нарушению экскурсии грудной клетки.
- Рекомендуется проведение осмотра суставов осевого скелета всем пациентам с целью выявления спондилита [1, 3, 4, 26, 29, 32, 37]. (УДД 5, УУР C)
Комментарии: при ЮАС суставы осевого скелета вовлекаются в процесс на поздних стадиях болезни. У детей с сакроилеитом боль может возникать при прямом надавливании на один или оба крестцово-подвоздошных сустава, на таз. Также может определяться припухлость в области крестца.
При поражении позвоночника выявляются сглаженность поясничного лордоза, усиление грудного кифоза, увеличение расстояния от головы до стены при проведении диагностических проб, исчезновение физиологических изгибов позвоночника и ригидность в различных его отделах.
Поражение грудного отдела позвоночника может приводить к ограничению экскурсии грудной клетки. На поздних стадиях болезни, как правило, во взрослом возрасте развивается "поза просителя".
Провести оценку функциональных проб Томаера, Отта, Шобера, Зацепина, Форестье, пробы подбородок. Определение болезненности по ходу остистых отростков позвоночника и в паравертебральных точках.
Симптом Зацепина - болезненность при надавливании у места прикрепления к позвонкам X - XII ребер в связи с воспалительным процессом в реберно-позвонковых сочленениях.
Симптом Форестье выявляется для определения формы осанки. Больной стоит спиной к стенке, прикасаясь к ней пятками, туловищем, головой. В норме к стенке должны прикасаться пятки, лопатки, затылок. У больных анкилозирующим спондилитом и болезнью Форестье вследствие развития кифоза не будет соприкосновения в какой-либо точке.
Определение подвижности в шейном отделе позвоночника. От CVII отмеряют вверх 8 см и делают отметку. Затем просят больного максимально наклонить голову вниз и снова измеряют это расстояние. У здоровых лиц оно увеличивается на 3 см.
При поражении шейного отдела позвоночника это расстояние увеличивается незначительно или вообще не меняется. У больных с анкилозирующим спондилоартритом, с короткой шеей проба не информативна.
Проба подбородок - грудина: здоровый человек свободно дотрагивается подбородком до грудины. При поражении шейного отдела позвоночника остается расстояние между подбородком и грудиной при максимальном наклоне головы вперед.
Проба Отта выполняется для определения подвижности в грудном отделе позвоночника. От CVII вниз отмеряют 30 см и делают отметку. Затем расстояние между указанными точками измеряют повторно при максимальном наклоне обследуемого вперед. У здоровых людей это расстояние увеличивается на 4 - 5 см, а у больных анкилозирующим спондилитом практически не изменяется.
Определение ограничения дыхательных экскурсий грудной клетки - для выявления патологического процесса в реберно-позвоночных суставах. Измерение производится сантиметровой лентой на уровне IV ребра. В норме разница окружности грудной клетки между максимальным вдохом и выдохом составляет 6 - 8 см. При развитии анкилоза реберно-позвоночных суставов эта разница уменьшается до 1 - 2 см. При наличии эмфиземы легких проба не информативна.
Проба Шобера выполняется для выявления ограничения подвижности в поясничном отделе позвоночника. От LV откладывают вверх 10 см и делают отметку. При максимальном наклоне вперед у здоровых лиц это расстояние увеличивается на 4 - 5 см, а при поражении поясничного отдела позвоночника практически не меняется.
Проба Томайера выполняется для оценки общей подвижности позвоночника. Определяется путем измерения в сантиметрах расстояния от III пальца вытянутых рук до пола при максимальном наклоне вперед. Это расстояние в норме равно "0" и увеличивается при ограничении сгибания позвоночника.
- Рекомендуется определение объема движения во всех суставах: определение объема пассивного движения одного сустава в одной плоскости, определение объема активного движения одного сустава в одной плоскости всем пациентам с целью выявления функциональной недостаточности [1, 3, 4, 26, 29, 32, 37]. (УДД 5, УУР C)
Комментарии: в случае отсутствия болезненности в суставах при обычной амплитуде движений необходимо оценить появление боли (защитного напряжения мышц, сопротивления) при максимальной амплитуде движений.
Оценивают объем движений:
- Шейный отдел позвоночника. Попросить: забросить голову назад (разгибание в норме - 50 - 60°), достать подбородком до грудины (сгибание в норме - 45°), повернуть голову вправо, влево (ротация в норме 60 - 80°), положить голову на правое и левое плечо (боковое сгибание в норме - 40°).
- Челюстно-височные суставы. Попросить: открыть рот, выдвинуть вперед и назад нижнюю челюсть, произвести боковые движения нижней челюстью из стороны в сторону.
- Плечевые суставы. Попросить: поднять руки через стороны вверх, достать правое и левое ухо через затылок, достать правую и левую лопату противоположной кистью сзади, снять самостоятельно рубашку, майку, причесаться.
- Локтевые суставы. Попросить: положить кисти на плечи (в норме угол сгибания не более 20°), разогнуть руку в локтевом суставе (в норме - не менее 180°), проверить пронацию и супинацию (в норме - 90°).
- Лучезапястные суставы. Проверить: тыльное сгибание (в норме - 70°), ладонное сгибание (в норме - 90°).
- Мелкие суставы кистей рук. Попросить: собрать пальцы в кулак (кулак должен быть плотным), снять самостоятельно носки и колготки, расстегнуть и застегнуть пуговицы. В норме пальцы легко касаются ладони.
- Тазобедренные суставы: проверить отведение (в норме - не менее 140°), приведение (должен коснуться бедрами и коленями груди), ротация наружная и внутренняя (в норме - не менее 40 - 45°).
- Проба на внутреннюю ротацию в тазобедренных суставах. При этом ребенок лежит на спине с согнутыми под углом 90° тазобедренными и коленными суставами. Держа колени вместе, поворачивают голени кнаружи.
- Почти при всех заболеваниях тазобедренных суставов в первую очередь изменяется внутренняя ротация.
- Коленные суставы. Попросить: согнуть ноги в коленных суставах (должен достать пяткой до ягодицы), сесть на колени и опустить ягодицы на пятки, разогнуть коленные суставы (в норме - угол 180°), присесть на корточки.
- Проверить симптом баллотации надколенника.
- Нижние конечности сгибают в коленных суставах. Обычно касание пятками ягодиц происходит без труда. Максимально разгибают нижние конечности в коленных суставах в положении ребенка на спине.
- Суставы стоп, голеностопные суставы. Проверить: тыльное сгибание (в норме - угол 45°), подошвенное разгибание (в норме - угол 20°), супинация (поворот стопы внутрь - 30°), пронация (в норме поворот стопы кнаружи - 20°). Попросить: встать на цыпочки и пройти, встать на пятки и пройти (в норме ребенок должен сделать это без затруднений). Наблюдают за асимметрией при перемещении лодыжек в разных направлениях. Заметное ограничение сгибания выявляют обычно без затруднений, даже при отсутствии видимой припухлости суставов.
- Рекомендуется оценить походку всем пациентам с целью выявления характера ее нарушения [1, 3, 4, 26, 29, 32, 37]. (УДД 5, УУР C)
Комментарии: варианты походки:
- с быстрым переносом массы тела с больной ноги на здоровую (поражение коленных, тазобедренных суставов, стоп). Больной встает на всю стопу или носок (поражение пятки),
- "утиная" - переваливающаяся (двустороннее поражение тазобедренных суставов).
Наблюдение за походкой при ходьбе и беге: хромота у пациента - это важный диагностический ключ для выявления боли или скованности. Максимально выражены хромота и нарушение походки у детей с ЮА в утренние часы за счет утренней скованности. При осмотре пациента во второй половине дня хромоты может не быть, нарушение походки минимально или не выражено.
- Рекомендуется проведение осмотра энтезисов всем пациентам с целью выявления их поражения [1, 3, 4, 26, 29, 32, 37]. (УДД 5, УУР C)
Комментарии: энтезиты (воспалительные изменения в местах прикрепления связок, сухожилий и фасций к костям) - патогномоничный признак артрита, ассоциированного с энтезитом, позволяющий провести дифференциальный диагноз с другими вариантами ЮИА.
Энтезиты типичны для ЮАС развиваются чаще, чем при АС. Они проявляются сильной болью и выраженной функциональной недостаточностью суставов и бывают наиболее серьезной жалобой ребенка. При осмотре определяется выраженная локальная болезненность в области надколенника (на 10, 14 и 18 ч), бугристости большеберцовой кости; в месте прикрепления ахиллова сухожилия и подошвенного апоневроза к бугру пяточной кости; подошвенного апоневроза к основанию пятой метатарзальной кости; в области головок метатарзальных костей; больших трохантеров бедренных костей; верхнего переднего гребня подвздошной кости; лонного сочленения; седалищного бугра и редко в области верхних конечностей. Возможно развитие дактилита.
- Рекомендуется проведение осмотра мышечной системы всем пациентам с целью выявления характера ее поражения [1, 3, 4, 32]. (УДД 5, УУР C)
Комментарии: для ЮА характерны слабость мышц вокруг пораженных суставов, атрофия и укорочение мышц и сухожилий, что приводит к развитию сгибательных контрактур в суставах. Для РФ негативного полиартрита характерно развитие тотальной амиотрофии, особенно в случае дебюта заболевания в возрасте до 3-х лет. При ЮА также может развиться неспецифический миозит, который сопровождается мышечной слабостью, отеком мышц, болью, повышением концентрации ферментов мышечного распада в крови. При наличии активного артрита развивается атрофия мышц проксимальнее пораженного сустава.
При ЮАС может развиться миопатический синдром, который проявляется снижением мышечной силы, спонтанной болью в мышцах и при пальпации, слабостью.
- Рекомендуется перед назначением противоревматической терапии у всех пациентов исключить заболевания, которые могут протекать с похожей клинической симптоматикой с целью проведения дифференциальной диагностики [1, 3, 4, 37 - 41]. (УДД 4, УУР C)
Комментарии: заболевания, которые необходимо исключить в случае развития моноартрита: энтезит-ассоциированный артрит, псориатический артрит, септический артрит, онкологические заболевания, лейкоз, нейробластома, гемофилия, травма, семейная средиземноморская лихорадка другие периодические лихорадки; вилонодулярный синовит, саркоидоз. Заболевания, которые следует исключить при постановке диагноза олиго- и полиартрит, ЮАС: острая ревматическая лихорадка, реактивные артриты (после перенесенных инфекций); иерсиниоз, шигеллез, сальмонеллез, хламидиоз, токсоплазмоз, токсокароз), септический артрит, системная красная волчанка, смешанное заболевание соединительной ткани, системная склеродермия, ювенильный дерматополимиозит, геморрагический васкулит (болезнь Шенлейна-Геноха), хронический неспецифический язвенный колит, болезнь Крона, туберкулез, болезнь Лайма (системный клещевой боррелиоз), вирусные артриты (герпетическую, цитомегаловирусная инфекция, гепатит B и C), гипертрофическая остеоартропатия (синдром Мари-Бамбергера), гемофилия, лейкозы, неопластические процессы, нейробластома, саркома, остеоидная остеома, доброкачественные и злокачественные опухоли суставов и мягких тканей, гипотиреоз, аутовоспалительные синдромы.
2.3 Лабораторные диагностические исследования
- Рекомендуется общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови) всем пациентам с целью оценки активности заболевания и выявления патологических изменений [1, 3, 4, 42 - 45]. (УДД 5, УУР C)
Комментарии: при олигоартрите изменения показателей периферической крови, как правило, не выявляются, но может быть повышение СОЭ, уровень гемоглобина, число лейкоцитов и тромбоцитов - в пределах нормы; при полиартрите - нормальное или умеренно повышенное число лейкоцитов с нейтрофильным сдвигом влево, повышение СОЭ, редко гипохромная анемия, редко тромбоцитоз. Картина клинического анализа крови не является специфичной для ЮА, следовательно, дифференциально-диагностический поиск должен продолжаться. В первую очередь необходимо исключать гемобластозы, лимфопролиферативные и онкологические заболевания.
При ЮАС выявляется, как правило, нормальное или умеренно повышенное число лейкоцитов с нейтрофильным сдвигом влево, повышение СОЭ (до 100 мм/ч, иногда выше), редко гипохромная анемия, редко тромбоцитоз (> 500 * 109/л). Картина клинического анализа крови не является специфичной для ЮАС, следовательно, дифференциально-диагностический поиск должен продолжаться.
- Рекомендуется определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня протеина C в крови, определение активности протеина S в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение активности антитромбина III пациентам с признаками васкулита с целью оценки состояния системы гемостаза [3, 32, 46 - 55]. (УДД 5, УУР C)
Комментарии: для ЮА характерны изменения в системе гемостаза по типу гиперкоагуляции.
- Рекомендуется проведение тромбоэластографии пациентам с признаками васкулита с целью оценки выраженности нарушений в системе гемостаза [46, 47, 50, 51, 56 - 59]. (УДД 5, УУР C)
- Рекомендуется определение основных групп по системе AB0, подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy и определение антигена D системы Резус (резус-фактор) всем пациентам перед проведением инвазивных исследований (эзофагогастродуоденоскопия, колоноскопия с биопсией, получение цитологического препарата костного мозга путем пункции, цитологическое исследование отпечатков трепанобиоптата костного мозга, биопсия кости) с целью обеспечения возможности проведения гемотрансфузии при наличии показаний во время или после проведения исследования [1, 3, 60 - 63]. (УДД 5, УУР C)
Комментарии: определение группы крови выполняется каждому пациенту при наличии показаний для проведения инвазивного исследования.
- Рекомендуется исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтранспептидазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня холестерина, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови всем пациентам с целью выявления патологических изменений и исключения других ревматических и неревматических болезней [1, 3, 4, 32, 42, 44, 64 - 67]. (УДД 5, УУР C)
Комментарии: повышение уровня ферритина, триглицеридов, активности АЛТ, АСТ, ЛДГ, ГГТ, гипонатремия могут наблюдаться при вторичном гемофагоцитарном синдроме (ГФС), а также токсическом влиянии лекарственных препаратов, онкологическом заболевании, гемобластозе, лимфопролиферативном заболевании, другом ревматическом заболевании, сепсисе, что является основанием для продолжения проведения дифференциального диагноза.
- Рекомендуется исследование уровня C-реактивного белка в сыворотке крови всем пациентам с целью определения выраженности воспалительного процесса [1, 3, 4, 43, 44, 65, 68, 69]. (УДД 3, УУР C)
Комментарии: у большинства пациентов с олигоартикулярным ЮА уровень CРБ сыворотки крови соответствует референсным значениям, при полиартрите РФ+, РФ-, ЮАС, как правило, повышен.
- Рекомендуется определение содержания антител к антигенам ядра клетки и ДНК; определение содержания ревматоидного фактора (РФ) в крови, определение маркеров ANCA-ассоциированных васкулитов: PR3 (c-ANCA), МПО (p-ANCA), определение содержания антицентромерных антител в крови, определение содержания антител к РНК в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-CCP) в крови; определение содержания антинуклеарных антител к Sm-антигену в крови; определение содержания антител к РНК-полимеразе (Ro-антигену) и протеину, входящему в состав РНК (La-антигену) в крови, определение содержания антител к фосфолипидам в крови, определение содержания антител к кардиолипину в крови, определение содержания антител к бета-2-гликопротеину в крови, определение содержания антител к Scl-70 в крови, исследование уровня C3, C4 фракции комплемента всем пациентам с целью исключения других ревматических болезней, верификации диагноза и определения иммунологической активности ЮА [1, 3, 4, 65, 68, 70, 71]. (УДД 3, УУР C)
Комментарии: ревматоидный фактор значительно повышен при РФ+ полиартрите. Выявляется, как правило IgM РФ в высоком титре. Также может выявляться IgA РФ. Выявление только IgA РФ или в сочетании с IgM РФ ассоциируется с высокой активностью болезни, выраженной функциональной недостаточностью, сужением суставных щелей и формированием эрозий суставных поверхностей. Частота выявления АЦЦП составляет 57 - 90% у пациентов с РФ+ полиартритом и у 17% - с РФ-полиартритом. Как и у взрослых АЦЦП ассоциируются с DR4 антигеном и развитием эрозий. Антинуклеарный фактор (АНФ) выявляется у 50% пациентов с РФ-полиартритом, как правило, в низких титрах - 1:80 - 1:640. Наличие АНФ при РФ- полиартрите ассоциируется с ранним дебютом заболевания, чаще у девочек, развитием асимметричного артрита и высоким риском развития увеита. При РФ+ полиартрите АНФ выявляется у 80% пациентов. При олигоартрите АНФ выявляется у 65 - 85% пациентов, в основном у девочек с увеитом. Уровень комплемента нормальный или повышен.
При ЮАС РФ отрицательный. АНФ выявляется чаще, чем в общей популяции пациентов с ЮА.
Содержание антител к антигенам ядра клетки и ДНК; АНЦА, антицентромерных антител, антител к РНК; антинуклеарных антител к Sm-антигену, антител к Scl-70 не повышено.
- Рекомендуется исследование уровня иммуноглобулинов в крови всем пациентам с целью оценки состояния иммунного статуса и исключения первичного иммунодефицитного состояния [1, 3, 4, 44, 65, 66]. (УДД 5, УУР C)
Комментарии: уровень иммуноглобулинов крови сыворотки при ЮА может быть повышен при наличии высокого титра аутоантител.
- Рекомендуется определение антистрептолизина-O в сыворотке крови всем пациентам с целью выявления/исключения инфицированности  гемолитическим стрептококком группы A [1, 3, 4, 44, 65, 72, 73]. (УДД 3, УУР C)
гемолитическим стрептококком группы A [1, 3, 4, 44, 65, 72, 73]. (УДД 3, УУР C)
Комментарии: повышение уровня антистрептолизина-O в сыворотке крови свидетельствует об острой или хронической стрептококковой инфекции и никак не исключает наличие ЮА.
- Рекомендуется определение HLA-антигенов (антигена HLA-B27) всем пациентам с целью выявления/исключения заболеваний, ассоциированных с HLA-B27 [1, 3, 4, 65, 74 - 76]. (УДД 4, УУР C)
Комментарии: HLA-B27-антиген выявляется у 90% детей с ЮАС. Определение HLA-B27 служит не диагностическим тестом, а маркером риска.
- Рекомендуется проведение комплекса исследований для диагностики криопирин-ассоциированных синдромов и других аутовоспалительных синдромов пациентам с лихорадкой, сыпью, увеитом, а также детям с ранним началом и нетипичным течением болезни с целью исключения аутовоспалительных синдромов [1, 77 - 82]. (УДД 5, УУР C)
Комментарии: определяются мутации генов, отвечающих за развитие семейной средиземноморской лихорадки (FMF), периодического синдрома, ассоциированного с мутацией рецептора фактора некроза опухолей (TRAPS), мевалоновой ацидурии (MKD), семейной холодовой крапивницы (FCAS), синдрома Макла-Уэлса (MWS), младенческого мультисистемного воспалительного заболевания (CINCA).
- Рекомендуется исследование популяций лимфоцитов пациентам, часто болеющим вирусными, гнойными бактериальными инфекциями, в том числе оппортунистическими инфекциями, с целью исключения иммунодефицитных состояний [83 - 85]. (УДД 3, УУР B)
- Рекомендуется проведение очаговой пробы с туберкулином (реакция Манту, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**) и исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови всем пациентам с целью выявления/исключения инфицированности микобактериями туберкулез [3, 32, 86 - 94]. (УДД 4, УУР C)
- Рекомендуется определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci) в крови; определение антител к хламидии пневмонии (Chlamydophila pneumoniae) в крови; определение антител класса G (IgG) к хламидии трахоматис (Chlamydia trachomatis) в крови; определение антител классов M, G (IgM, IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови всем пациентам с целью исключения инфекционного процесса, который может протекать с клинической картиной, похожей на ЮА [1, 3, 32, 81, 95 - 99]. (УДД 5, УУР C)
- Рекомендуется определение к сальмонелле кишечной (Salmonella enterica) в крови, определение антител к сальмонелле тифи (Salmonella typhi) в крови, определение антител классов M, G (IgM, IgG) к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis) в крови, определение антител к сероварам иерсинии энтероколитика (Yersinia enterocolitica) в крови всем пациентам с целью исключения инфекционного процесса, который может протекать с клинической картиной похожей на ЮА [1, 3, 32, 95, 96, 100 - 108]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к шигелле Боуди (Shigella boydii) в крови, определение антител классов M, G (IgM, IgG) к шигелле дизентерии (Shigella dysenteriae) в крови, определение антител классов M, G (IgM, IgG) к шигелле Зонне (Shigella sonnei) в крови, определение антител классов M, G (IgM, IgG) к шигелле Флекснера (Shigella flexneri) всем пациентам с целью выявления/исключения инфекционного процесса, который может протекать с клинической картиной, похожей при ЮА [95, 96]. (УДД 5, УУР C)
- Рекомендуется, определение дезоксирибонуклеиновой кислоты (ДНК) возбудителей иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови методом ПЦР; определение антител класса M (IgM) к возбудителям иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови; определение антител класса G (IgG) к возбудителям иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови, определение суммарных антител к возбудителям иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови пациентам, у которых есть анамнестические данные о походе в лес, проживании в районах, эндемичных по распространению клеща, укусе клеща с целью исключения боррелиоза [3, 32, 109 - 111]. (УДД 5, УУР C)
- Рекомендуется определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче пациентам с лихорадкой с целью выявления/исключения заболеваний, активной Эпштейна-Барр вирусной инфекции [1, 3, 32, 81, 112 - 118].
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР качественное исследование пациентам с лихорадкой с целью выявления/исключения активной цитомегаловирусной инфекции [1, 3, 32, 115, 116, 119 - 122]. (УДД 4, УУР C)
- Рекомендуется определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче пациентам с клиническими признаками активной герпетической инфекции и/или лихорадкой с целью выявления/исключения активой герпеческой инфекции [1, 3, 32, 115, 116, 119, 123]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови пациентам с лихорадкой с целью выявления/исключения активной цитомегаловирусной инфекции [1, 112, 115, 119, 121, 122, 124, 125]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови пациентам с лихорадкой с целью выявления/исключения активнй Эпштейна-Барр вирусной инфекции [3, 32, 113, 115, 119, 126]. (УДД 4, УУР C)
- Рекомендуется определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с лихорадкой с целью выявления/исключения заболеваний, вызванных вирусом Эпштейна-Барр [3, 32, 113, 126]. (УДД 5, УУР C)
- Рекомендуется определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с лихорадкой с целью выявления/исключения заболеваний, активной Эпштейна-Барр вирусной инфекции [3, 32, 113, 126]. (УДД 5, УУР C)
- Рекомендуется определение антител к вирусу простого герпеса (Herpes simplex virus) в крови пациентам с клиническими признаками герпетической инфекции и/или лихорадкой с целью выявления/исключения активной герпетической инфекции [1, 3, 32, 81, 115, 119, 127 - 130]. (УДД 5, УУР C)
- Рекомендуется молекулярно-биологическое исследование крови на токсоплазмы (Toxoplasma gondii) пациентам, у которых есть данные о наличии контакта с животными с целью исключения токсоплазмоза [131 - 135]. (УДД 3, УУР B)
- Рекомендуется определение антител к лейшмании (Leischmania) в крови пациентам, у которых есть данные о пребывании в эндемичных районах с целью исключения лейшманиоза [136 - 140]. (УДД 3, УУР B)
- Рекомендуется молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus) и молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) пациентам с клиническими и лабораторными признаками гепатита с целью проведения дифференциальной диагностики [3, 32, 141 - 145]. (УДД 5, УУР C)
Комментарии: при ЮА может развиться аутоиммунный гепатит, гепатит на фоне бесконтрольного применения НПВП, а также гепатит может быть признаком вторичного гемофагоцитарного синдрома, сопровождающегося цитолизом.
- Рекомендуется определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) и определение антител к вирусу гепатита C (Hepatitis C virus) в крови пациентам с клиническими и лабораторными признаками гепатита с целью проведения дифференциальной диагностики [3, 32, 141 - 145]. (УДД 5, УУР C)
Комментарии: при ЮА может развиться аутоиммунный гепатит, ГФС, сопровождающиеся цитолизом.
- Рекомендуется определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови пациентам с клиническими и лабораторными признаками иммунодефицита с целью выявления/исключения инфицированности ВИЧ [32, 146 - 149]. (УДД 5 УУР C)
- Рекомендуется исследование уровня прокальцитонина в крови пациентам с лихорадкой с целью исключения сепсиса [3, 32, 150 - 153]. (УДД 3 УУР C)
Комментарии: при остром воспалительном ответе уровень прокальцитонина крови повышен. При ЮА без инфекционных осложнений - в пределах референсных значений
- Рекомендуется микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы пациентам с лихорадкой с целью исключения сепсиса и инфекции мочевыводящих путей [1, 3, 32, 81, 95, 150, 151, 154 - 156]. (УДД 4, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы всем пациентам с целью исключения контаминации носоглотки патогенной и условно-патогенной флорой [1, 3, 32, 81, 150, 151, 157, 158]. (УДД 5, УУР C)
- Рекомендуется общий (клинический) анализ мочи, исследование мочи методом Нечипоренко всем пациентам с целью исключения поражения почек [1, 3, 4, 65, 159]. (УДД 5, УУР C)
Комментарии: микро-макрогематурия может быть следствием токсического влияния НПВП и метотрексата** на почки; протеинурия может быть проявлением амилоидоза почек. Микро-, макрогематурия, протеинурия могут быть проявление острого пореждения почек при ГФС. При ЮА, как правило, изменений нет.
- Рекомендуется исследование уровня кальпротектина в кале всем пациентам с целью исключения ВЗК [3, 32, 160 - 162]. (УДД 4, УУР C)
2.4 Инструментальные диагностические исследования
- Рекомендуется проведение комплексного ультразвукового исследования (УЗИ) внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек) всем пациентам с целью выявления патологических изменений органов брюшной полости, почек, лимфаденопатии [1, 3, 32]. (УДД 5, УУР C)
Комментарии: может выявляться увеличение размеров и изменения паренхимы печени и селезенки, поджелудочной железе, холестаз, изменение паренхимы почек, обеднение кровотока при ОПП, увеличение мезентериальных лимфоузлов.
- Рекомендуется проведение эхокардиографии всем пациентам с целью оценки состояния сердца [1, 3, 32, 34]. (УДД 4, УУР C)
Комментарии: при ЮА без системных проявлений патология, как правило, не выявляется, при ЮАС в редких случаях могут быть выявлены типичные проявления аортальной недостаточности; нарушение систолической функции левого желудочка. При проведении трансэзофагеальной ЭхоКГ поражение аортального клапана выявляется у 82% взрослых больных АС. Также может выявляться узелковое уплотнение створок аортального клапана.
Проводится для дифференциальной диагностики с другими ревматическими болезнями. При миокардите выявляется дилатация левого желудочка, снижение фракции выброса левого желудочка, гипокинезия задней стенки левого желудочка и/или межжелудочковой перегородки, аортит, признаки относительной недостаточности митрального, аортального и/или трикуспидального клапанов, повышение давления в легочной артерии. При перикардите - сепарация листков перикарда, наличие свободной жидкости в полости перикарда. Эндокард и клапанный аппарат при ЮА, как правило, не поражаются. В случае наличия поражения эндокарда необходимо исключать острую ревматическую лихорадку, септический эндокардит.
- Рекомендуется регистрация электрокардиограммы всем пациентам с целью оценки состояния функции сердца [1, 3, 32, 34]. (УДД 5, УУР C)
Комментарии: при ЮА без системных проявлений, изменений, как правило, нет. Проводится для дифференциальной диагностики с другими ревматическими болезнями.
- Рекомендуется проведение ультразвукового исследования сустава всем пациентам с целью оценки наличия/выраженности выпота в полости сустава, состояния синовиальной оболочки, хряща [1, 3, 32, 42, 163 - 166]. (УДД 5, УУР C)
Комментарии: УЗИ позволяет проводить динамическое наблюдение и оценку степени поражения суставов. При УЗИ есть возможность оценить утолщение синовиальной оболочки, выпот в суставах, теносиновит, энтезит и эрозии костей. Поражение синовиальной оболочки проявляется наличием аномально гипоэхогенной ткани, связанной с линиями суставов или окружающими сухожилиями
- Рекомендуется проведение рентгенографии височно-нижнечелюстного сустава и/или рентгенографии межпозвоночных сочленений, и/или рентгенографии локтевого сустава, и/или рентгенографии лучезапястного сустава, и/или рентгенографии коленного сустава, и/или рентгенографии плечевого сустава, и/или рентгенографии тазобедренного сустава, и/или рентгенографии голеностопного сустава, и/или рентгенографии акромиально-ключичного сочленения, и/или рентгенографии грудинно-ключичного сочленения, и/или рентгенографии кисти и/или рентгенографии стопы в двух проекциях или компьютерной томографии сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с поражением суставов с целью выявления деструктивных изменений костной ткани суставов, типичных и нетипичных для ЮА [1, 3, 4, 32, 163, 167]. (УДД 5, УУР C)
Комментарии: при ЮА выявляются: остеопороз, деструктивные изменения костных структур, изменение суставной щели, целостность суставных поверхностей костей, составляющих сустав, наличие эрозий, узурации суставных поверхностей, кисты, очаги некроза костной ткани, подвывихи, переломы, остеофиты, кальцинаты и др. Необходимо одновременное исследование симметричных суставов. Изменения хрящевой и костной ткани выявляются у большинства пациентов. выявляет остеопороз, деструктивные изменения костных структур, изменение суставной щели, целостность суставных поверхностей костей, составляющих сустав, наличие эрозий, узурации суставных поверхностей, кисты, очаги некроза костной ткани, подвывихи, переломы, остеофиты, кальцинаты и др. Необходимо одновременное исследование симметричных суставов. Изменения хрящевой и костной ткани выявляются у большинства пациентов.
При РФ негативном полиартрите через 2 года после дебюта болезни у 30% пациентов обнаруживают сужение суставных щелей, у 35% - эрозии, у 10% - нарушение роста костей. Ранние рентгенологические изменения развиваются в лучезапястных, тазобедренных и плечевых суставах. Через 6,5 лет у 39% пациентов выявляется сужение суставных щелей, у 64% - эрозии, у 25% - нарушение роста костей. Также развивается переразгибание в атлантоаксиальном суставе.
При РФ позитивном полиартрите сужение суставных щелей и эрозии суставных поверхностей развиваются через 1 - 2 года после дебюта заболевания, наиболее часто - в лучезапястных суставах, мелких суставах кистей и в плечевых суставах. В запястьях потеря хряща развивается проксимальном запястном и интеркарпальных суставах, что приводит к развитию карпального анкилоза и укорочению кисти.
При олигоартрите сужение суставных щелей и эрозии суставных поверхностей на ранних стадиях болезни развивается у 5% и 10% пациентов, соответственно; у 15% и 25% - через 6 лет. У 20% больных наблюдается ускоренный рост кости, преимущественно коленного сустава, на ранних стадиях болезни.
При агрессивном течении ЮА развивается анкилоз в лучезапястных и апофизальных суставах шейного отдела позвоночника, а также асептический некроз тазобедренных суставов.
Ранние изменения в периферических суставах при артрите, ассоциированном с энтезитом, соответствуют таковым при других вариантах ЮИА. Рентгенологические признаки энтезита чаще выявляются в области бугра пяточной кости, реже - коленного сустава. Они характеризуются уменьшением четкости контура и эрозиями кости в месте прикрепления ахиллова сухожилия к бугру пяточной кости, формированием "шпор". Развивается анкилозирующий тарзит. При прогрессировании заболевания возможно значительное сужение суставных щелей и анкилозов в периферических суставах.
- Рекомендуется проведение компьютерной томографии сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с моно-олигоартритом, нетипичными для ЮА изменениями по данным МРТ с целью исключения туберкулеза костей, остеомиелита, доброкачественных и злокачественных опухолей, метастазов в кости [1, 3, 32, 88, 91, 92, 163, 167 - 169]. (УДД 5, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии суставов (один сустав) с контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с артритом с целью исключения травматического повреждения сухожильно-связочного аппарата, менисков, опухолей, выявления роста паннуса, патологических изменений синовиальной оболочки и хряща на ранних стадиях ЮА [1, 3, 32, 170]. (УДД 1, УУР A)
- Рекомендуется проведение магнитно-резонансной томографии позвоночника (один отдел), компьютерной томографии позвоночника (один отдел), компьютерная томография костей таза с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с жалобами на боли в спине, наличием энтезопатий (по данным физикального осмотра), пациентам с положительным HLA-B27, при подозрении на юношеский анкилозирующий спондилит с целью выявления/исключения поражения позвоночника, крестцово-подвздошных сочленений [1, 3, 24, 32, 45, 171 - 178]. (УДД 5, УУР C)
Комментарии: при ЮАС рентгенологические признаки сакроилеита появляются через несколько лет после дебюта периферического артрита и являются первыми признаками поражения позвоночника. Стадии сакроилеита представлены в таблице 1. Анатомические изменения в позвоночнике, как правило, появляются во взрослом возрасте, но при раннем дебюте заболевания и агрессивном течении поражение позвоночника может развиться и у детей.
Таблица 1. Рентгенологические стадии сакроилеита (J. Kallgren в модификации K. Dale, 1979).
|
Стадии
|
Признаки
|
|
0
|
Нормальная ширина суставных щелей и четкие суставные поверхности, возможен незначительный склероз по подвздошной стороне суставов
|
|
I
|
Изменения, позволяющие заподозрить сакроилеит: наличие субхондрального остеосклероза, некоторая неровность и нечеткость суставных поверхностей (возможно, вариант нормы)
|
|
II
|
Явные ранние изменения: псевдорасширение суставной щели и (или) ограниченные участки с эрозиями; остеосклероз обычно определяется на обеих сторонах суставной щели; часто имеется нечеткость суставных поверхностей
|
|
IIа
|
Односторонние изменения
|
|
IIб
|
Двусторонние изменения
|
|
III
|
Тяжелые деструктивные изменения: эрозии и псевдорасширение суставной щели по крайней мере в одном суставе; возможны маленькие костные мостики
|
|
IV
|
Двусторонние изменения суставов, аналогичные описанным при III стадии, но с дополнительными признаками сужения суставной щели, часто - с костными мостиками в одном или обоих крестцово-подвздошных сочленениях
|
|
V
|
Терминальные изменения: выраженные признаки костного анкилоза в обоих крестцово-подвздошных сочленениях
|
- Рекомендуется проведение ультразвукового исследования слюнных желез пациентам с положительным РФ и/или АЦЦП, пациентам с подозрением на развитие синдрома Шегрена с целью исключения/подтверждения их поражения [1, 179 - 182]. (УДД 5, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии мягких тканей головы с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с положительным РФ и/или АЦЦП, пациентам с подозрением на развитие синдрома Шегрена с целью выявления/исключения поражения слюнных желез при синдроме Шегрена [1, 179 - 182]. (УДД 5, УУР C)
Комментарии: синдром Шегрена чаще всего развивается у пациентов с ЮА серопозитивным по РФ.
- Рекомендуется проведение эзофагогастродуоденоскопии с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам для исключения воспалительных, а также эрозивно-язвенных процессов [3, 32, 160, 161, 183 - 185, 185 - 191]. (УДД 4, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений по данным эзофагогастродуоденоскопии с целью исключения патологии ЖКТ, связанной с Helicobacter pylori [3, 32, 160, 161, 184 - 188, 190 - 193]. (УДД 4, УУР C)
- Рекомендуется проведение биопсии пищевода с помощью эндоскопии, биопсии желудка с помощью эндоскопии, биопсии двенадцатиперстной кишки с помощью эндоскопии, биопсии тощей кишки с помощью эндоскопии с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения с патолого-анатомическим исследованием биопсийного (операционного) материала пищевода, патолого-анатомическим исследованием биопсийного (операционного) материала желудка, патолого-анатомическим исследованием биопсийного (операционного) материала двенадцатиперстной кишки, патолого-анатомическим исследованием материала тощей кишки пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений слизистой оболочки с целью исключения воспалительных заболеваний кишечника [3, 32, 160, 161, 186, 194 - 197]. (УДД 4, УУР C)
- Рекомендуется проведение колоноскопии с применением анестезиологического пособия (включая раннее послеоперационное ведение) всем пациентам с целью исключения воспалительных заболеваний кишечника [3, 32, 160, 161, 186, 194 - 197]. (УДД 4, УУР C)
- Рекомендуется проведение биопсии толстой кишки с помощью эндоскопии и патолого-анатомическим исследованием биопсийного (операционного) материала толстой кишки пациентам, у которых выявлены воспалительные и/или эрозивные и/или язвенные изменения в толстом кишечнике по данным колоноскопии с целью исключения воспалительных заболеваний кишечника [3, 32, 160, 161, 186, 194 - 197]. (УДД 4, УУР C)
- Рекомендуется проведение тонкокишечной эндоскопии видеокапсульной пациентам с клиническими признаками воспалительных заболеваний кишечника и/или повышением уровня кальпротектина в кале при отсутствии изменений по данным эзофагогастродуоденоскопии и колоноскопии с целью исключения болезни Крона с изолированным поражением тонкого кишечника [3, 32, 160, 161, 184 - 188, 198]. (УДД 4, УУР C)
- Рекомендуется проведение компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с целью исключения/выявления поражения легких, других ревматических болезней, онкологических/онко-гематологических/лимфопролиферативных заболеваний, туберкулеза [1, 3, 32, 41, 91, 92, 168, 199 - 201]. (УДД 4, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии головного мозга с контрастированием, магнитно-резонансной томографии органов брюшной полости с внутривенным контрастированием, магнитно-резонансной томографии забрюшинного пространства с внутривенным контрастированием, магнитно-резонансной томографии органов малого таза с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов с целью и выявления/исключения онкологических/онко-гематологических/лимфопролиферативных заболеваний, туберкулеза, абсцессов [3, 32, 41, 91, 168, 199, 202, 203]. (УДД 5, УУР C)
- Рекомендуется проведение компьютерной томографии органов брюшной полости с внутривенным болюсным контрастированием, компьютерной томографии забрюшинного пространства с внутривенным болюсным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам при наличии противопоказаний к проведению МРТ с целью исключения поражения внутренних органов при сЮА, выявления/исключения онкологических/онко-гематологических/лимфопролиферативных заболеваний, туберкулеза, абсцессов [1, 3, 32, 168, 204, 205]. (УДД 5, УУР C)
- Рекомендуется получение цитологического препарата костного мозга путем пункции и гистологического препарата костного мозга с применением анестезиологического пособия (включая раннее послеоперационное ведение) с цитологическим исследованием мазка костного мозга (миелограмма), патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов на этапе установления диагноза до назначения ГК и/или иммунодепрессанта, и/или ГИБП с целью выявления/исключения онкологических/онко-гематологических/лимфопролиферативных заболеваний/метастатического поражения костного мозга, ГФС [3, 32, 41, 81, 155, 168, 169, 204 - 208]. (УДД 5, УУР C)
Комментарии: в случае применения ГК или иммунодепрессантов исследование проводится не ранее, чем через 2 недели после их отмены.
- Рекомендуется проведение биопсии лимфатического узла (периферического, по показаниям - внутрибрюшного, внутригрудного) с применением анестезиологического пособия (включая раннее послеоперационное ведение) с цитологическим исследованием препарата тканей лимфоузла и патолого-анатомическим исследованием биопсийного (операционного) материала лимфоузла пациентам с выраженным увеличением размеров периферических и/или внутригрудных, и/или внутрибрюшных лимфатических узлов с целью выявления/исключения гемобластозов, лимфопролиферативных заболеваний, метастатического поражения лимфатического узла [1, 3, 32, 168, 204 - 206]. (УДД 5, УУР C)
Комментарии: исследование проводится на этапе установления диагноза до назначения ГК и/или иммунодепрессанта, и/или ГИБП. В случае применения ГК или иммунодепрессантов исследование проводится не ранее, чем через 2 недели после их отмены.
- Рекомендуется проведение позитронной эмиссионной томографии, совмещенной с компьютерной томографией с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)) с контрастированием, при необходимости, позитронной эмиссионной томографии всего тела с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с выраженной артралгией, миалгией, оссалгией, деструктивными изменениями в костях, инфильтратами в подкожно-жировой клетчатке, очагами в паренхиматозных органах, головном мозге, спинном мозге с целью выявления/исключения онкологических/онко-гематологических лимфопролиферативных заболеваний [3, 32, 41, 168, 204 - 206, 209, 210]. (УДД 5, УУР C)
- Рекомендуется, проведение сцинтиграфии полипозиционной костей с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с очагами деструкции в костях, не типичными для ЮА с целью выявления/исключения злокачественных и доброкачественных опухолей костей и метастатического поражения костей [168, 169]. (УДД 5, УУР C)
- Рекомендуется проведение трепанобиопсии костей таза под контролем компьютерной томографии с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов; цитологическим исследованием отпечатков трепанобиоптата костного мозга; иммуноцитохимическим исследованием отпечатков трепанобиоптата костного мозга; иммунофенотипированием гемопоэтических клеток-предшественниц в костном мозге пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов для дифференциальной диагностики на этапе обследования до назначения ГК, и/или иммунодепрессанта, и/или ГИБП с целью исключения онкологических/онко-гематологических/лимфопролиферативных заболеваний/метастатического поражения костного мозга [3, 32, 169, 204 - 207, 210, 211]. (УДД 5, УУР C)
Комментарии: в случае применения ГК или иммунодепрессанта исследование проводится не ранее, чем через 2 недели после их отмены.
- Рекомендуется проведение биопсии кости с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костной ткани пациентам с очагами деструкции в костях, не типичными для ювенильного артрита, с целью выявления/исключения злокачественных, доброкачественных опухолей и метастатического поражения костей [3, 32, 168, 169, 204 - 208]. (УДД 5, УУР C)
Комментарии: очаги деструкции характерны для мультифокального остемиелита, злокачественных новообразований, гемобластозов, при которых могут развиваться эпизоды фебрильной лихорадки с болевым синдромом в области живота, грудной клетки, в суставах и костях. Для проведения дифференциального диагноза необходимо проведение биопсии кости [169].
2.5 Иные диагностические исследования
2.1.5 Иные диагностические исследования
- Рекомендуется прием (осмотр, консультация) врача-детского онколога первичный пациентам, у которых по результатам обследований заподозрено онкологическое или онко-гематологическое заболевание с целью их исключения [3, 32, 41, 169, 199, 204 - 207]. (УДД 4, УУР C)
Комментарии: проводится по результатам обследования (компьютерная томография органов грудной полости; магнитно-резонансная томография головного мозга, магнитно-резонансная томография органов брюшной полости, магнитно-резонансная томография забрюшинного пространства и малого таза с внутривенным контрастированием; цитологического исследования мазка костного мозга (миелограмма), патолого-анатомического исследования биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов; цитологического и иммуноцитохимического исследования отпечатков трепанобиоптата костного мозга; иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге; цитологического исследования препарата тканей лимфоузла и патолого-анатомического исследования биопсийного (операционного) материала лимфоузла; позитронной эмиссионной томографии, совмещенной с компьютерной томографией с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)) с контрастированием, позитронной эмиссионной томографии всего тела с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)); сцинтиграфии костей; патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга (трепанобиоптат) с применением иммуногистохимических методов, биопсии кости патолого-анатомическим исследованием биопсийного (операционного) материала).
- Рекомендуется прием (осмотр, консультация) врача-фтизиатра первичный пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или инфильтративными очагами в легких с целью исключения туберкулеза [3, 32, 88, 90 - 92, 212, 213]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-травматолога-ортопеда первичный пациентам с объемными и деструктивными изменениями, а также с деформациями в костях, не типичными для ЮА с целью исключения гнойного артрита, остеомиелита и другой хирургической патологии [1, 3, 32, 214]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-оториноларинголога первичный всем пациентам с целью выявления очагов хронической инфекции ЛОР органов [1, 3, 32, 95]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога первичный с обязательной биомикроскопией глаза всем пациентам с целью выявления поражения органа зрения [1, 3, 15, 32]. (УДД 5, УУР C)
Комментарии: в обязательном порядке необходимо проведение биомикроскопии глаза.
- Рекомендуется прием (осмотр, консультация) врача-стоматолога детского первичный всем пациентам с целью определения состояния ротовой полости [1, 3, 4, 32, 215]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-невролога первичный пациентам с неврологической симптоматикой, выраженным болевым синдромом, отставанием в психомоторном развитии, психотическими реакциями с целью исключения патологии центральной и периферической нервной системы, в том числе при злокачественных и доброкачественных новообразованиях [1, 3, 4, 32, 216, 217]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-сурдолога оториноларинголога первичный и проведение аудиограммы пациентам с подозрением на аутовоспалительные синдромы с целью исключения/подтверждения наличия тугоухости [1, 3, 32, 77, 82]. (УДД 5, УУР C)
- Рекомендуется проведение осмотра (консультации) врачом-анестезиологом-реаниматологом первичного пациентам, которым планируются поднаркозные исследования с целью оценки состояния [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется проведение осмотра (консультации) врачом-анестезиологом-реаниматологом первичного пациентам, находящимся в тяжелом состоянии, с целью решения вопроса о переводе в отделение реанимации и интенсивной терапии [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется проведение суточного наблюдения врачом-анестезиологом-реаниматологом всех пациентов, находящихся в критическом состоянии (полиорганная недостаточность, ГФС) с целью оказания помощи в условиях отделения реанимации и интенсивной терапии [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется прием (тестирование, консультация) медицинского психолога первичный всем пациентам с возраста 1 года и их родителям (вне зависимости от возраста ребенка) с целью гармонизации процесса формирования детской личности в условиях тяжелого хронического заболевания и оптимизации детско-родительских отношений; повышения приверженности лечению, сотрудничеству с врачом и медицинским персоналом для достижения ремиссии заболевания; для достижения психологической адаптации в социуме; для разработки индивидуальной программы психологической реабилитации для пациента и его родителей [32, 221 - 227]. (УДД 1, УУР A)
2.1.6 Критерии установления диагноза "Юношеский артрит"
Диагноз "юношеский артрит" устанавливается при наличии артрита одного и более суставов, продолжающийся более 6 недель [1].
В зависимости о количества пораженных суставов, наличия или отсутствия РФ выделяют следующие формы заболевания:
Олигоартикулярный вариант (олигоартрит) - артрит с поражением 1 - 4 суставов в течение первых 6 месяцев болезни.
Полиартикулярный РФ негативный вариант (полиартикулярный РФ-) - артрит с поражением 5 или более суставов в течение первых 6 месяцев болезни, тест на РФ отрицательный.
Полиартикулярный РФ позитивный вариант (полиартикулярный РФ+) - артрит с поражением 5 или более суставов в течение первых 6 месяцев болезни, ассоциированный с положительным РФ в двух тестах в течение 3 месяцев или при положительном тесте на антитела к циклическому цитруллиновому пептиду (cyclic citrullinated peptide [CCP]).
Юношеский анкилозирующий спондилит (син.: артрит, ассоциированный с энтезитом) - артрит и энтезит, или артрит или энтезит в сочетании по меньшей мере с 2 из следующих признаков:
- наличие болезненности илеосакральных сочленений и/или воспалительной боли в спине;
- наличие HLA-B27;
- начало артрита у мальчика в возрасте старше 6 лет;
- наличие анкилозирующего спондилита, артрита, ассоциированного с энтезитом, сакроилеита в сочетании с воспалительными заболеваниями кишечника, реактивного артрита или острого переднего увеита у родственников первой линии родства (родители, сибсы)
- острый передний увеит.
Диагноз олиго- или полиартикулярного юношеского артрита не может быть установлен при наличии [18]:
- псориаза (в том числе в анамнезе) у пациента или у его родственников первой линии родства (родители, сибсы);
- артрита, ассоциированного с B27 антигеном (HLA-B27) главного комплекса гистосовместимости 1 класса, у мальчиков в возрасте старше 6 лет;
- анкилозирующего спондилита;
- артрита, ассоциированного с энтезитом,
- сакроилеита в сочетании с воспалительными заболеваниями кишечника,
- синдрома Рейтера;
- острого переднего увеита;
- одного из этих заболеваний у родственников первой линии родства;
- наличии системного артрита.
Диагноз артрит, ассоциированный с энтезитом, не может быть установлен при наличии [18]:
- псориаза (в том числе в анамнезе) у пациента или у его родственников первой линии родства;
- положительного РФ класса IgM минимум в 2-х пробах, взятых с интервалом не
- менее 3 мес;
- системного ЮИА у пациента
Дополнительные сведения для диагностики юношеского анкилозирующего спондилита, артрита, ассоциированного с энтезитом:
Таблица 2. Римские критерии диагностики АС [228].
|
Клинические критерии
|
|
1. Боль в крестце > 3 мес не проходящая в покое
2. Боль и скованность в грудной клетке
3. Ограничение подвижности поясничного отдела позвоночника
4. Ограничение экскурсии грудной клетки
5. Ирит острый или в анамнезе
|
|
Диагноз устанавливают при наличии двустороннего сакроилеита в сочетании с одним из клинических критериев или при наличии 4 из 5 критериев.
|
Таблица 3. Нью-Йоркские критерии диагностики АС [229].
|
Клинические критерии
|
|
1. Ограничение движений в поясничном отделе позвоночника во всех 3-х проекциях
2. Наличие в настоящем или в анамнезе боли в области поясничного или пояснично-крестцового отдела позвоночника
3. Ограничение экскурсии грудной клетки <= 2,5 см на уровне IV межреберья
|
|
Достоверный АС: двустронний сакроилеит III - IV стадии по данным рентгенографии в сочетании по меньшей мере с одним клиническим критерием или односторонний сакроилеит III - IV стадии или двусторонний сакроилеит II стадии по данным рентгенографии в сочетании с клиническим критерием 1 или клиническими критериями 2 и 3
|
|
Вероятный АС: двусторонний сакроилеит III - IV стадии по данным рентгенографии без клинических критериев
|
Таблица 4. Критерии АС Европейской группы по изучению спондилоартропатий [230].
|
Боль в позвоночнике воспалительного характера или
Синовит (асимметричный или преимущественно нижних конечностей)
|
Плюс один из перечисленных признаков:
- наличие в семейном анамнезе анкилозирующего спондилоартрита, псориаза, острого переднего увеита, воспалительных заболеваний кишечника
- псориаз
- воспалительное заболевание кишечника
- уретрит, цервицит или острая диарея за 1 мес до развития артрита
- перемежающаяся боль в ягодицах
- энтезопатии
- двусторонний сакроилеит II - IV стадии
|
Таблица 5. Критерии АС Amor [231].
|
Признаки
|
Балл
|
|
Клинические или анамнестические
|
|
|
1. Ночные боли в поясничной области или спине и (или) утренняя скованность в пояснице
|
1
|
|
2. Олигоартрит асимметричный
|
2
|
|
3. Боль в ягодицах, нечетко определяемая,
|
1
|
|
или периодические боли в ягодицах
|
2
|
|
4. "Сосискообразные" пальцы на кистях и стопах 2
|
2
|
|
5. Талалгии или другие энтезопатии
|
2
|
|
6. Ирит
|
2
|
|
7. Эпизод негонококкового уретрита или цервицита менее чем за 1 мес до дебюта артрита
|
1
|
|
8. Эпизод диареи менее чем за 1 мес до дебюта артрита
|
1
|
|
9. Наличие или анамнестические данные по псориазу, и (или) баланиту, и (или) хроническому энтероколиту
|
2
|
|
Рентгенологические
|
|
|
10. Сакроилеит (двусторонний: >= II стадии, односторонний: >= III стадии)
|
3
|
|
Генетические
|
|
|
11. Наличие HLA-B27 и (или) семейный анамнез по анкилозирующему спондилиту и (или) синдрому Рейтера и (или) псориазу, и (или) увеиту, и (или) хроническому энтероколиту
|
2
|
|
Ответ на лечение
|
|
|
12. Уменьшение болей в течение 48 ч от начала приема НПВП и (или) обострение в течение 48 ч после отмены НПВП
|
2
|
|
Диагноз достоверен при сумме баллов по 12 критериям >= 6.
|
|
Таблица 6. Критерии ЮАС Garmisch-Partenkirchen.
|
Основные
|
|
1. Асимметричный пауциартрит (<= 5 суставов) преимущественно нижних конечностей в дебюте заболевания (первые 3 мес)
2. Энтезопатии
3. Боль в пояснично-крестцовой области
4. Острый иридоциклит
|
|
Дополнительные
|
|
Полиартрит (> 5 суставов) в дебюте заболевания
Мужской пол
Начало заболевания в возрасте >= 6 лет
Наличие HLA-B27
Семейная агрегация по заболеваниям из группы серонегативных спондилоартропатий
|
|
Диагноз вероятного ЮАС устанавливают при наличии 2-х основных критериев или 1-го или 2-х основных критериев в сочетании с двумя дополнительными.
Определенному ЮАС соответствует тот же набор признаков в сочетании с рентгенологическим подтверждением сакроилеита (т.е. двусторонний сакроилеит II или как минимум односторонний сакроилеит III стадии)
|
Таблица 7. Критерии АС у детей [232, 233].
|
Основные
|
|
1. Наличие спондилоартропатий или олигоартрита в семейном анамнезе
2. Энтезопатия
3. Артрит межфаланговых суставов
4. Сакроилеит
5. Наличие HLA-B27
6. Рецидивирующий артрит или артралгии
|
|
Дополнительные
|
|
Начало заболевания в возрасте > 10 лет
Мужской пол
Поражение только нижних конечностей
Острый иридоциклит или конъюнктивит
Артрит тазобедренных суставов
Начало после неподтвержденного энтерита
|
|
Диагноз вероятного атипичного спондилоартрита может быть установлен при наличии 3-х основных и 2-х дополнительных критериев.
|
В 2019 г. Организацией по проведению международных исследований в области педиатрической ревматологии (PRINTO) предложен новый "предварительный" вариант классификации ювенильного идиопатического артрита, в рамках которой выделены новые критерии диагностики энтезит/спондилит-ассоциированного артрита (таблица 8).
Таблица 8. Критерии энтезит/спондилит-ассоциированного артрита по классификации PRINTO [234].
|
Периферический артрит и энтезит, или
Артрит или энтезит плюс воспалительная боль в спине >= 3 мес и сакроилеит по данным визуализации, или
Артрит или энтезит плюс 2 из следующих критериев:
- Болезненность илеосакральных сочленений;
- Воспалительная боль в спине;
- Наличие HLA-B27;
- Острый передний увеит
- Наличие анкилозирующего спондилита у родственников первой линии родства (родители, сибсы)
|
2.2. Обследование пациентов с юношеским артритом с подозрением на гемофагоцитарный синдром
Вторичный гемофагоцитарный синдром (вГФС) - осложнение ЮА, опасный гипервоспалительный синдром, завершение тяжелой неконтролируемой реакции, при которой возникает гиперцитокинемия со значительным, но неэффективным иммунным ответом. Это последствие врожденной или приобретенной неспособности иммунной системы справиться с пусковым механизмом - чаще инфекционным агентом [235, 236].
Вторичный ГФС провоцируется вирусами (цитомегаловирусом, Эпштейна-Барр, герпес-вирусом и др.), лекарственными препаратами (НПВП, препаратами золота, сульфасалазином** и др.). Вторичный ГФС - следствие избыточной активации и экспансии клеток системы фагоцитирующих мононуклеаров (СФМ) и Т-лимфоцитов, что проявляется цитопенией, системной воспалительной реакцией, повреждением печени, селезенки. Клетки, входящие в СФМ, образуют единую линию дифференцировки, включающую клетки-предшественницы костного мозга, а также пул моноцитов и макрофагов. СФМ в целом представляет собой своеобразный биологический фильтр крови и лимфы, удаляющий опухолевые и инфицированные вирусами клетки, микроорганизмы, токсины, различные метаболиты и циркулирующие иммунные комплексы. Гистиоциты (син.: макрофаги) выполняют и антигенпрезентирующие функции. [235, 236].
При ЮА без системных проявлений вГФС развивается значительно реже, чем при системном ЮА, но может быть спровоцирован вирусной или бактериальной инфекцией.
вГФС - следствие избыточной активации и экспансии клеток системы фагоцитирующих мононуклеаров (СФМ) и Т-лимфоцитов, что проявляется цитопенией, системной воспалительной реакцией, повреждением печени, селезенки. Клетки, входящие в СФМ, образуют единую линию дифференцировки, включающую клетки-предшественницы костного мозга, а также пул моноцитов и макрофагов. СФМ в целом представляет собой своеобразный биологический фильтр крови и лимфы, удаляющий опухолевые и инфицированные вирусами клетки, микроорганизмы, токсины, различные метаболиты и циркулирующие иммунные комплексы. Гистиоциты (син.: макрофаги) выполняют и антигенпрезентирующие функции.
Не всегда представляется возможным установить диагноз вГФС, т.к. его клинические и лабораторные проявления могут быть похожи на инфекционный процесс [235, 236].
2.2.1 Физикальное обследование
- Рекомендуется проведение диагностики, в том числе дифференциальной диагностики, в условиях ревматологического стационара при подозрении на вторичный гемофагоцитарный синдром всем пациентам с целью его подтверждения/исключения [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется проведение оценки выраженности и характера лихорадки всем пациентам с целью выявления ее особенностей, характерных для ГФС [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: лихорадка (постоянная или неремиттирующая) представляет собой один из главных клинических симптомов ГФС. Она всегда устойчива к противоинфекционному лечению. В то же время одним из признаков, свидетельствующих в пользу ГФС, служит нормализация температуры тела в результате иммуносупрессивной терапии.
- Рекомендуется проведение оценки общего состояния всем пациентам с целью разработка тактики диагностики и лечения [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: течение вГФС варьирует от легкого, с минимальной выраженностью симптомов, до тяжелого. При тяжелом неконтролируемом течении ГФС может развиться нарушение сознания, кома, возможен летальный исход.
- Рекомендуется проведение осмотра кожных покровов всем пациентам с целью выявления патологических изменений [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: бледность и желтушность кожных покровов свидетельствуют о развитии анемии, прогрессировании гепатита и коагулопатии; отечный синдром - о развитии синдрома капиллярной утечки, почечной недостаточности.
Частота кожных проявлений при вГФС варьирует от 6 до 65%. Поражение кожи может протекать в форме генерализованной макулопапулезной сыпи, эритродермии, отека, панникулита, кореподобной сыпи и пурпуры. Некоторые проявления аналогичны таковым при болезни Кавасаки.
При патолого-анатомическом исследовании биопсийного (операционного) материала кожи обнаруживается лимфогистиоцитарная инфильтрация дермы с явлениями гемофагоцитоза.
- Рекомендуется проведение осмотра лимфатических узлов всем пациентам с целью выявления патологических изменений [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: при развитии вГФС значительно увеличивается размер лимфатических узлов и развивается генерализованная лимфаденопатия.
- Рекомендуется проведение анализа жалоб, анамнеза, осмотра, перкуссии, аускультации органов сердечно-сосудистой системы всем пациентам с целью выявления патологических изменений сердца и сосудов [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: при прогрессирующем вГФС развивается микроангиопатия с тромбозом, которая может сопровождаться аритмиями, а в ряде случаев инфарктом миокарда. Одним из следствий тромбоза мелких сосудов, микровазальной дисфункции или стресс-индуцированной кардиомиопатии является острая сердечная недостаточность.
Признаками развития кардиоваскулярных осложнений вГФС являются боли в области сердца, за грудиной, в грудной клетке, в эпигастрии, иррадиирущей в спину, левое плечо, шею, кашель, одышка, усиливающиеся в горизонтальном положении, нарастающий цианоз.
При физикальном обследовании могут выявляться усиленная пульсация области сердца, расширение границ относительной сердечной тупости, аритмии, патологические шумы над областью проекции клапанов сердца.
При прогрессировании вГФС, как правило, развивается сердечная недостаточность.
- Рекомендуется проведение анализа жалоб, анамнеза, осмотра, перкуссии, аускультации легких всем пациентам с целью выявления патологических изменений дыхательной системы [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: при вГФС может развиваться респираторный дистресс синдром вследствие микроангиопатии с тромбозом сосудов легких. Поражение легких может иметь различную степень выраженности, вплоть до развития тяжелой дыхательной недостаточности, требующей проведения искусственной вентиляции легких.
Смертность пациентов при поражении легких составляет до 88%.
Нарастание дыхательной недостаточности - тревожный признак, свидетельствующий о неадекватном контроле над вГФС или присоединении суперинфекции.
При осмотре могут выявляться одышка, цианоз, мозаичность перкуторного звука, ослабление дыхания, крепитирующие хрипы, разнокалиберные влажные хрипы, преимущественно мелкопузырчатые.
- Рекомендуется проведение анализа жалоб, осмотра, перкуссии и пальпации органов пищеварительной системы всем пациентам с целью выявления патологических изменений [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: при осмотре может определяться увеличение размеров живота за счет увеличения размеров печени и/или селезенки, и/или наличия жидкости в брюшной полости. Перкуторно и пальпаторно - увеличение размеров печени и/или селезенки, болезненность при пальпации по всей поверхности живота.
Поражение печени встречается у подавляющего большинства пациентов с вГФС, варьируя от бессимптомного течения с изменениями в крови до развития печеночной энцефалопатии, тяжелой гипокоагуляции, отечно-асцитического синдрома. Описано спонтанное возникновение веноокклюзионной болезни.
Степень увеличения селезенки варьирует от выраженной до умеренной, когда спленомегалия выявляется лишь при инструментальных исследованиях.
2.2.2 Лабораторные диагностические исследования
- Рекомендуется общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови) всем пациентам с целью оценки активности заболевания и выявления патологических изменений, характерных для вГФС [3, 32, 236 - 240]. (УДД 4, УУР C)
Комментарии: при вГФС развиваются тромбоцитопения, лейкопения, эритропения, снижается показатель СОЭ.
- Рекомендуется определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня протеина C в крови, определение активности протеина S в крови, исследование уровня плазминогена в крови, исследование активности и свойств фактора Виллебранда в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, определение активности антитромбина III в крови всем пациентам с целью оценки состояния системы гемостаза [46, 47, 53 - 55, 156, 235 - 238, 241 - 243]. (УДД 5, УУР C)
Комментарии: при вГФС повышается уровень Д-димера, продуктов деградации фибрина (ранний доклинический признак), снижается уровень фибриногена.
- Рекомендуется исследование уровня гепарина в крови всем пациентам с целью оценки выраженности нарушений в системе гемостаза, степени риска развития тромбоза/кровотечения [1, 3, 32, 46, 50, 56, 56, 244, 245]. (УДД 5, УУР C)
- Рекомендуется проведение тромбоэластографии всем пациентам с целью оценки выраженности нарушений в системе гемостаза, степени риска развития тромбоза/кровотечения/внутрисосудистого диссеминированного свертывания [50, 56 - 59, 246 - 248]. (УДД 4, УУР C)
- Рекомендуется исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтранспептидазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови всем пациентам с целью выявления патологических изменений, характерных для вГФС [3, 32, 235 - 238, 240, 249 - 251]. (УДД 4, УУР C)
Комментарии: для вГФС характерно повышение уровня ферритина, триглицеридов, АЛТ, АСТ ЛДГ в сыворотке крови, гипонатриемия, гипохлоремия, гипоальбуминемия.
При прогрессировании полиорганной недостаточности может наблюдаться гипербилирубинемия, повышение уровня креатинина, мочевой кислоты, мочевины. Повышение уровня креатинина, мочевой кислоты, мочевины свидетельствует о развитии острой почечного повреждения, ассоциированного с вторичным гемофагоцитарным синдромом (вГФС-ОПП)
- Рекомендуется исследование уровня C-реактивного белка в сыворотке крови всем пациентам с целью оценки активности вГФС [3, 32, 235 - 238, 240, 249 - 251]. (УДД 4, УУР C)
Комментарии: уровень CРБ сыворотки при вГФС значительно повышается.
- Рекомендуется микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы, микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам всем пациентам с целью выявления активной бактериальной и/или грибковой инфекции, как триггерного фактора вГФС [1, 237, 238, 249, 252 - 255]. (УДД 5, УУР C)
- Рекомендуется определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci); определение антител к хламидии трахоматис (Chlamydia trachomatis); определение антител к хламидии пневмонии (Chlamydophila pheumoniae) в крови; определение антител классов M, G (IgM, IgG) в крови к микоплазме пневмонии (Mycoplasma pneumoniae) в крови всем пациентам с целью выявления/исключения активной микоплазменной и/или хламидийной инфекции как триггерного фактора вГФС [1, 3, 32, 81, 237, 238, 253, 253 - 255]. (УДД 5, УУР C)
- Рекомендуется определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения активной микоплазменной инфекции, как триггерного фактора вГФС [1, 124, 249, 252, 253, 256 - 259]. (УДД 4, УУР C)
- Рекомендуется определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче всем пациентам с целью выявления/исключения активной герпетической инфекции, как триггерного фактора вГФС [1, 113 - 118, 124, 249, 252, 253, 260, 261]. (УДД 4, УУР C)
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР, качественное исследование всем пациентам с целью выявления/исключения активной герпетической инфекции, как триггерного фактора вГФС [1, 115, 116, 119, 121, 122, 124, 125, 237, 238, 249, 252, 253]. (УДД 5, УУР C)
- Рекомендуется определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче всем пациентам с целью выявления/исключения активной герпетической инфекции, как триггерного фактора вГФС [1, 3, 32, 115 - 117, 123, 124, 249, 252, 253, 262, 263]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови всем пациентам с целью выявления/исключения активной цитомегаловирусной вирусной инфекции, как триггерного фактора вГФС [1, 32, 124, 125, 237, 238]. (УДД 5, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови всем пациентам с целью выявления/исключения активной Эпштейна-Барр вирусной инфекции, как триггерного фактора вГФС [112, 113, 121, 237, 238, 252, 253, 264]. (УДД 4, УУР C)
- Рекомендуется определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови всем пациентам с целью выявления/исключения активной Эпштейна-Барр вирусной инфекции, как триггерного фактора вГФС [112, 113, 121, 237, 238, 252, 253, 264]. (УДД 4, УУР C)
- Рекомендуется определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови всем пациентам с целью выявления/исключения активной Эпштейна-Барр вирусной инфекции, как триггерного фактора вГФС [112, 113, 121, 237, 238, 252, 253, 264]. (УДД 4, УУР C)
- Рекомендуется определение антител к вирусу простого герпеса (Herpes simplex virus) в крови всем пациентам с целью выявления/исключения активной герпетической инфекции, как триггерного фактора вГФС [32, 123, 130, 237, 238, 251, 252, 265]. (УДД 4, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы, с применением автоматизированного посева с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологического фактора поражения легких [237, 238, 266, 267]. (УДД 4, УУР C)
- Рекомендуется определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью с целью выявления/исключения активной Эпштейна-Барр вирусной инфекции как триггерного фактора вГФС [237, 238, 266 - 269]. (УДД 4, УУР C)
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения активной активной цитомегаловирусной инфекции как триггерного фактора вГФС [237, 238, 266 - 269]. (УДД 4, УУР C)
- Рекомендуется определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения активной пневмоцистной инфекции как триггерного фактора вГФС [119, 238, 252, 270 - 276]. (УДД 4, УУР C)
- Рекомендуется определение антител класса M, G к Pneumocystis jirovecii в крови при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения активной пневмоцистной инфекции как триггерного фактора вГФС [238, 249, 252, 272, 277, 278]. (УДД 5, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii) при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения активной пневмоцистной инфекции как триггерного фактора вГФС [112, 237, 238, 252, 270 - 273, 275, 276, 279, 280]. (УДД 4, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные) при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения микоза как триггерного фактора вГФС [237, 252, 266, 267, 270, 281, 282]. (УДД 4, УУР C)
- Рекомендуется определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в сыворотке крови методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения аспергиллеза как триггерного фактора вГФС [252, 266, 267, 270, 281, 282]. (УДД 4, УУР C)
- Рекомендуется определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в бронхоальвеолярном лаваже методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления/исключения аспергиллеза как триггерного фактора вГФС [252, 266, 267, 270, 281, 282]. (УДД 4, УУР C)
- Рекомендуется исследование уровня прокальцитонина в крови всем пациентам с целью исключения сепсиса [150, 150, 153, 156, 237, 238]. (УДД 3, УУР C)
Комментарии: при повышении уровня прокальцитонина следует заподозрить присоединение инфекции и развитие сепсиса.
- Рекомендуется проведение общего (клинического) анализа мочи, определение альбумина в моче, определение количества белка в суточной моче всем пациентам, с целью выявления/исключения поражения почек [3, 32, 236 - 240, 283]. (УДД 5, УУР C)
Комментарии: канальцевый некроз - преобладающая форма поражения почек при остром повреждении почек, связанном с вГФС (вГФС-ОПП). Однако гистопатологические изменения могут также включать интерстициальное воспаление, аномалии клубочков, микроскопические поражения и тромботическую микроангиопатию. У пациентов с вГФС-ОПП обычно наблюдается олигурия, азотемия и нефротический синдром. В анализе моче выявляется протеинурия разной степени выраженности, макро-, микрогематурия, цилиндурия.
2.2.3 Инструментальные диагностические исследования
- Рекомендуется проведение комплексного ультразвукового исследование (УЗИ) внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек) всем пациентам с целью выявления поражения почек, нарастания размеров печени и селезенки, внутрибрюшных лимфатических узлов [1, 3, 32, 237, 238, 284, 285]. (УДД 4, УУР C)
- Рекомендуется проведение эхокардиографии всем пациентам с целью оценки состояния сердца [1, 3, 32, 235 - 238, 240]. (УДД 4, УУР C)
- Рекомендуется проведение регистрации электрокардиограммы всем пациентам с целью оценки состояния функции сердца [1, 3, 32, 235 - 238, 286]. (УДД 5, УУР C)
- Рекомендуется проведение компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с целью выявления/исключения поражения легких [1, 3, 32, 235 - 238, 284]. (УДД 4, УУР C)
Комментарии: при вГФС может развиваться геморрагический альвеолит, альвеолярный и интерстициальный отек легких по типу респираторного дистресс-синдрома (РДС); возможно выявление пневмонии (очаговой, долевой, интерстициальной, полисегментарной).
- Рекомендуется проведение магнитно-резонансной томографии головного мозга с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с неврологической симптоматикой с целью выявления поражения головного мозга [1, 3, 32, 235 - 238, 284, 287]. (УДД 4, УУР C)
Комментарии: при вГФС могут выявляться ишемические/геморрагические инсульты, очерченные очаги демиелинизации, а также задняя обратимая энцефалопатия (PRES).
- Рекомендуется проведение магнитно-резонансной томографии органов брюшной полости, магнитно-резонансной томографии забрюшинного пространства и магнитно-резонансной томографии органов малого таза с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения при развитии полиорганной недостаточности всем пациентам с целью выявления органомегалии, поражения органов брюшной полости, внутрибрюшных лимфатических узлов, почек, свободной жидкости в брюшной полости и малом тазу [1, 3, 32, 235 - 238, 288]. (УДД 5, УРР C)
- Рекомендуется получение цитологического препарата костного мозга путем пункции с применением анестезиологического пособия (включая раннее послеоперационное ведение) и гистологического препарата костного мозга с цитологическим исследованием мазка костного мозга (миелограмма), патологоанатомическим исследованием биопсийного (операционного) материала костного мозга всем пациентам с целью выявления дифференцированных макрофагов, фагоцитирующих гемопоэтические клетки [1, 3, 32, 235 - 238, 289, 290]. (УДД 4, УУР C)
Комментарии: при тяжелом течении вГФС может развиться аплазия костного мозга.
2.2.4 Иные диагностические исследования
- Рекомендуется прием (осмотр, консультация) врача-невролога первичного пациентам с неврологической симптоматикой с целью оценки состояния центральной и периферической нервной системы [1, 3, 32, 235 - 238]. (УДД 5, УУР C)
Комментарии: у 30 - 35% пациентов развиваются симптомы поражения ЦНС; судороги, менингизм, снижение уровня сознания, паралич черепно-мозговых нервов, психомоторное возбуждение, атаксия, гипотония, раздражительность.
У половины пациентов с психоневрологическими симптомами в ликворе выявляется плеоцитоз, гиперпротеинархия (увеличение содержания белка в ликворе), гемофагоцитирующие клетки.
Встречается также периферическая нейропатия и выраженная общая слабость, непропорциональная степени анемии.
- Рекомендуется проведение осмотра (консультации) врачом-анестезиологом-реаниматологом первичного пациентам, которым планируются поднаркозные исследования с целью оценки состояния [60, 61, 218 - 220]. (УДД 5, УУР C)
Комментарии: перед всеми процедурами, которые требуют анестезиологического пособия/наркоза, необходим осмотр (консультация) врача-анестезиолога-реаниматолога.
- Рекомендуется проведение осмотра (консультации) врачом-анестезиологом-реаниматологом первичного пациентам, находящимся в тяжелом/критическом состоянии, с целью решения вопроса о переводе в отделение реанимации и интенсивной терапии [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется проведение суточного наблюдения врачом-анестезиологом-реаниматологом пациентам с панцитопенией, моноорганной или полиорганной недостаточностью, поражением ЦНС с целью оказания помощи условиях отделения реанимации и интенсивной терапии [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога первичный пациентам с геморрагическим синдромом проведение с целью оценки состояния сред и оболочек глаза, зрительного нерва, сетчатки и глазного дна [1, 3, 32, 235 - 238, 291 - 293]. (УДД 4, УУР C)
Комментарии: у пациентов с вГФС могут выявляться кровоизлияния в сетчатку, воспаление зрительного нерва и инфильтрация сосудистой оболочки глаза.
2.2.5 Критерии установления диагноза "Вторичный гемофагоцитарный синдром".
Критерии A. Ravelli et all. [236]:
Концентрация ферритина сыворотки крови > 684 нг/мл в сочетании с фебрильной лихорадкой и 2 из нижеследующих:
- число тромбоцитов крови <= 180 x 109/л;
- концентрация АСТ сыворотки > 48 ед/л;
- концентрация триглицеридов сыворотки крови > 1,75 ммоль/л;
- концентрация фибриногена крови <= 3,60 г/л.
2.2.6. Персонифицированный алгоритм диагностики вторичного гемофагоцитарного синдрома у пациентов с юношеским артритом
Всем пациентам с установленным диагнозом ЮА при наличии фебрильной лихорадки необходимо [294]:
Проведение оценки клинических показателей:
- лихорадка, сыпь, увеличение печени и селезенки, лимфаденопатия, миалгии, геморрагический синдром, поражение ЦНС (судороги, парестезии, спутанность сознания, черепно-мозговая или периферическая нейропатия), поражение почек, легких, сердца.
Проведение оценки результатов лабораторных показателей:
- уровень гемоглобина, абсолютное число эритроцитов, лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов крови, СОЭ, активность АЛТ, АСТ, ГГТ, ЛДГ, концентрация креатинина, мочевины, CРБ, ферритина, триглицеридов, ПКТ, общего белка и альбумина сыворотки крови, электролитный состав крови (натрий, калий, хлориды, железо), скорость клубочковой фильтрации (при нарастании азотемии), свертывающая способность крови (протромбин по Квику, тромбиновое время, протромбиновое время, МНО, АЧТВ, Д-димер, фибриноген, фибринмономер, фактор фон Виллебранда, протеин S, протеин C);
Проведение оценки результатов исследований:
- Инструментальных:
- ЭКГ, ЭХО-КГ, УЗИ органов брюшной полости, почек (комплексного), КТ органов грудной полости, МРТ органов брюшной полости, МРТ головного мозга; микробиологических: крови на стерильность, мочи, слизи с миндалин и с задней стенки глотки, кала на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам;
- молекулярно-биологических: обследование на вирусы из семейства Herpesviridae (цитомегаловирус, вирус Эпштейна-Барр, вирус простого герпеса 1 и 2 типа) (перечень включенных исследований - см. в соотв. разделе)
После анализа вышеописанных клинических данных и результатов исследований пациентам необходимо верифицировать диагноз вГФС согласно критериям A. Ravelli и соавт. от 2016 года (см. раздел 2.3) и инициировать иммуносупрессивную терапию в соответствии с алгоритмом лечения юношеского артрита с гемофагоцитарным синдромом (см. раздел 3.1.2).
Проведение контроля ранних маркеров развития вГФС [294]:
Всем пациентам с ЮА необходимо проведение контроля ранних маркеров развития вГФС:
Ранние клинические маркеры вГФС:
- Лимфаденопатия
Ранние инструментальные маркеры вГФС:
- Снижение числа эритроцитов крови < 4,34 млн/мкл
- Снижение числа тромбоцитов крови < 208 тыс./мкл
- Снижение концентрации хлоридов < 101,9 ммоль/л в крови
- Повышение активности ЛДГ в сыворотке крови > 412 Ед/л
При выявлении ранних маркеров развития вГФС необходимо инициировать иммуносупрессивную терапию в соответствии с алгоритмом лечения юношеского артрита с гемофагоцитарным синдромом (см. раздел 3.1.2).
2.3. Обследование пациентов с подтвержденным диагнозом юношеский артрит в стадии активной болезни с целью назначения/коррекции терапии
- Рекомендуется проведение обследования в условиях ревматологического стационара всем пациентам с установленным диагнозом ЮА, активная стадия с целью назначения/коррекции терапии [1, 3, 32]. (УДД 5, УУР C)
Жалобы и анамнез (см. пункт 2.1)
Физикальное обследование (см. пункт 2.2)
2.3.1 Лабораторные диагностические исследования
- Рекомендуется общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови) всем пациентам перед назначением/коррекцией противоревматической терапии с целью определения активности болезни и нежелательных эффектов НПВП и/или иммунодепрессантов и/или ГИБП [1, 3, 4, 32, 42, 45]. (УДД 5, УУР C)
Комментарии: у большинства пациентов с олигоартритом, показатели клинического анализа крови, как правило, находятся в пределах референсных значений, в ряде случаев отмечается повышение показателя СОЭ. У пациентов с полиартритом, ЮАС может наблюдаться умеренный лейкоцитоз, повышение показателя СОЭ, при сухом полиартрите - показатели клинического анализа крови находятся в пределах референсных значений.
При вГФС - лейкопения и/или тромбоцитопения, и/или эритропения, возможно снижение СОЭ. Нормальное число лейкоцитов и тромбоцитов у пациентов с лихорадкой могут свидетельствовать о течении вГФС. Одно-, двух или трехростковая цитопения может быть также нежелательным проявлением лечения НПВП и/или метотрексатом**, и/или ГИБП.
- Рекомендуется определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня протеина C в крови, определение активности протеина S в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение активности антитромбина III в крови пациентам с признаками васкулита перед назначением/коррекцией терапии с целью оценки состояния системы гемостаза и решения вопроса о проведении его коррекции [3, 32, 46 - 49, 51, 53 - 55]. (УДД 5, УУР C)
Комментарии: изменения в системе гемостаза по типу гиперкоагуляции могут наблюдаться у пациентов с серопозитивным полиартритом и васкулитом, ЮАС, по типу гипер/гипокоагуляции - при развитии вГФС.
- Рекомендуется исследование уровня гепарина в крови пациентам с признаками васкулита перед назначением/коррекцией терапии антикоагулянтами с целью оценки их эффективности [3, 32, 46 - 48, 50, 51, 56, 244, 245]. (УДД 5, УУР C)
- Рекомендуется проведение тромбоэластографии пациентам с признаками васкулита перед назначением/коррекцией терапии с целью разработки тактики антикоагулянтной терапии [46, 47, 50, 51, 56 - 59, 246, 247]. (УДД 4, УУР C)
- Рекомендуется исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтранспептидазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью оценки электролитного состава, функции печени, почек, поджелудочной железы, выявления маркеров ГФС [1, 3, 4, 32, 42, 44, 64 - 67]. (УДД 5, УУР C)
Комментарии: повышение уровня триглицеридов, ферритина, активности ЛДГ, АСТ и АЛТ свидетельствуют о развитии вГФС; повышение уровня креатинина и/или мочевины, и/или АЛТ, АСТ, и/или амилазы, и/или ГГТ, и/или ЩФ, и/или К, и/или общего билирубина, и/или глюкозы и/или холестерина, триглицеридов может быть нежелательным проявлением лечения НПВП и/или иммунодепрессанта, и/или ГИБП, и/или ГК.
У некоторых пациентов выявляется снижение уровня сывороточного железа, что отражает наличие анемии хронического заболевания.
- Рекомендуется определение основных групп по системе AB0, определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy, определение антигена D системы Резус (резус-фактор) всем пациентам перед проведением инвазивных исследований (эзофагогастродуоденоскопия, колоноскопия с биопсией, биопсия почки) или гемотрансфузий [1, 3, 60 - 63]. (УДД 5, УУР C)
- Рекомендуется исследование уровня прокальцитонина в крови пациентам с лихорадкой перед назначением/коррекцией противоревматической терапии с целью исключения септического процесса [32, 150 - 153]. (УДД 3, УУР C)
Комментарии: уровень прокальцитонина повышается при развитии бактериальной инфекции и острого воспалительного ответа.
- Рекомендуется исследование уровня C-реактивного белка в сыворотке крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью оценки активности заболевания [1, 3, 4, 43, 44, 65, 68, 69]. (УДД 3, УУР C)
- Рекомендуется определение антистрептолизина-O в сыворотке крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью выявления/исключения инфицированности в гемолитическим стрептококком группы A [1, 3, 4, 44, 65, 72, 73]. (УДД 3, УУР C)
Комментарии: при повышении уровня антистрептолизина-O в сыворотке крови необходима консультация врача-оториноларинголога и решение вопроса о дальнейшем обследовании с целью исключения очагов хронической инфекции ЛОР-органов.
- Рекомендуется определение содержания ревматоидного фактора (РФ) в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-CCP) в крови, определение содержания антител к антигенам ядра клетки и ДНК, всем пациентам перед назначением/коррекцией противоревматической терапии с целью выявления иммунологических маркеров [1, 3, 4, 32, 44, 65, 66, 70, 71]. (УДД 3, УУР C)
Комментарии: повышение содержания антител к антигенам ядра клетки (АНФ), как правило, наблюдается у пациентов с риском развития увеита или уже с наличием увеита, у пациентов с серопозитивным полиартритом; содержания антител к антигенам ядра клетки (АНФ) и антител двуспиральной ДНК - у пациентов, получающих ингибиторы ФНО-альфа, как проявления волчаночно-подобной реакции.
- Рекомендуется исследование популяций лимфоцитов всем пациентам, получающим #ритуксимаб** (L01XC), а также пациентам, часто болеющим вирусными, гнойными бактериальными инфекциями, в том числе оппортунистическими инфекциями, перед назначением/коррекцией противоревматической терапии с целью исключения иммунодефицитного состояния, развившегося в условиях иммуносупрессивной терапии и решения вопроса о терапии [3, 32, 83 - 85, 295 - 297]. (УДД 4, УУР C)
- Рекомендуется проведение очаговой пробы с туберкулином (реакция Манту, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**) и исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью исключения инфицированности микобактериями туберкулеза [3, 32, 86 - 94, 212, 298]. (УДД 4, УУР C)
- Рекомендуется определение антител к сальмонелле кишечной (Salmonella enterica) в крови, определение антител к сальмонелле тифи (Salmonella typhi) в крови, определение антител классов M, G (IgM, IgG) к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis) в крови, определение антител к сероварам иерсинии энтероколитика (Yersinia enterocolitica) в крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью исключения инфицированности бактериями кишечной группы и решения вопроса о проведении этиотропной терапии [1, 3, 32, 95, 96]. (УДД 5, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к шигелле Боуди (Shigella boydii) в крови, определение антител классов M, G (IgM, IgG) к шигелле дизентерии (Shigella dysenteriae) в крови, определение антител классов M, G (IgM, IgG) к шигелле Зонне (Shigella sonnei) в крови, определение антител классов M, G (IgM, IgG) к шигелле Флекснера (Shigella flexneri) в крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью исключения инфицированности бактериями кишечной группы и решения вопроса о проведении этиотропной терапии [1, 3, 32, 95, 96]. (УДД 5, УУР C)
- Рекомендуется определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci); определение антител к хламидии трахоматис (Chlamydia trachomatis); определение антител к хламидии пневмонии (Chlamydophila pheumoniae) в крови; определение антител классов M, G (IgM, IgG) в крови к микоплазме пневмонии (Mycoplasma pneumoniae) в крови всем пациентам перед назначением/коррекцией противоревматической терапии с целью подтверждения/исключения активной хламидийной и/или микоплазменной инфекции и решения вопроса о проведения этиотропной терапии [1, 3, 32, 81, 95 - 97]. (УДД 5, УУР C)
- Рекомендуется определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекцией и/или с лихорадкой, и/или получающим #ритуксимаб**, перед назначением/коррекцией противоревматической терапии, с целью лабораторного подтверждения/исключения активной Эпштейна-Барр вирусной инфекции и решения вопроса о проведении этиотропной терапии [1, 3, 32, 81, 113 - 118, 299]. (УДД 5, УУР C)
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР, качественное исследование пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**, перед назначением/коррекцией противоревматической терапии, с целью лабораторного подтверждения/исключения активной цитомегаловирусной, инфекции и решения вопроса о проведении этиотропной терапии [1, 3, 32, 115, 116, 119 - 122]. (УДД 4, УУР C)
- Рекомендуется определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями герпетической инфекции и/или с лихорадкой, и/или получающим #ритуксимаб** перед назначением/коррекцией противоревматической терапии, с целью лабораторного подтверждения/исключения активной герпетической инфекции и решения вопроса о проведении этиотропной терапии [1, 3, 32, 115, 116, 119]. (УДД 4, УУР C)
- Рекомендуется определение антител к вирусу простого герпеса (Herpes simplex virus) в крови пациентам с клиническими признаками герпетической инфекции, и/или с лихорадкой, и/или получающим #ритуксимаб**, с целью подтверждения/исключения активной герпетической инфекции и решения опроса о проведении этиотропной терапии [3, 32, 113, 115, 119, 126 - 130]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**, перед назначением/коррекцией противоревматической терапии с целью подтверждения/исключения активной цитомегаловирусной инфекции и решения вопроса о проведении этиотропной терапии [1, 112, 115, 121, 122, 124, 125]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**, перед назначением/коррекцией противоревматической терапии с целью исключения активной Эпштейна-Барр вирусной инфекции и решения вопроса о проведении этиотропной терапии [3, 32, 112, 113, 115, 124, 126]. (УДД 4, УУР C)
- Рекомендуется определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**, перед назначением/коррекцией противоревматической терапии с целью исключения активной Эпштейна-Барр вирусной инфекции и решения вопроса о проведении этиотропной терапии [3, 32, 112, 113, 115, 124, 126]. (УДД 5, УУР C)
- Рекомендуется определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**, перед назначением/коррекцией противоревматической терапии с целью исключения активной Эпштейна-Барр вирусной инфекции и решения вопроса о проведении этиотропной терапии [3, 32, 112, 113, 115, 124, 126]. (УДД 5, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью подтверждения/исключения пневмоцистной этиологии пневмонии и решения вопроса о проведении этиотропной терапии [276, 277, 279, 280, 300 - 303]. (УДД 4, УУР C)
- Рекомендуется определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью подтверждения/исключения пневмоцистной этиологии пневмонии и решения вопроса о проведении этиотропной терапии [276 - 278, 300 - 304]. (УДД 4, УУР C)
- Рекомендуется определение антител класса M, G к Pneumocystis jirovecii в крови при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью подтверждения/исключения пневмоцистной этиологии пневмонии и решения вопроса о проведении этиотропной терапии [276, 277, 279, 280, 300 - 303]. (УДД 5, УУР C)
- Рекомендуется определение ДНК Mycobacterium tuberculosis complex (M. tuberculosis, M. bovis, M. bovis BCG) с дифференциацией вида в мокроте, бронхоальвеолярной лаважной жидкости или промывных водах бронхов методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 267, 270, 305 - 310]. (УДД 4, УУР C)
- Рекомендуется определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [256 - 259]. (УДД 4, УУР C)
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [125, 311, 312]. (УДД 5, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование мокроты на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270, 271, 273, 300, 313, 314]. (УДД 3, УУР B)
- Рекомендуется микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270, 271, 273, 300, 313, 314]. (УДД 3, УУР B)
- Рекомендуется микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270, 271, 273, 300, 313, 314]. (УДД 3, УУР B)
- Рекомендуется определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии. (УДД 3, УУР B)
- Рекомендуется определение маннана, галактоманнана в лаважной жидкости и крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270, 271, 273, 300, 313, 314]. (УДД 3, УУР B)
- Рекомендуется определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в сыворотке крови методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270, 271, 273, 300, 313, 314]. (УДД 4, УУР C)
- Рекомендуется определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в бронхоальвеолярном лаваже методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270, 271, 273, 300, 313, 314]. (УДД 4, УУР C)
- Рекомендуется общий (клинический) анализ мочи и исследование мочи методом Нечипоренко всем пациентам перед назначением/коррекцией противоревматической терапии с целью оценки состояния мочевыделительной системы [1, 3, 4, 32, 65, 159]. (УДД 5, УУР C)
Комментарии: микро- макрогематурия может быть следствием токсического влияния НПВП и метотрексата** на почки; протеинурия может быть проявлением амилоидоза почек.
- Рекомендуется микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы всем пациентам перед назначением/коррекцией противоревматической терапии с целью исключения контаминации носоглотки аэробными и факультативно анаэробными микроорганизмами [1, 3, 32, 81, 95, 157, 158]. (УДД 5, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы пациентам с фебрильной и гектической лихорадкой перед назначением/коррекцией противоревматической терапии с целью исключения сепсиса [1, 3, 32, 81, 150, 151, 154 - 156]. (УДД 4, УУР C)
- Рекомендуется исследование уровня кальпротектина в кале пациентам с клиническими проявлениями воспалительных заболеваний кишечника перед назначением/коррекцией противоревматической терапии с целью решения вопроса о дальнейшей тактике обследования [3, 32, 160 - 162]. (УДД 4, УУР C)
2.3.2 Инструментальные диагностические исследования
- Рекомендуется проведение комплексного ультразвукового исследования внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек) всем пациентам перед назначением/коррекцией терапии с целью оценки состояния печени, селезенки, почек, других органов, наличия/отсутствия свободной жидкости в брюшной полости [3, 18, 32]. (УДД 5, УУР C)
Комментарии: при активном ЮА могут выявляться увеличение размеров и изменения паренхимы печени и селезенки, лимфаденопатия. Патологические изменения в почках при ЮА, как правило, не выявляются. При развитии вторичного амилоидоза могут определяться типичные для этого осложнения патологические изменения со стороны органов брюшной полости, почек.
- Рекомендуется проведение эхокардиографии всем пациентам перед назначением/коррекцией противоревматической терапии с целью оценки состояния функции сердца, выявления поражения эндокарда, миокарда, перикарда [1, 3, 4, 32, 34]. (УДД 5, УУР C)
Комментарии: при миокардите выявляется дилатация левого желудочка, снижение фракции выброса левого желудочка, гипокинезия задней стенки левого желудочка и/или межжелудочковой перегородки, признаки относительной недостаточности митрального, аортального и/или трикуспидального клапанов, повышение давления в легочной артерии. Перикард, эндокард и клапанный аппарат при ЮА, как правило, не поражаются.
- Рекомендуется проведение регистрации электрокардиограммы всем пациентам перед назначением/коррекцией противоревматической терапии с целью оценки состояния функции сердца [1, 3, 4, 32, 34]. (УДД 5, УУР C)
Комментарии: при наличии миокардита выявляются признаки перегрузки левых и/или правых отделов сердца. Перикардит в большинстве случаев не сопровождается снижением вольтажа зубцов, подъемом сегмента ST, инверсией зубца T на ЭКГ.
- Рекомендуется проведение холтеровского мониторирования сердечного ритма пациентам с аритмией, патологическими изменениями по данным электрокардиограммы перед назначением/коррекцией противоревматической терапии с целью разработки индивидуальной программы кардиотропной терапии [1, 3, 32, 34, 315 - 317]. (УДД 5, УУР C)
- Рекомендуется проведение суточного мониторирования артериального давления пациентам с артериальной гипертензией перед назначением/коррекцией противоревматической терапии с целью выявления отклонений артериального давления от нормы и разработки индивидуальной программы гипотензивной терапии [1, 3, 32, 34, 315 - 317]. (УДД 5, УУР C)
- Рекомендуется проведение ультразвукового исследования сустава всем пациентам с активным артритом для оценки состояния синовиальной оболочки, хряща и выявления выпота в полость сустава [1, 3, 32, 42, 163 - 166]. (УДД 5, УУР C)
Комментарии: при активном артрите определяется увеличение количества синовиальной жидкости, утолщение (разрастание) синовиальной оболочки, разволокнение хряща, эрозии хряща.
- Рекомендуется проведение рентгенографии височно-нижнечелюстного сустава и/или рентгенографии межпозвоночных сочленений, и/или рентгенографии локтевого сустава, и/или рентгенографии лучезапястного сустава, и/или рентгенографии коленного сустава, и/или рентгенографии плечевого сустава, и/или рентгенографии тазобедренного сустава, и/или рентгенографии голеностопного сустава, и/или рентгенографии акромиально-ключичного сочленения, и/или рентгенографии грудинно-ключичного сочленения, и/или рентгенографии кисти и/или рентгенографии стопы в двух проекциях или компьютерной томографии сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с активным артритом перед назначением/коррекцией противоревматической терапии с целью определения агрессивности течения заболевания и эффективности противоревматической терапии [1, 3, 32, 42, 163 - 166]. (УДД 5, УУР C)
Комментарии: могут выявляться: остеопороз, деструктивные изменения костных структур, сужение суставной щели, целостность суставных поверхностей костей, составляющих сустав, наличие эрозий, узурации суставных поверхностей, кисты, очаги некроза костной ткани, подвывихи, переломы, остеофиты, кальцинаты и др. Прогрессирование деструктивных изменений хрящевой и костной ткани суставов на фоне лечения ГИБП в сочетании (или без) с иммунодепрессантом является показанием для коррекции терапии.
- Рекомендуется проведение магнитно-резонансной томографии суставов (один сустав) с контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с активным артритом перед назначением/коррекцией противоревматической терапии для выявления степени разрастания синовиальной оболочки (паннуса), повреждения хряща, отека костного мозга, ранних проявлений асептического остеонекроза, кист Бейкера [1, 3, 32, 166, 170, 318, 319]. (УДД 1, УУР A)
- Рекомендуется проведение магнитно-резонансной томографии позвоночника (один отдел), компьютерной томографии позвоночника (один отдел), компьютерной томографии костей таза с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с жалобами на боли в спине, наличием энтезопатий (по данным физикального осмотра) при подозрении на юношеский анкилозирующий спондилит перед назначением/коррекцией противоревматической терапии с целью выявления/исключения поражения позвоночника, крестцово-подвздошных сочленений [1, 3, 24, 32, 45, 171 - 178] (УДД 5, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии головного мозга с контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с неврологической симптоматикой с целью выявления поражения головного мозга [1, 3, 32, 307, 320 - 324]. (УДД 4, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии органов брюшной полости с внутривенным контрастированием, магнитно-резонансной томографии забрюшинного пространства с внутривенным контрастированием, магнитно-резонансной томографии органов малого таза с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов перед назначением/коррекцией противоревматической терапии с целью выявления полисерозита, поражения органов брюшной полости, забрюшинного пространства и малого таза [1, 3, 32, 41, 91, 168, 199, 202, 203, 210]. (УДД 5, УУР C)
- Рекомендуется проведение компьютерной томографии органов брюшной полости с внутривенным болюсным контрастированием, компьютерной томографии забрюшинного пространства с внутривенным болюсным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения при наличии противопоказаний к проведению МРТ пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов перед назначением/коррекцией противоревматической терапии с целью выявления поражения органов брюшной полости и забрюшинного пространства [1, 3, 32, 168, 204, 205, 325]. (УДД 5, УУР C)
- Рекомендуется проведение эзофагогастродуоденоскопии с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам перед назначением/коррекцией противоревматической терапии с целью исключения воспалительных заболеваний верхних отделов ЖКТ, связанных с основным заболеванием и/или с Helicobacter pylori и/или с применением НПВП, и/или ГК [3, 32, 160, 161, 184 - 191]. (УДД 4, УУР C)
- Рекомендуется проведение биопсии желудка/двенадцатиперстной кишки с помощью эндоскопии с патолого-анатомическим исследованием биопсийного (операционного) материала желудка и микробиологическим (культуральным) исследованием биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений слизистой оболочки перед назначением/коррекцией противоревматической терапии с целью исключения воспалительных заболеваний верхних отделов ЖКТ, связанных с Helicobacter pylori и/или с применением НПВП, и/или ГК [3, 32, 160, 161, 184 - 188, 190 - 193, 326]. (УДД 4, УУР C)
- Рекомендуется проведение компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам перед назначением/коррекцией противоревматической терапии, а также пациентам, получающим иммунодепрессанты и/или ГИБП в сочетании (или без) ГК, для исключения очаговой, долевой, интерстициальной пневмонии, туберкулеза легких [1, 3, 32, 41, 86, 90 - 92, 168, 168, 199 - 201, 212]. (УДД 4, УУР C)
Комментарии: интерстициальная пневмония наиболее часто развивается на фоне применения #ритуксимаба**, реже - тоцилизумаба**, крайне редко на фоне лечения ингибиторами ФНО-альфа. Очаговая, долевая пневмония - на фоне терапии тоцилизумабом**, ингибиторами ФНО-альфа.
Интерстициальную пневмонию следует заподозрить при появлении субфебрильной/фебрильной лихорадки, сухого кашля/кашля с незначительным количеством мокроты/одышки, крепитаций/ослабления дыхания при аускультации, одышки.
Для очаговой/долевой пневмонии, развивающейся в условиях терапии тоцилизумабом**, характерно асимптомное течение.
- Рекомендуется проведение бронхоскопии с применением анестезиологического пособия (включая раннее послеоперационное ведение) пациентам с поражением легких перед назначением/коррекцией противоревматической терапии с целью оценки состояния слизистой оболочки бронхиального дерева и получения бронхо-альвеолярного лаважа для дальнейшего исследования [124, 270, 271, 273, 300, 313, 314]. (УДД 3, УУР B)
- Рекомендуется проведение рентгенденситометрии пациентам, получающим или получавшим ГК, перед назначением/коррекцией противоревматической терапии с целью выявления остеопении/остеопороза и разработки тактики терапии [3, 32, 327, 328]. (УДД 5, УУР C)
- Рекомендуется проведение флоуметрии дыхания всем пациентам с поражением легких перед назначением/коррекцией противоревматической терапии с целью оценки состояния функции бронхолегочной системы. (УДД 5, УУР C)
2.3.3 Иные диагностические исследования
Консультации специалистов с целью диагностики и лечения проявлений основного заболевания, сопутствующей патологии и/или осложнений.
- Рекомендуется прием (осмотр, консультация) врача-оториноларинголога первичный всем пациентам перед назначением/коррекцией терапии с целью выявления очагов хронической инфекции ЛОР органов и решения вопроса о проведении санации [1, 3, 32, 95, 329]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-стоматолога детского первичный всем пациентам перед назначением/коррекцией противоревматической терапии с целью определения состояния ротовой полости и необходимости ее санации [1, 3, 4, 32, 215, 330, 331]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога первичный с обязательной биомикроскопий глаза всем пациентам перед назначением/коррекцией противоревматической терапии с целью исключения увеита, а также пациентам, получающим ГК, с целью исключения осложненной катаракты [1, 3, 15, 32, 332, 333]. (УДД 5, УУР C)
Комментарии: пациентам с увеитом назначается местная терапия, пациентам с осложненной стероидной катарактой назначается местная терапия.
- Рекомендуется прием (осмотр, консультация) врача-детского кардиолога первичный пациентам с нарушением сердечной деятельности и/или артериальной гипертензией с целью решения вопроса о проведении кардиотропной и/или гипотензивной терапии перед назначением/коррекцией противоревматической терапии [1, 3, 32, 34, 334]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-фтизиатра первичный перед назначением/коррекцией противоревматической терапии пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или очаговыми, инфильтративными изменениями в легких с целью решения вопроса о проведении химиопрофилактики или противотуберкулезной химиотерапии [3, 32, 86, 88, 90 - 92, 212, 213]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-детского эндокринолога первичный пациентам с сопутствующей эндокринологической патологией, в том числе стероидным диабетом, с целью решения вопроса о проведении терапии [1, 3, 32, 327, 328, 335, 336]. (УДД 5, УУР C)
- Рекомендуется прием (тестирование, консультация) медицинского психолога первичный пациентам с возраста 1 года и их родителям для гармонизации процесса формирования детской личности в условиях тяжелого хронического заболевания и оптимизации детско-родительских отношений; повышения приверженности лечению, сотрудничеству с врачом и медицинским персоналом для достижения ремиссии заболевания; для достижения психологической адаптации в социуме; для разработки индивидуальной программы психологической реабилитации для пациента и его родителей [32, 221 - 227, 337 - 339]. (УДД 2, УУР A)
- Рекомендуется прием (осмотр, консультация) врача-невролога первичный пациентам с неврологической симптоматикой, отставанием в психомоторном развитии, психотическими реакциями с целью решения вопроса о проведении терапии [1, 3, 4, 32, 216]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-диетолога первичный пациентам с дефицитом массы тела, амиотрофией, остепенией/остеопорозом, конституциональным ожирением и синдромом Кушинга, стероидным диабетом с целью разработки индивидуальной программы диетического питания [1, 3, 32, 340, 341]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-ортопеда травматолога первичный пациентам с функциональной недостаточностью суставов, нарушением роста костей в длину, подвывихами, болью в спине, а также с целью решения вопроса о проведении реконструктивных операций и протезирования суставов [1, 3, 32, 214]. (УДД 5, УУР C)
- Рекомендуется проведение осмотра (консультации) врача-анестезиолога-реаниматолога первичного всем пациентам, которым планируется проведение поднаркозных исследований с целью оценки их состояния [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется проведение осмотра (консультации) врача-анестезиолога-реаниматолога первичного всем пациентам, находящимся в тяжелом состоянии, с целью решения вопроса о переводе в отделение реанимации и интенсивной терапии [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется проведение суточного наблюдения врачом-анестезиологом-реаниматологом всех пациентов, находящихся в критическом состоянии (моно/полиорганная недостаточность, вГФС), с целью оказания помощи в условиях отделения реанимации и интенсивной терапии [60, 61, 218 - 220]. (УДД 5, УУР C)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
- Рекомендуется назначение патогенетической терапии всем пациентам после проведения диагностики, в том числе дифференциальной диагностики, и установления/подтверждения диагноза ЮА, в условиях ревматологического стационара, с целью контроля безопасности и эффективности лечения [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется проведение переключения на другой селективный иммунодепрессант (ингибитор янус-киназ) и/или дженерник исключительно по медицинским показаниям; не рекомендуется автоматическое переключение с целью сохранения ремиссии заболевания и предотвращения развития нежелательных явлений [342 - 344]. (УДД 5, УУР C)
- Рекомендуется переключение на другой генно-инженерный биологический препарат и/или биоаналог исключительно по медицинским показаниям; не рекомендуется автоматическое переключение с целью сохранения ремиссии заболевания, предотвращения формирования нейтрализующих антител и развития нежелательных явлений [342 - 344]. (УДД 5, УУР C)
Комментарии: в настоящее время зарегистрированы биоаналоги (биосимиляры) ингибиторов фактора некроза опухоли альфа (ФНО-альфа) анти-ФНО, а также дженерики ингибиторов янус-киназ, которые эквивалентны им по строению. Часть из этих препаратов в клинических испытаниях у взрослых пациентов показали схожую с оригинальными препаратами эффективность [345]. Однако в детской популяции с юношеским артритом клинические испытания бионалагов и дженериков иммунодепрессантов и селективных иммунодепрессантов не проводились.
Оригинальный иммунодепрессант и/или селективный иммунодепрессант, и/или ГИБП не могут автоматически заменяться на дженерик и биоаналог. Замена препаратов может осуществляться только на основе консенсуса лечащего врача, инициировавшего терапию иммунодепрессантом и/или селективным иммунодепрессантом, и/или ГИБП, после получения информированного согласия родителей и детей старше 15 лет.
3.1 Консервативное лечение
3.1.1 Лечение юношеского полиартрита (полиартикулярного ювенильного идиопатического артрита серонегативного и серопозитивного)
- Рекомендуется проведение контроля эффективности любого лекарственного препарата, применяемого для патогенетической терапии через 3 и 6, далее каждые 6 месяцев терапии (препарат эффективен при достижении 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace) (см. Приложение 3) [1, 3, 32, 346, 347]. (УДД 5, УУР C)
- Рекомендуется проведение коррекции терапии (переключение препаратов) до достижения эффективности или минимальной/низкой активности болезни у пациентов с длительно текущим заболеванием вне зависимости от применяемого препарата [1, 3, 32, 346, 347]. (УДД 5, УУР C)
- Рекомендуется назначение монотерапии НПВП (M01A) длительностью не более 1 мес. на этапе обследования пациентам с неустановленным диагнозом ЮА с целью достижения противовоспалительного эффекта [1, 3, 42, 348 - 357]. (УДД 5, УУР C)
- Рекомендуется назначение НПВП (M01A) с целью купирования лихорадки и болевого синдрома у пациентов с установленным диагнозом ЮА [1, 3, 42, 348 - 357]. (УДД 5, УУР C)
Комментарии: применяются следующие режимы назначения НПВП:
- диклофенак** (M01AB) в соответствии с инструкцией по применению препарата или
- нимесулид (M01AX) в соответствии с инструкцией по применению препарата или
- мелоксикам (M01AC) в соответствии с инструкцией по применению препарата, или
- ибупрофен** (M01AE01) в соответствии с инструкцией по применению препарата с целью достижения противовоспалительного, обезболивающего и жаропонижающего эффекта [3, 32, 355, 357 - 364].
Диклофенак** (M01AB) применяется у детей с 6 лет в таблетках и суппозиториях, в виде в/м инъекций (разрешен с 18 лет).
Нимесулид (M01AX) применяется у детей с 2-х лет в суспензии, старше 12 лет - в таблетках.
Мелоксикам (M01AC) применяется у детей с 2-х лет в суспензии, старше 15 лет в таблетках, в виде в/м инъекции разрешен с 18 лет.
Ибупрофен** (M01AE01) применяется у детей старше 3 мес. в суспензии, старше 6 лет в таблетках, интервалы между приемами препарата 6 - 8 ч.
#Диклофенак** (M01AB), #нимесулид (M01AX), #мелоксикам (M01AC) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Не рекомендуется проведение монотерапии НПВП (M01A) длительностью более 1 мес. с целью минимизации побочных эффектов длительного приема НПВП [1, 3, 32]. (УДД 5, УУР C)
- Не рекомендуется назначение глюкокортикоидов (H02AB) перорально и/или внутривенно, и/или внутрисуставно, и/или иммунодепрессантов (метотрексата** (L01BA) или #лефлуномида** (L04FFAA)), и/или ГИБП (тоцилизумаба** (L04AC), или адалимумаба** (L04AB), или этанерцепта** (L04AB), или голимумаба** (L04AB), или абатацепта** (LO4AA24), или #ритуксимаба** (L04AC10)) и/или тофацитиниба** (L04AA), или #упадацитиниба** (L04AA), или барицитиниба** (L04AA) до завершения полного лабораторно-инструментального обследования, исключения онкологических, онко-гематологических, инфекционных заболеваний и установления диагноза ЮА (см. разделы 2, 3) [1, 3, 42, 348]. (УДД 5, УУР C)
Комментарии: применение глюкокортикоидов (H02AB), иммунодепрессантов (метотрексата** (L01BA) или #лефлуномида** (L04FFAA)), и/или ГИБП (тоцилизумаба** (L04AC), или адалимумаба** (L04AB), или этанерцепта** (L04AB), или голимумаба** (L04AB), или абатацепта** (LO4AA24), или #ритуксимаба** (L04AC10)) и/или тофацитиниба** (L04AA), или #упадацитиниба** (L04AA), или барицитиниба** (L04AA) при онкологических и онко-гематологических заболеваниях, протекающих под маской ЮА, значительно затруднит в дальнейшем верификацию диагноза, так как они обладают выраженным иммуносупрессивным эффектом, нивелируют клиническую и морфологическую картину злокачественных новообразований.
- Рекомендуется внутрисуставное введение:
- бетаметазона** (H02AB) детям старше 3-х лет в соответствии с инструкцией по применению или
- #триамцинолона (H02AB) детям старше 12 лет в дозе 1 - 2 мг/кг (максимальная доза 80 мг) при введении в коленные суставы, 0,5 - 1 мг/кг (максимальная доза 40 мг) - в голеностопные, локтевые суставы и 0,3 - 0,5 мг/кг (максимальная доза 40 мг) - в лучезапястные суставы, мелкие суставы кистей и стоп [365 - 368]
пациентам с активным моно- или олигоартритом не чаще 1 раза в 4 мес. с целью быстрого купирования воспалительного процесса в суставах [1, 3, 32, 86, 348, 365 - 370] (УДД 5, УУР C).
Комментарии: при частом обострении артрита (чаще, чем 1 раз в 4 мес.) внутрисуставное введение ГК не проводится. Показания к внутрисуставному введению ГК - выраженные экссудативные изменения и болевой синдром в пораженных суставах.
#Бетаметазон** (H02AB) и #триамцинолон вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей в старше 15 лет.
- Рекомендуется проведение пульс-терапии #метилпреднизолоном** (H02AB) в дозе 10 - 30 мг/кг/введение внутривенно в течение 3, при необходимости 5 дней подряд при фебрильной/гектической лихорадке, полиартрите, сопровождающемся болевым синдромом, не купирующимся приемом НПВП (M01A) и выраженной функциональной недостаточностью с целью достижения быстрого противовоспалительного и иммуноподавляющего эффекта [3, 32, 358, 372 - 375]. (УДД 5, УУР C)
Комментарии: пульс-терапия #метилпреднизолоном** (H02AB) назначается по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение метотрексата** (L01BA) в дозе 15 мг/м2/нед 1 раз в нед. подкожно или перорально пациентам с активным полиартритом сразу после верификации диагноза при высокой активности болезни вне зависимости от наличия факторов неблагоприятного прогноза с целью индукции ремиссии заболевания [1, 3, 32, 42, 348, 376 - 380]. (УДД 2, УУР B)
Комментарии: Подкожный способ введения метотрексата** (L01BA) является предпочтительным из-за более высокой биодоступности.
Метотрексат** (L01BA) предпочтительно применять в градуированных шприцах (здесь и далее).
Вне возрастных показаний #метотрексат** (L01BA) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Контроль эффективности терапии - см. Приложения Г1 - Г4
- Рекомендуется назначение метотрексата** (L01BA) в дозе 15 мг/м2/нед 1 раз в нед. подкожно или перорально пациентам с активным полиартритом сразу после верификации диагноза при средней активности болезни, при наличии факторов неблагоприятного прогноза с целью индукции ремиссии заболевания [1, 3, 32, 42, 348, 376 - 380]. (УДД 2, УУР B)
Комментарии: вне возрастных показаний #метотрексат** (L01BA) назначается по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение метотрексата** (L01BA) в дозе 15 мг/м2/нед 1 раз в нед. подкожно или перорально пациентам с активным полиартритом через 1 мес. лечения НПВП при низкой активности болезни и наличии факторов неблагоприятного прогноза или при средней степени активности болезни и отсутствии факторов неблагоприятного прогноза с целью индукции ремиссии заболевания [1, 3, 32, 42, 348, 376 - 380]. (УДД 2, УУР B)
Комментарии: вне возрастных показаний #метотрексат** (L01BA) назначается по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Не рекомендуется увеличение дозы метотрексата** (L01BA) > 15 мг/м2/нед. (не более 25 мг/нед) пациентам с активным артритом с целью предотвращения развития токсических реакций [1, 3, 32, 42, 348, 376 - 380]. (УДД 2, УУР B)
Комментарии: повышение дозы метотрексата** (L01BA) не ассоциировано с дополнительными терапевтическими преимуществами.
- Рекомендуется подкожное введение метотрексата** (L01BA) пациентам с активным артритом с целью обеспечения стабильной биодоступности препарата [1, 3, 32, 42, 348, 376 - 380]. (УДД 2, УУР B)
Комментарии: подкожный способ введения метотрексата** (L01BA) является предпочтительным, так как обеспечивает стабильную биодоступность.
При непереносимости метотрексата** (L01BA) для подкожного введения назначается метотрексат** (L01BA) в таблетках для перорального приема.
Вне возрастных показаний метотрексат** (L01BA) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Контроль эффективности терапии - см. Приложения Г1 - Г4
- Рекомендуется назначение #фолиевой кислоты** (B03BB) в дозе 1 мг каждый день кроме дня приема метотрексата** или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема метотрексата** (L01BA) с целью предотвращения его побочных эффектов [3, 32, 358, 377, 381 - 384]. (УДД 5, УУР C)
Комментарии: #фолиевая кислота** (B03BB) вне возрастных показаний назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется переключение на #лефлуномид** (L04FFAA) при непереносимости или неэффективности метотрексата** (L01BA) пациентам с серопозитивным полиартритом с целью индукции/поддержания ремиссии [3, 32, 42, 348, 358, 385, 386]. (УДД 4, УУР C)
Комментарий: #лефлуномид** (L04FFAA) предпочтительно назначать пациентам подросткового возраста с серопозитивным ЮА.
- Рекомендуется назначение #лефлуномида** (L04FFAA) перорально детям массой тела < 20 кг - 10 мг в сут. однократно через день; детям массой тела 20 - 40 кг - 10 мг в сут. ежедневно; детям массой тела > 40 кг - 20 мг в сут. ежедневно с целью поддержания/индукции ремиссии заболевания [3, 32, 42, 348, 358, 385, 386]. (УДД 4, УУР C)
- Рекомендуется переключение на ГИБП или селективный иммунодепрессант при непереносимости метотрексата** (L01BA) или #лефлуномида** (L04FFAA) с целью индукции/поддержания ремиссии [1, 42, 348, 387 - 393]. (УДД 5, УУР C)
- Рекомендуется переключение на один из следующих препаратов:
- ингибиторы ФНО альфа (L04AB) [332, 387 - 390, 394] (УДД 2, УУР B)
- тоцилизумаб** (L04AC) [387, 391] (для тоцилизумаба в форме для внутривенного введения - (УДД 2, УУР B), для тоцилизумаба в форме для подкожного введения - (УДД 4, УУР C)
- тофацитиниб** (L04AA) [392] (УДД 2, УУР B)
- #упадацитиниб** (L04AA) [395 - 402] (УДД 4 УУР C)
- барицитиниб** (L04AA) [614, 615] (УДД 2, УУР B)
- абатацепт** (LO4AA24) [387] (УДД 2, УУР B)
при непереносимости метотрексата** (L01BA) или #лефлуномида** (L04FFAA) с целью индукции/поддержания ремиссии.
- Рекомендуется назначение ГИБП или селективного иммунодепрессанта в комбинации с метотрексатом** при его неэффективности или #лефлуномидом** при его неэффективности, или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни с целью индукции ремиссии [1, 42, 348, 387 - 393]. (УДД 5, УУР C)
- Рекомендуется назначение одного из следующих препаратов:
- ингибиторы ФНО альфа (L04AB) [332, 387 - 390, 394] (для схем с применением ингибиторов ФНО альфа в сочетании с метотрексатом** - (УДД 2, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C)
- тоцилизумаб** (L04AC) [387, 391] (для схем с применением тоцилизумаба** в форме для внутривенного введения в сочетании с метотрексатом** - (УДД 2, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C); для схем с применением тоцилизумаба** в форме для подкожного введения метотрексатом** - (УДД 4, УРР C); в сочетании с #лефлуномидом** - (УДД 5, УРР C)
- тофацитиниб** (L04AA) [392] (для схем с применением #тофацитиниба** в сочетании с метотрексатом** - (УДД 2, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C)
- упадацитиниб** (L04AA) [395 - 402] (УДД 5, УРР C)
- барицитиниб** (L04AA) [614, 615] (УДД 2, УУР B)
- абатацепт** (LO4AA24) [387] (для схем с применением #абатацепта** в сочетании с метотрексатом** - (УДД 2, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C)
в комбинации с метотрексатом** (L01BA) при его неэффективности или #лефлуномидом** (L04FFAA) при его неэффективности с целью индукции ремиссии.
Комментарии: критериями неэффективности являются недостижение 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
Аналогично проводится переключение на один из указанных выше препаратов в сочетании с метотрексатом** (L01BA) или #лефлуномидом** (L04FFAA), или в качестве монотерапии при неэффективности используемой комбинации препаратов.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
Режимы дозирования см. ниже.
- Рекомендуется назначение одного из следующих препаратов:
- адалимумаба** (L04AB) безцитратной формы (40 мг/0,4 мл) подкожно 1 раз в 2 нед. пациентам >= 2 лет с массой тела 10 - 30 кг - 20 мг, с массой тела; > 30 кг - 40 мг
- этанерцепта** (L04AB) лиофилизата для приготовления раствора для подкожного введения пациентам >= 2 лет и массой тела менее 62,5 кг в дозе 0,4 мг/кг/введение 2 раза в нед. или 0,8 мг/кг/введение 1 раз в нед.
- голимумаба** (L04AB) пациентам >= 2 лет с массой тела < 40 кг - в дозе 30 мг/м2 подкожно; >= 40 кг - 50 мг подкожно 1 раз в 4 нед.
в комбинации с метотрексатом** (L01BA) или #лефлуномидом** (L04FFAA), или в качестве монотерапии с целью индукции ремиссии [42, 348, 387 - 390, 394, 403 - 407] (для схем с применением #адалимумаба** или этанерцепта**, или олимумаба** в качестве монотерапии - (УДД 2, УРР B); в сочетании с метотрексатом** - (УДД 2, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C)
Комментарии: при неэффективности метотрексата** (L01BA) или неэффективности #лефлуномида** (L04FFAA) в качестве ГИБП первого выбора предпочтительно применять ингибиторы ФНО-альфа.
Моноклональные антитела к ФНО-альфа (адалимумаб**, голимумаб**) (L04AB) предпочтительно назначать в сочетании с метотрексатом** или #лефлуномидом** для снижения риска формирования нейтрализующих антител.
Дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
Вне возрастных показаний #адалимумаб** (L04AB), #этанерцепт** (L04AB) и #голимумаб** (L04AB) назначаются по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей [348].
Показание к применению у детей и подростков с юношеским артритом в возрасте от 2 до 17 лет и с массой тела менее 62,5 кг имеет только лекарственный препарат этанерцепт** "лиофилизат для приготовления раствора для подкожного введения". Лекарственный препарат этанерцепт** "раствор для подкожного введения" имеет противопоказание к применению - детский возраст младше 12 лет и с массой тела менее 62,5 кг. [408 - 411]
Согласно письму разъяснению ФАС N ТН/109573/21 от 22.12.2021 и медицинским инструкциям по применению лекарственного препарата Этанерцепт** [412]:
использование лекарственной формы "раствор для подкожного введения" вместо "лиофилизат для приготовления раствора для подкожного введения" у детей младше 12 лет и массой тела менее 62,5 кг не признается приемлемым в связи с различиями в конечной концентрации растворов и отсутствии исследований, позволяющих оценить переносимость, эффективность и фармакокинетику применения у детей раствора в дозировке 50 мг/мл. Таким образом, замена лекарственной формы "лиофилизат для приготовления раствора для подкожного введения" у данного пациента является невозможной.
Для лечения пациентов с ЮА целесообразно применять лекарственный препарат адалимумаб** безцитратную форму 40 мг/0,4 мл с целью избежания причинения детям необоснованной боли, которая развивается при применении лекарственного препарата адалимумаб** цитратной формы 40 мг/0,8 мл [404 - 407, 413].
Учитывая выраженный болевой синдром при применении лекарственного препарата адалимумаб** цитратной формы 40 мг/0,8 мл применение данной формы препарата у пациентов детского возраста является невозможным [404 - 407, 413].
- Рекомендуется назначение тоцилизумаба** (L04AC):
- детям с массой тела < 30 кг - в дозе 10 мг/кг/введение, детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно, внутривенно 1 раз в 4 нед.
или
- детям с массой тела < 30 кг в дозе 162 мг подкожно 1 раз в 3 нед., детям с массой тела >= 30 кг - в дозе 162 мг подкожно 1 раз в 2 нед.
в комбинации с метотрексатом** (L01BA) или #лефлуномидом** (L04FFAA), или в качестве монотерапии с целью индукции ремиссии заболевания [42, 348, 387, 391, 414]. (для схем с применением тоцилизумаба** в форме для внутривенного введения в качестве монотерапии - (УДД 2, УРР B), в сочетании с метотрексатом** - (УДД 2, УРР B); для схем с применением тоцилизумаба** в форме для подкожного введения в качестве монотерапии - (УДД 4, УРР C), в сочетании с метотрексатом** - (УДД 4, УРР C); для схем с применением тоцилизумаба** в формах для внутривенного или подкожного введения в сочетании с #лефлуномидом** - (УДД 5, УРР C).
Комментарии: дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
#Тоцилизумаб** (L04AC) назначается по жизненным показаниям детям младше 2-х лет внутривенно или детям младше 1 года подкожно по решению врачебной комиссии, после получения информированного согласия родителей [348].
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение:
- тофацитиниба** (L04AA) перорально пациентам в возрасте >= 2-х лет и массой тела >= 40 кг в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) или
- #упадацитиниба** (L04AA) перорально пациентам в возрасте >= 12 лет и массой тела >= 40 кг 15 мг 1 раза в сут.
- барицитиниба** (L04AA) перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. [614, 615]
в комбинации с метотрексатом** (L01BA) или в качестве монотерапии с целью индукции ремиссии заболевания [392, 395, 397 - 402]. (для схем с применением тофацитиниба**, барицитиниба** в качестве монотерапии - (УДД 2, УРР B), в сочетании с метотрексатом** - (УДД 2, УРР B); для схем с применением #упадацитиниба** в качестве монотерапии - (УДД 4, УРР C), в сочетании с метотрексатом** - (УДД 4, УРР C).
Комментарии: дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
#Тофацитиниб** (L04AA) назначается по жизненным показаниям детям возрасте <= 2 лет, по решению врачебной комиссии, после получения информированного согласия родителей [415].
#Барицитиниб** (L04AA) назначается по жизненным показаниям детям возрасте <= 2 лет, по решению врачебной комиссии, после получения информированного согласия родителей [614, 615].
#Упадацитиниб** (L04AA) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [392, 395, 397 - 402].
- Рекомендуется назначение абатацепта** (LO4AA24) внутривенно детям старше 6 лет с массой тела менее 75 кг в дозе 10 мг/кг/ведение, детям с массой тела от 75 - 100 кг - в дозе 750 мг, детям с массой тела более 100 кг - в дозе 1000 мг по схеме 0, 2, 4-я нед., далее каждые 4 нед. в комбинации с метотрексатом** (L01BA) или #лефлуномидом** (L04FFAA), или в качестве монотерапии с целью индукции ремиссии заболевания [42, 348, 387, 416]. (для схем с применением абатацепта** в качестве монотерапии - (УДД 2, УРР B), в сочетании с метотрексатом** - (УДД 2, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C).
Комментарии: абатацепт** (LO4AA24) предпочтительно применять в качестве ГИБП первого выбора для лечения серопозитивного полиартрита.
Дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
#Абатацепт** (LO4AA24) детям младше 6 лет назначается по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей [348].
- Рекомендуется переключение на #ритуксимаб** (L01XC) в комбинации с метотрексатом** (L01BA) или с #лефлуномидом** (L04FFAA) при неэффективности ингибиторов ФНО-альфа (L04AB), тоцилизумаба** (L04AC), абатацепта** (LO4AA24), тофацитиниба** (L04AA), #упадацитиниба** (L04AA), барицитиниба** (L04AA) в сочетании с метотрексатом** (L01BA) или с #лефлуномидом** (L04FFAA), или в качестве монотерапии с целью индукции ремиссии заболевания [417 - 420]. (для схем с применением #ритуксимаба** в сочетании с метотрексатом** - (УДД 3, УРР B); в сочетании с #лефлуномидом** - (УДД 5, УРР C).
Комментарии: критерии неэффективности: недостижение 50% улучшения по критериям АКРпеди через 3 мес., стадии неактивной болезни по критериям через 6 мес, ремиссии через 12 мес. По критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется переключение на #ритуксимаб** (L01XC) при непереносимости ингибиторов ФНО-альфа (L04AB), тоцилизумаба** (L04AC), абатацепта** (LO4AA24), тофацитиниба** (L04AA), #упадацитиниба** (L04AA), или барицитиниба** (L04AA) на любом этапе лечения с целью поддержания/индукции ремиссии заболевания [418 - 420]. (УДД 4, УУР C)
Комментарии: #ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение #ритуксимаба** (L01XC) в дозе 375 мг/м2 поверхности тела внутривенно 1 раз в нед. в течение 4 последовательных нед. с целью поддержания/индукции ремиссии заболевания [417 - 419]. (УДД 4, УУР C)
Комментарии: при серопозитивном полиартрите #ритуксимаб** (L01XC) может быть ГИБП первого выбора при неэффективности метотрексата** (L01BA) или #лефлуномида** (L04FFAA), а также ГИБП второго выбора при неэффективности/непереносимости #абатацепта** (LO4AA24).
Дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
Курсы лечения #ритуксимабом** (L01XC) (4 инфузии в течение 4-х последовательных нед.) проводятся 1 раз в 22 - 24 нед. при сохраняющейся активности заболевания с учетом инфекционных и неинфекционных осложнений. Если после 3-го курса лечения #ритуксимабом** (L01XC) не достигнута стадия неактивной болезни/ремиссия, лечение ритуксимабом рекомендуется прекратить.
#Ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение #ритуксимаба** (L01XC) в комбинации с #ко-тримоксазолом** (J01EE) в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно с целью профилактики пневмоцистной пневмонии в соответствии с международными рекомендациями [303, 3, 32, 276]. (УДД 5, УУР C)
- Рекомендуется отмена ГИБП, тофацитиниба** (L04AA), #упадацитиниба** (L04AA), барицитиниба** (L04AA) при их непереносимости и назначение глюкокортикоидов (H02AB) для перорального приема в дозе 0,25 - 0,5 мг/кг/сут в комбинации с метотрексатом** (L01BA) или #лефлуномидом** (L04FFAA) на любом этапе лечения с целью индукции ремиссии заболевания [1, 3, 42, 348, 356, 401, 421]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
- Рекомендуется дополнительное назначение ГК (H02AB): преднизолона** (H02AB) для перорального приема в дозе 0,25 - 0,5 мг/кг в сут. или метилпреднизолона** (H02AB) в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** (L01BA) или #лефлуномида** (L04FFAA) в комбинации с ГИБП или тофацитинибом** (L04AA), или #упадацитинибом** (L04AA), или барицитинибом** (L04AA) при нарастании активности болезни на любом этапе лечения с целью индукции ремиссии заболевания [1, 3, 42, 348, 356, 421, 401, 422, 614 - 617]. (УДД 5, УУР C)
Комментарии: критерии неэффективности: недостижение 50% улучшения по критериям АКРпеди через 3 мес., стадии неактивной болезни по критериям через 6 мес, ремиссии через 12 мес. По критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
Дозы и порядок назначения метотрексата** (L01BA) и #лефлуномида** (L04FFAA) см. выше.
- Рекомендуется проведение коррекции терапии (переключение препаратов) всем пациентам до достижения эффективности [347, 423]. (УДД 4, УУР C)
Комментарии: основная цель лечения ЮА - достижение стадии неактивной болезни ремиссии; корректирование терапии осуществляется до тех пор, пока снижение активности болезни на 50% не будет достигнуто, по крайней мере, через 3 месяца, а цель (неактивная болезнь/ремиссия) - через 6 месяцев лечения вне зависимости от применяемого препарата.
3.1.2 Лечение пауциартикулярного юношеского артрита (олигоартикулярного ювенильного идиопатического артрита, персистирующего)
- Рекомендуется назначение монотерапии НПВП (M01A) длительностью не более 1 мес. на этапе обследования пациентам с неустановленным диагнозом ЮА с целью достижения противовоспалительного эффекта [1, 3, 42, 348 - 357]. (УДД 5, УУР C)
- Рекомендуется проведение контроля эффективности любого лекарственного препарата, применяемого для патогенетической терапии через 3 и 6, далее каждые 6 месяцев терапии (препарат эффективен при достижении 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace) [1, 3, 32, 346, 347]. (УДД 5, УУР C)
- Рекомендуется коррекция терапии (переключение препаратов) до достижения эффективности или минимальной/низкой активности болезни у пациентов с длительно текущим заболеванием вне зависимости от применяемого препарата [1, 3, 32, 346, 347]. (УДД 5, УУР C)
- Рекомендуется назначение НПВП (M01A) с целью купирования лихорадки и болевого синдрома у пациентов с установленным диагнозом ЮА [1, 3, 42, 348 - 357]. (УДД 5, УУР C)
Комментарии: применяются следующие режимы назначения НПВП:
- диклофенак** (M01AB) в соответствии с инструкцией по применению препарата или
- нимесулид (M01AX) в соответствии с инструкцией по применению препарата или
- мелоксикам (M01AC) в соответствии с инструкцией по применению препарата, или
- ибупрофен** (M01AE01) в соответствии с инструкцией по применению препарата с целью достижения противовоспалительного, обезболивающего и жаропонижающего эффекта [3, 32, 355, 357 - 364].
Диклофенак** (M01AB) применяется у детей с 6 лет в таблетках и суппозиториях, в виде в/м инъекций (разрешен с 18 лет).
Нимесулид (M01AX) применяется у детей с 2-х лет в суспензии, старше 12 лет - в таблетках.
Мелоксикам (M01AC) применяется у детей с 2-х лет в суспензии, старше 15 лет в таблетках, в виде в/м инъекции разрешен с 18 лет.
Ибупрофен** (M01AE01) применяется у детей старше 3 мес. в суспензии, старше 6 лет в таблетках, интервалы между приемами препарата 6 - 8 ч.
#Диклофенак** (M01AB), #нимесулид (M01AX), #мелоксикам (M01AC) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Не рекомендуется проведение монотерапии НПВП (M01A) длительностью более 2 мес. с целью минимизации побочных эффектов длительного приема НПВП [1, 3, 32, 424 - 426]. (УДД 5, УУР C)
- Не рекомендуется назначение глюкокортикоидов (H02AB) перорально и/или внутривенно, и/или внутрисуставно, и/или метотрексата** (L01BA), и/или ГИБП (#адалимумаба** (L04AB) или #этанерцепта** (L04AB), или #голимумаба** (L04AB), или тоцилизумаба** (L04AC), или абатацепта** (LO4AA24), или #ритуксимаба** (L01XC)), и/или тофацитиниба** (L04AA), или #упадацитиниба** (L04AA), или барицитиниба** (L04AA) до завершения полного лабораторно-инструментального обследования, исключения онкологических, онко-гематологических, инфекционных заболеваний и установления диагноза ЮА (см. разделы 2, 3) [1, 3, 42, 348]. (УДД 5, УУР C)
Комментарии: применение ГК (H02AB), метотрексата** (L01BA), ГИБП (#адалимумаба** (L04AB) или #этанерцепта** (L04AB), или #голимумаба** (L04AB), или тоцилизумаба** (L04AC), или абатацепта** (LO4AA24), или #ритуксимаба** (L01XC)), и/или #тофацитиниба** (L04AA), или #упадацитиниба** (L04AA), или барицитиниба** (L04AA) при онкологических и онко-гематологических заболеваниях, протекающих под маской ЮА, значительно затруднит в дальнейшем верификацию диагноза, так как они обладают выраженным иммуносупрессивным эффектом, нивелируют клиническую и морфологическую картину злокачественных новообразований.
- Рекомендуется внутрисуставное введение:
- бетаметазона** (H02AB) детям старше 3-х лет в соответствии с инструкцией по применению или
- #триамцинолона (H02AB) детям старше 12 лет в дозе 1 - 2 мг/кг (максимальная доза 80 мг) при введении в коленные суставы, 0,5 - 1 мг/кг (максимальная доза 40 мг) - в голеностопные, локтевые суставы и 0,3 - 0,5 мг/кг (максимальная доза 40 мг) - в лучезапястные суставы, мелкие суставы кистей и стоп [365 - 368]
- пациентам с активным моно- или олигоартритом не чаще 1 раза в 4 мес. с целью быстрого купирования воспалительного процесса в суставах [1, 3, 32, 86, 348, 365 - 370]. (УДД 5, УУР C)
Комментарии: при частом обострении артрита (чаще, чем 1 раз в 4 мес.) внутрисуставное введение ГК не проводится. Показания к внутрисуставному введению ГК - выраженные экссудативные изменения и болевой синдром в пораженных суставах.
#Бетаметазон** (H02AB) и #триамцинолон вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей в старше 15 лет.
- Рекомендуется назначение метотрексата** (L01BA) в дозе 10 - 15 мг/м2/нед. 1 раз в нед. перорально или подкожно пациентам с активным олигоартритом сразу после верификации диагноза при высокой активности болезни вне зависимости от наличия факторов неблагоприятного прогноза с целью индукции ремиссии заболевания [1, 3, 42, 348, 376 - 381, 427]. (УДД 5, УУР C)
- Рекомендуется назначение метотрексата** (L01BA) в дозе 10 - 15 мг/м2/нед. 1 раз в нед. перорально или подкожно пациентам с активным олигоартритом сразу после верификации диагноза при средней активности болезни, при наличии факторов неблагоприятного прогноза с целью индукции ремиссии заболевания [1, 3, 42, 348, 376 - 381, 427]. (УДД 5, УУР C)
- Рекомендуется назначение метотрексата** (L01BA) в дозе 10 - 15 мг/м2/нед. 1 раз в неделю перорально или подкожно пациентам с активным олигоартритом в случае неэффективности лечения НПВП в течение 1 - 2 мес. и внутрисуставного введения ГК (необходимость инъекций чаще, чем 1 раз в 4 мес.), при низкой активности болезни и наличии факторов неблагоприятного прогноза или при средней активности болезни и отсутствии факторов неблагоприятного прогноза с целью индукции ремиссии заболевания [1, 3, 42, 348, 376 - 381, 427]. (УДД 5, УУР C)
- Не рекомендуется увеличение дозы метотрексата** (L01BA) > 15 мг/м2/нед. (не более 25 мг/нед) пациентам с активным артритом с целью профилактики развития токсических реакций [1, 3, 42, 348, 376 - 381, 427, 428]. (УДД 2, УУР B)
Комментарии: повышение дозы метотрексата** (L01BA) не ассоциировано с дополнительными терапевтическими преимуществами.
- Рекомендуется подкожное введение метотрексата** (L01BA) пациентам с активным артритом с целью обеспечения стабильной биодоступности препарата [1, 3, 42, 348, 376 - 381, 427, 428]. (УДД 2, УУР B)
Комментарии: подкожный способ введения метотрексата** (L01BA) является предпочтительным, так как обеспечивает стабильную биодоступность.
При непереносимости метотрексата для подкожного введения назначается метотрексат в таблетках для перорального приема.
Контроль эффективности терапии - см. Приложения Г1 - Г4
- Рекомендуется назначение #фолиевой кислоты** (B03BB) в дозе 1 мг каждый день, кроме дня приема метотрексата или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема метотрексата** (L01BA) с целью предотвращения побочных эффектов его применения [3, 32, 358, 377, 381 - 384]. (УДД 5, УУР C)
Комментарии: #фолиевая кислота** (B03BB) вне возрастных показаний назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется переключение на ГИБП или селективный иммунодепрессант при непереносимости метотрексата** (L01BA) с целью индукции/поддержания ремиссии [1, 42, 348, 390, 392, 393, 403, 415, 430 - 433]. (УДД 5, УУР C)
- Рекомендуется переключение на один из следующих препаратов:
- ингибиторы ФНО альфа (L04AB) [45, 348, 390, 403] (УДД 5, УУР C)
- #тоцилизумаб** (L04AC) [372, 431, 432] (УДД 5, УУР C)
- #тофацитиниб** (L04AA) [392, 415, 430] (УДД 5, УУР C)
- #упадацитиниб** (L04AA) [395 - 402] (УДД 5, УУР C)
- барицитиниб** (L04AA) [614, 615] (УДД 2, УУР B)
- #абатацепт** (LO4AA24) [42, 45, 372, 433] (УДД 5, УУР C)
при непереносимости метотрексата** (L01BA) с целью индукции/поддержания ремиссии заболевания.
Комментарий: аналогично проводится переключение с одного из указанных препаратов на другой на любом этапе лечения при их непереносимости. Режимы дозирования - см. ниже.
Контроль эффективности терапии - см. Приложение Г1 - Г4
- Рекомендуется назначение ГИБП или селективного иммунодепрессанта в комбинации с метотрексатом** при его неэффективности, или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни с целью индукции ремиссии [1, 42, 348, 390, 392, 393, 403, 415, 430 - 433]. (УДД 5, УУР C)
- Рекомендуется назначение одного из следующих препаратов:
- ингибиторы ФНО альфа (L04AB) [45, 348, 390, 403] (УДД 5, УУР C)
- #тоцилизумаб** (L04AC) [372, 431, 432] (УДД 5, УУР C)
- #тофацитиниб** (L04AA) [372, 392, 415, 430] (УДД 5, УУР C)
- #упадацитиниб** (L04AA) [395 - 402] (УДД 5, УУР C)
- барицитиниб** (L04AA) [614, 615] (УДД 2, УУР B)
- #абатацепт** (LO4AA24) [42, 45, 372, 433] (УДД 5, УУР C)
в комбинации с метотрексатом** (L01BA) при его неэффективности с целью индукции ремиссии.
Комментарии: критериями неэффективности являются недостижение 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
Аналогично проводится переключение на один из указанных выше препаратов в сочетании с метотрексатом** или в качестве монотерапии при неэффективности используемой комбинации препаратов.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение одного из следующих препаратов:
- #адалимумаба** (L04AB) безцитратной формы (40 мг/0,4 мл) подкожно 1 раз в 2 нед. пациентам с массой тела 10 - 30 кг - 20 мг, с массой тела; > 30 кг - 40 мг [42, 348, 372, 389, 403 - 407]. (УДД 5, УУР C)
- #этанерцепта** (L04AB) в дозе 0,4 мг/кг/введение 2 раза в нед. или 0,8 мг/кг/введение 1 раз в нед. [403, 390, 348, 42, 372, 405, 407, 434]. (УДД 5, УУР C)
- #голимумаба** (L04AB) в дозе 30 мг/м2 подкожно (максимальная доза 50 мг) 1 раз в 4 нед. [388, 403, 348, 42, 372, 405, 407]. (УДД 5, УУР C)
в комбинации с метотрексатом** (L01BA) или в качестве монотерапии с целью индукции ремиссии заболевания.
Комментарии: при неэффективности метотрексата** (L01BA) в качестве ГИБП первого выбора предпочтительно применять ингибиторы ФНО-альфа.
Моноклональные антитела к ФНО-альфа (#адалимумаб**, #голимумаб**) (L04AB) предпочтительно назначать в сочетании с метотрексатом** (L01BA) для снижения риска формирования нейтрализующих антител.
Дозы и порядок назначения метотрексата** (L01BA) см. выше.
#Адалимумаб** (L04AB) вне возрастных показаний назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей [348]. Для лечения пациентов с ЮА целесообразно применять лекарственный препарат адалимумаб безцитратную форму 40 мг/0,4 мл с целью избежания причинения детям необоснованной боли, которая развивается при применении лекарственного препарата адалимумаб цитратной формы 40 мг/0,8 мл [404 - 407, 413].
Учитывая выраженный болевой синдром при применении лекарственного препарата #адалимумаб** цитратной формы 40 мг/0,8 мл применение данной формы препарата у пациентов детского возраста является невозможным [404 - 407, 413].
#Этанерцепт** (L04AB) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [348].
Показание к применению у детей и подростков с юношеским артритом в возрасте от 2 до 17 лет и с массой тела менее 62,5 кг имеет только лекарственный препарат #этанерцепт** "лиофилизат для приготовления раствора для подкожного введения". Лекарственный препарат #этанерцепт** "раствор для подкожного введения" имеет противопоказание к применению - детский возраст младше 12 лет и с массой тела менее 62,5 кг. [408 - 411]
Согласно письму разъяснению ФАС N ТН/109573/21 от 22.12.2021 и медицинским инструкциям по применению лекарственного препарата #Этанерцепт** [412]:
использование лекарственной формы "раствор для подкожного введения" вместо "лиофилизат для приготовления раствора для подкожного введения" у детей младше 12 лет и массой тела менее 62,5 кг не признается приемлемым в связи с различиями в конечной концентрации растворов и отсутствии исследований, позволяющих оценить переносимость, эффективность и фармакокинетику применения у детей раствора в дозировке 50 мг/мл. Таким образом, замена лекарственной формы "лиофилизат для приготовления раствора для подкожного введения" у данного пациента является невозможной.
#Голимумаб** (L04AB) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [348].
- Рекомендуется назначение #тоцилизумаба** (L04AC)
- детям с массой тела < 30 кг - в дозе 10 мг/кг/введение, детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно, внутривенно 1 раз в 4 нед. или
- детям с массой тела < 30 кг в дозе 162 мг подкожно 1 раз в 3 нед., детям с массой тела >= 30 кг - в дозе 162 мг подкожно 1 раз в 2 нед.
в комбинации с метотрексатом** (L01BA) или в качестве монотерапии с целью индукции ремиссии заболевания [42, 372, 391, 431, 432, 435]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения метотрексата** (L01BA) см. выше
#Тоцилизумаб** (L04AC) назначается по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [348].
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение одного из следующих препаратов:
- #тофацитиниба** (L04AA) перорально в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) [372, 392, 397, 399, 401, 405, 415] (УДД 5, УУР C) или
- #упадацитиниба** (L04AA) перорально пациентам >= 12 лет и массой тела >= 40 кг - 15 мг 1 раз в сут. с целью индукции ремиссии заболевания [372, 395, 397 - 402]. (УДД 5, УУР C)
- барицитиниба** (L04AA) перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. [614, 615] (УДД 2, УУР B)
в комбинации с метотрексатом** или в качестве монотерапии с целью индукции ремиссии заболевания [372, 392, 395, 397 - 401, 405, 415].
Комментарии: дозы и порядок назначения метотрексата** (L01BA) см. выше.
#Тофацитиниб** (L04AA) и #упадацитиниб** (L04AA) назначаются по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [395 - 402, 415].
#Барицитиниб** (L04AA) назначается по жизненным показаниям детям возрасте <= 2 лет, по решению врачебной комиссии, после получения информированного согласия родителей [614, 615].
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение #абатацепта** (LO4AA24) внутривенно в дозе 10 мг/кг/ведение по схеме 0, 2, 4-я нед, далее каждые 4 нед. в комбинации с метотрексатом** (L01BA) или в качестве монотерапии с целью индукции ремиссии заболевания [42, 45, 372, 433]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения метотрексата** (L01BA) см. выше.
#Абатацепт** (LO4AA24) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [348].
- Рекомендуется переключение на #ритуксимаб** (L01XC) в комбинации с метотрексатом** (L01BA) при неэффективности ингибиторов ФНО-альфа (L04AB), #тоцилизумаба** (L04AC), #абатацепта** (LO4AA24), #тофацитиниба** (L04AA), #упадацитиниба** (L04AA), барицитиниба** (L04AA) в сочетании с метотрексатом** (L01BA) или в качестве монотерапии с целью индукции ремиссии заболевания [1, 3, 32, 417 - 420]. (УДД 4, УУР C)
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется переключение на #ритуксимаб** (L01XC) при непереносимости ингибиторов ФНО-альфа (L04AB), #тоцилизумаба** (L04AC), #абатацепта** (LO4AA24), #тофацитиниба** (L04AA) (L04FFAA), #упадацитиниба** (L04AA) или барицитиниба** (L04AA) на любом этапе лечения с целью поддержания/индукции ремиссии заболевания [1, 3, 32, 417 - 420]. (УДД 4, УУР C)
Комментарии: #ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение #ритуксимаба** (L01XC) в дозе 375 мг/м2 поверхности тела внутривенно 1 раз в нед. в течение 4-х последовательных нед. с целью поддержания/индукции ремиссии заболевания [1, 3, 32, 417 - 420]. (УДД 4, УУР C)
Комментарии: дозы и порядок назначения метотрексата** (L01BA) см. выше.
Курсы лечения #ритуксимабом** (L01XC) (4 инфузии в течение 4-х последовательных недель) проводятся 1 раз в 22 - 24 недели при сохраняющейся активности заболевания с учетом инфекционных и неинфекционных осложнений. Если после 3-го курса лечения #ритуксимабом** (L01XC) не достигнута стадия неактивной болезни/ремиссия, лечение #ритуксимабом рекомендуется прекратить.
#Ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение #ритуксимаба** (L01XC) в комбинации с #ко-тримоксазолом** (J01EE) в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно с целью профилактики пневмоцистной пневмонии в соответствии с международными рекомендациями [303, 3, 32, 276]. (УДД 5, УУР C)
- Рекомендуется отмена ГИБП, #тофацитиниба** (L04AA) или #упадацитиниба** (L04AA), или барицитиниба** (L04AA) при их непереносимости и назначение глюкокортикоидов (H02AB) для перорального приема в дозе 0,25 - 0,5 мг/кг/сут. с в комбинации с метотрексатом** (L01BA) на любом этапе лечения с целью индукции ремиссии заболевания [1, 3, 42, 348, 356, 401, 421]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения метотрексата** см. выше.
- Рекомендуется дополнительное назначение ГК (H02AB): преднизолона** (H02AB) для перорального приема в дозе 0,25 - 0,5 мг/кг в сут. или метилпреднизолона** (H02AB) в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** (L01BA) в комбинации с ГИБП, #тофацитинибом** (L04AA), #упадацитинибом** (L04AA), барицитинибом** (L04AA) или при нарастании активности болезни на любом этапе лечения с целью индукции ремиссии заболевания [1, 3, 42, 348, 356, 401, 421, 614 - 617]. (УДД 5, УУР C)
Комментарии: критерии неэффективности: недостижение 50% улучшения по критериям АКРпеди через 3 мес., стадии неактивной болезни по критериям через 6 мес, ремиссии через 12 мес. По критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
- Рекомендуется проведение коррекции терапии (переключение препаратов) у всех пациентов до достижения эффективности [347, 423].
Комментарии: основная цель лечения ЮА - достижение стадии неактивной болезни ремиссии; корректирование терапии осуществляется до тех пор, пока снижение активности болезни на 50% не будет достигнуто, по крайней мере, через 3 месяца, а цель (неактивная болезнь/ремиссия) - через 6 месяцев лечения вне зависимости от применяемого препарата.
3.1.3 Лечение юношеского анкилозирующего спондилита
- Рекомендуется проведение контроля эффективности любого лекарственного препарата, применяемого для патогенетической терапии через 3 и 6, далее каждые 6 месяцев терапии (препарат эффективен при достижении 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace) [1, 3, 32, 346, 347]. (УДД 5, УУР C)
- Рекомендуется коррекция терапии (переключение препаратов) до достижения эффективности или минимальной/низкой активности болезни у пациентов с длительно текущим заболеванием вне зависимости от применяемого препарата [1, 3, 32, 346, 347]. (УДД 5, УУР C)
- Рекомендуется назначение монотерапии НПВП (M01A) длительностью не более 1 мес. на этапе обследования пациентам с неустановленным диагнозом ЮАС с целью достижения противовоспалительного эффекта [1, 3, 42, 348 - 357]. (УДД 5, УУР C)
- Рекомендуется назначение НПВП (M01A) с целью купирования лихорадки и болевого синдрома у пациентов с установленным диагнозом ЮАС [1, 3, 42, 348 - 357]. (УДД 5, УУР C)
Комментарии: применяются следующие режимы назначения НПВП:
- диклофенак** (M01AB) в соответствии с инструкцией по применению препарата или
- нимесулид (M01AX) в соответствии с инструкцией по применению препарата или
- мелоксикам (M01AC) в соответствии с инструкцией по применению препарата, или
- ибупрофен** (M01AE01) в соответствии с инструкцией по применению препарата с целью достижения противовоспалительного, обезболивающего и жаропонижающего эффекта [3, 32, 355, 357 - 364].
Диклофенак** (M01AB) применяется у детей с 6 лет в таблетках и суппозиториях, в виде в/м инъекций (разрешен с 18 лет).
Нимесулид (M01AX) применяется у детей с 2-х лет в суспензии, старше 12 лет - в таблетках.
Мелоксикам (M01AC) применяется у детей с 2-х лет в суспензии, старше 15 лет в таблетках, в виде в/м инъекции разрешен с 18 лет.
Ибупрофен** (M01AE01) применяется у детей старше 3 мес. в суспензии, старше 6 лет в таблетках, интервалы между приемами препарата 6 - 8 ч.
#Диклофенак** (M01AB), #нимесулид (M01AX), #мелоксикам (M01AC) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Не рекомендуется проведение монотерапии НПВП (M01A) длительностью более 1 мес. с целью минимизации побочных эффектов длительного приема НПВП [1, 3, 32]. (УДД 5, УУР C)
- Не рекомендуется назначение глюкокортикоидов (H02AB) перорально и/или внутривенно, и/или внутрисуставно, и/или иммунодепрессантов (метотрексата** (L01BA) или #сульфасалазина** (A07EC01)), и/или ГИБП (ингибиторов ФНО-альфа (L04AB), или #тоцилизумаба** (L04AC), или секукинумаба** (L04AC10)) и/или #тофацитиниба** (L04AA), или #упадацитиниба** (L04AA), или барицитиниба** (L04AA) до завершения полного лабораторно-инструментального обследования, исключения онкологических, онко-гематологических, инфекционных заболеваний и установления диагноза ЮА (см. разделы 2, 3) [1, 3, 42, 348]. (УДД 5, УУР C)
Комментарии: применение ГК, иммунодепрессантов (#метотрексата** (L01BA) или #сульфасалазина** (A07EC01), ГИБП (#адалимумаба** (L04AB) или #этанерцепта** (L04AB), или #голимумаба** (L04AB), или секукинумаба** (L04AC10), или #тоцилизумаба** (L04AC), и/или #тофацитиниба** (L04AA), #упадацитиниба** (L04AA), барицитиниба** (L04AA) при онкологических и онко-гематологических заболеваниях, протекающих под маской ЮА, значительно затруднит в дальнейшем верификацию диагноза, так как они обладают выраженным иммуносупрессивным эффектом, нивелируют клиническую и морфологическую картину злокачественных новообразований.
- Рекомендуется внутрисуставное введение:
- бетаметазона** (H02AB) детям старше 3-х лет в соответствии с инструкцией по применению или
- #триамцинолона (H02AB) детям старше 12 лет в дозе 1 - 2 мг/кг (максимальная доза 80 мг) при введении в коленные суставы, 0,5 - 1 мг/кг (максимальная доза 40 мг) - в голеностопные, локтевые суставы и 0,3 - 0,5 мг/кг (максимальная доза 40 мг) - в лучезапястные суставы, мелкие суставы кистей и стоп [365 - 368]
- пациентам с активным моно- или олигоартритом не чаще 1 раза в 4 мес. с целью быстрого купирования воспалительного процесса в суставах [1, 3, 32, 86, 348, 365 - 370]. (УДД 5, УУР C)
Комментарии: при частом обострении артрита (чаще, чем 1 раз в 4 мес.) внутрисуставное введение ГК не проводится. Показания к внутрисуставному введению ГК - выраженные экссудативные изменения и болевой синдром в пораженных суставах.
#Бетаметазон** (H02AB) и #триамцинолон вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей в старше 15 лет.
- Рекомендуется назначение одного из следующих из следующих препаратов:
- сульфасалазина** (A07EC01) в дозе 30 - 50 мг/кг/сут. перорально [1, 3, 32, 437 - 441]. (УДД 5, УУР C) или
- метотрексата** (L01BA) в дозе 10 - 15 мг/м2/нед. 1 раз в нед. подкожно или перорально [1, 3, 42, 348, 376 - 381, 427, 428, 441]. (УДД 2, УУР B)
пациентам с периферическим артритом сразу после верификации диагноза с целью индукции ремиссии заболевания [1, 3, 42, 348, 376 - 381, 427, 428, 437 - 441]
Комментарии: рекомендуется применение при неэффективности НПВП, после первой внутрисуставной инъекции ГК, при средней или высокой активности болезни вне зависимости от наличия факторов неблагоприятного прогноза.
Вне возрастных показаний #метотрексат** (L01BA) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Вне возрастных показаний #сульфасалазин** (A07EC01) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Не рекомендуется пациентам с активным артритом увеличение дозы метотрексата** (L01BA) > 15 мг/м2/нед. (не более 25 мг/нед.) с целью предотвращения развития токсических реакций [1, 3, 42, 348, 376 - 381, 427, 428, 441]. (УДД 2, УУР B)
Комментарии: повышение дозы метотрексата** (L01BA) не ассоциировано с дополнительными терапевтическими преимуществами.
- Рекомендуется подкожное введение метотрексата** (L01BA) пациентам с активным артритом [1, 3, 42, 348, 376 - 381, 427, 428, 441]. (УДД 2, УУР B)
Комментарии: подкожный способ введения метотрексата** (L01BA) является предпочтительным из-за более высокой биодоступности.
При непереносимости метотрексата** (L01BA) для подкожного введения назначается метотрексат** (L01BA) в таблетках для перорального приема.
Вне возрастных показаний #метотрексат** (L01BA) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
- Рекомендуется назначение #фолиевой кислоты** (B03BB) в дозе 1 мг каждый день, кроме дня приема метотрексата или 2,5 - 7,5 мг 1 раз в неделю перорально в период приема метотрексата** (L01BA) с целью предотвращения побочных эффектов его применения [3, 32, 358, 377, 381 - 384]. (УДД 5, УУР C)
Комментарии: #фолиевая кислота** (B03BB) вне возрастных показаний назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется при непереносимости сульфасалазина** (A07EC01) или метотрексата** (L01BA) переключение на один из следующих препаратов с целью индукции/поддержания ремиссии:
- ингибиторы ФНО-альфа (L04AB) [25, 442 - 451] (УДД 2, УУР B)
- секукинумаб** (L04AC10) [452 - 454] (УДД 2, УУР B)
- #тофацитиниб** (L04AA) [392, 455] (УДД 5, УУР C)
- #упадацитиниб** (L04AA) [402, 456] (УДД 5, УУР C)
- барицитиниб** (L04AA) [614, 615] (УДД 2, УУР B)
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение ГИБП или селективного иммунодепрессанта в комбинации с сульфасалазином** (A07EC01) при его неэффективности или #метотрексатом** (L01BA) при его неэффективности, или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни с целью индукции ремиссии [1, 3, 42, 348, 376 - 381, 427, 428, 437, 441]. (УДД 5, УУР C)
- Рекомендуется назначение одного из следующих препаратов:
- ингибиторы ФНО-альфа (L04AB) [25, 442 - 451] (УДД 2, УУР B)
- секукинумаб** (L04AC10) [452 - 454] (УДД 2, УУР B)
- #тофацитиниб** (L04AA) [392, 455] (УДД 5, УУР C)
- #упадацитиниб** (L04AA) [402, 456] (УДД 5, УУР C)
- барицитиниб** (L04AA) [614, 615] (УДД 2, УУР B)
в комбинации с сульфасалазином** (A07EC01) или #метотрексатом** (L01BA), или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни с целью индукции ремиссии.
Комментарии: критериями неэффективности являются недостижение 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
Аналогично проводится переключение на один из указанных выше препаратов в сочетании с сульфасалазином** (A07EC01) или метотрексатом** (L01BA), или в качестве монотерапии при неэффективности используемой комбинации препаратов.
Контроль эффективности терапии - см. Приложения Г1 - Г4. Режимы дозирования - см. ниже.
- Рекомендуется назначение одного из следующих препаратов:
- #адалимумаба** (L04AB) безцитратной формы (40 мг/0,4 мл) подкожно 1 раз в 2 нед. с массой тела 10 - 30 кг - 20 мг, с массой тела; > 30 кг - 40 мг [42, 348, 372, 388 - 390, 403 - 407, 434, 449]. (УДД 2, УУР B)
- #этанерцепта** (L04AB) в дозе 0,4 мг/кг/введение 2 раза в нед. или 0,8 мг/кг/введение 1 раз в нед. [442, 443, 445, 450]. (УДД 2, УУР B)
- #голимумаба** (L04AB) в дозе 30 мг/м2 (максимальная доза 50 мг) подкожно 1 раз в 4 нед. [42, 348, 372, 388, 390, 403, 405, 451]. (УДД 5, УУР C)
в комбинации с сульфасалазином** (A07EC01) или #метотрексатом** (L01BA), или в качестве монотерапии с целью индукции ремиссии заболевания.
Комментарии: при неэффективности сульфасалазина** (A07EC01) или #метотрексата** (L01BA) в качестве ГИБП первого выбора предпочтительно применять ингибиторы ФНО-альфа.
Моноклональные антитела к ФНО-альфа (#адалимумаб**, #голимумаб**) (L04AB) предпочтительно назначать в сочетании сульфасалазином** (A07EC01) или метотрексатом** (L01BA) для снижения риска формирования нейтрализующих антител.
Дозы и порядок назначения сульфасалазина** (A07EC01) или #метотрексата** см. выше.
Для лечения пациентов с ЮА целесообразно применять лекарственный препарат #адалимумаб** безцитратную форму 40 мг/0,4 мл с целью избежания причинения детям необоснованной боли, которая развивается при применении лекарственного препарата #адалимумаб** цитратной формы 40 мг/0,8 мл [404 - 407, 413].
Учитывая выраженный болевой синдром при применении лекарственного препарата #адалимумаб** цитратной формы 40 мг/0,8 мл применение данной формы препарата у пациентов детского возраста является невозможным [404 - 407, 413].
#Этанерцепт** (L04AB) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [348].
Показание к применению у детей и подростков с юношеским артритом в возрасте от 2 до 17 лет и с массой тела менее 62,5 кг имеет только лекарственный препарат #этанерцепт** "лиофилизат для приготовления раствора для подкожного введения". Лекарственный препарат #этанерцепт** "раствор для подкожного введения" имеет противопоказание к применению - детский возраст младше 12 лет и с массой тела менее 62,5 кг. [408 - 411]
Согласно письму разъяснению ФАС N ТН/109573/21 от 22.12.2021 и медицинским инструкциям по применению лекарственного препарата #Этанерцепт** [412]:
использование лекарственной формы "раствор для подкожного введения" вместо "лиофилизат для приготовления раствора для подкожного введения" у детей младше 12 лет и массой тела менее 62,5 кг не признается приемлемым в связи с различиями в конечной концентрации растворов и отсутствии исследований, позволяющих оценить переносимость, эффективность и фармакокинетику применения у детей раствора в дозировке 50 мг/мл. Таким образом, замена лекарственной формы "лиофилизат для приготовления раствора для подкожного введения" у данного пациента является невозможной.
#Голимумаб** (L04AB) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [348].
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение секукинумаба** (L04AC10) детям с массой тела > 50 кг - в дозе 75 мг, >= 50 кг - в дозе 150 мг на 0, 1, 2 и 3 нед. с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4 недели подкожно в комбинации с сульфасалазином** (A07EC01) или метотрексатом** (L01BA), или в качестве монотерапии с целью индукции ремиссии заболевания [1, 3, 32, 452 - 454]. (УДД 2, УУР B)
Комментарии: дозы и порядок назначения сульфасалазина** (A07EC01) или метотрексата** (L01BA) см. выше.
Секукинумаб** (L04AC10) назначается по жизненным показаниям детям младше 6 лет подкожно по решению врачебной комиссии, после получения информированного согласия родителей.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение одного из следующих препаратов:
- #тофацитиниба** (L04AA) перорально в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) [1, 3, 32, 372, 392, 397, 399, 401, 405, 415, 455] (УДД 2, УУР B)
- #упадацитиниба** (L04AA) перорально пациентам >= 12 лет и массой тела >= 40 кг - 15 мг 1 раз в сут. [1, 3, 32, 372, 395, 397 - 402]. (УДД 4, УУР C)
- барицитиниба** (L04AA) перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. [614, 615] (УДД 2, УУР B)
в комбинации с сульфасалазином** (A07EC01) или #метотрексатом** (L01BA), или в качестве монотерапии с целью индукции ремиссии заболевания [372, 392, 395, 397 - 401, 405, 415].
Комментарии: дозы и порядок назначения #метотрексата** и сульфасалазина (L01BA) см. выше.
#Тофацитиниб** (L04AA) и #упадацитиниб** (L04AA) назначаются по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
#Барицитиниб** (L04AA) назначается по жизненным показаниям детям возрасте <= 2 лет, по решению врачебной комиссии, после получения информированного согласия родителей [614, 615].
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется назначение #тоцилизумаба** при неэффективности и/или непереносимости ингибиторов ФНО-альфа, секукинумаба**, #тофацитиниба**, #упадацитиниба**, барицитиниба**
- детям с массой тела < 30 кг - в дозе 10 мг/кг/введение, детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно, внутривенно 1 раз в 4 нед. или
- детям с массой тела < 30 кг в дозе 162 мг подкожно 1 раз в 3 нед., детям с массой тела >= 30 кг - в дозе 162 мг подкожно 1 раз в 2 нед.
в комбинации с сульфасалазином** (A07EC01) или #метотрексатом** (L01BA), или в качестве монотерапии с целью индукции ремиссии заболевания [1, 3, 32, 372, 431, 432, 435]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения метотрексата** (L01BA) см. выше.
#Тоцилизумаб** (L04AC) назначается по жизненным показаниям детям младше 2-х лет внутривенно или детям младше 1 года подкожно по решению врачебной комиссии, после получения информированного согласия родителей.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется отмена ГИБП, #тофацитиниба** (L04AA) или #упадацитиниба** (L04AA), барицитиниба** (L04AA) при их непереносимости и назначение глюкокортикоидов (H02AB) для перорального приема в дозе 0,25 - 1,0 мг/кг/сут в комбинации с сульфасалазином** (A07EC01) или #метотрексатом** на любом этапе лечения с целью индукции ремиссии заболевания [1, 3, 42, 348, 356, 401, 421]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения #метотрексата** (L01BA) и ГК (H02AB) см. ниже.
- Рекомендуется дополнительное назначение ГК (H02AB): преднизолона** (H02AB) для перорального приема в дозе 0,25 - 0,5 мг/кг в сут. или метилпреднизолона** (H02AB) в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** (L01BA), сульфасалазина** (A07EC01) в комбинации с ГИБП, #тофацитинибом** (L04AA), #упадацитинибом** (L04AA), барицитинибом** (L04AA) или при нарастании активности болезни на любом этапе лечения с целью индукции ремиссии заболевания [1, 3, 42, 348, 356, 401, 421]. (УДД 5, УУР C)
Комментарии: критерии неэффективности: недостижение 50% улучшения по критериям АКРпеди через 3 мес., стадии неактивной болезни по критериям через 6 мес, ремиссии через 12 мес. По критериям C. Wallace, или на любом этапе лечения при персистировании/нарастании активности болезни.
- Рекомендуется проведение коррекции терапии (переключение препаратов) у всех пациентов до достижения эффективности [347, 423]. (УДД 5, УУР C)
Комментарии: основная цель лечения ЮА - достижение стадии неактивной болезни ремиссии; корректирование терапии осуществляется до тех пор, пока снижение активности болезни на 50% не будет достигнуто, по крайней мере, через 3 месяца, а цель (неактивная болезнь/ремиссия) - через 6 месяцев лечения вне зависимости от применяемого препарата.
3.1.4 Лечение увеита, ассоциированного с юношеским артритом.
- Рекомендуется назначение местной терапии всем пациентам с увеитом, ассоциированным с юношеским артритом, после приема (осмотра, консультации) врача-офтальмолога с целью индукции ремиссии увеита [17, 332, 333, 356]. (УДД 5, УУР C)
Комментарий: все пациенты с юношеским артритом должны быть осмотрены врачом-офтальмологом для назначения терапии увеита при его выявлении.
- Рекомендуется проводить переключение первично назначенных иммунодепрессанта и/или селективного иммунодепрессанта на дженерик, и/или ГИБП на биоаналог исключительно при доказанной терапевтической эффективности и безопасности дженерика или биоаналога у педиатрической популяции пациентов с аналогичной нозологической формой; не рекомендуется автоматическое переключение с целью сохранения ремиссии заболевания, предотвращения формирования нейтрализующих антител и развития нежелательных явлений [342 - 344]. (УДД 5, УУР C)
Комментарии: в настоящее время зарегистрированы биоаналоги (биосимиляры) ингибиторов фактора некроза опухоли альфа (ФНО-альфа) анти-ФНО, а также дженерики ингибиторов янус-киназ, которые эквивалентны им по строению. Часть из этих препаратов в клинических испытаниях у взрослых пациентов показали схожую с оригинальными препаратами эффективность [345]. Однако в детской популяции с юношеским артритом с увеитом клинические испытания бионалагов и дженериков иммунодепрессантов и селективных иммунодепрессантов не проводились.
Оригинальный иммунодепрессант и/или селективный иммунодепрессант, и/или ГИБП не могут автоматически заменяться на дженерик и биоаналог. Замена препаратов может осуществляться только на основе консенсуса лечащего врача, инициировавшего терапию иммунодепрессантом и/или селективным иммунодепрессантом, и/или ГИБП, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется проведение форсажа #дексаметазоном** (H02AB02) по 1 капле 6 раз в день в комбинации с НПВП-содержащими каплями (диклофенак**) по 1 - 2 капле 4 - 6 раз в день с постепенным снижением дозы (по 1 капле 1 раз в 2 недели) при остром течении увеита с целью индукции ремиссии увеита [17, 32, 332, 333, 356]. (УДД 5, УУР C)
Комментарий: режим назначения, снижения дозы и отмены #дексаметазона** (H02AB02) и НПВП-содержащих капель определяет врач-офтальмолог.
- Рекомендуется проведение инстилляций #дексаметазона** (H02AB02) по 1 капле 2 - 3 раза в день с постепенным снижением дозы (по 1 капле 1 раз в 2 нед) в комбинации с инстилляциями НПВП-содержащих капель: по 1 капле 2 - 3 раза в день с постепенным снижением дозы (по 1 капле 1 раз в 2 нед) при подостром и вялотекущем течении увеита с целью индукции ремиссии увеита [17, 32, 332, 333]. (УДД 5, УУР C)
Комментарий: режим назначения, снижения дозы и отмены #дексаметазона** (H02AB02) и НПВП-содержащих капель определяет врач-офтальмолог.
#Дексаметазон** (L04AC) назначается по жизненным показаниям детям младше 6 лет по решению врачебной комиссии, после получения информированного согласия родителей.
- Рекомендуется назначение парабульбарных инъекций #бетаметазона** (H02AB) по 0,5 мл 1 раз в 10 - 14 дней при остром течении увеита и тяжелом течении панувеита при неэффективности местной терапии с целью индукции ремиссии увеита [17, 32, 332, 333, 356]. (УДД 5, УУР C)
Комментарий: парабульбарные инъекции #бетаметазона** (H02AB) назначаются и проводятся врачом-офтальмологом. Доза, режим назначения, снижения дозы и отмены #бетаметазона** (H02AB) определяет врач-офтальмолог.
#Бетаметазон** (H02AB) вне возрастных показаний назначается по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение #тропикамида** (S01FA06) по 1 - 2 капли 2 раза в день в течение 1 мес. (при необходимости курс может быть продлен до 2 мес.) пациентам с иридо-хрусталиковыми синехиями с целью профилактики прогрессирования деформации хрусталика [15, 32, 356, 457]. (УДД 5, УУР C)
Комментарии: режим назначения #тропикамида** (S01FA06) определяется врачом-офтальмологом.
#Тропикамид** (S01FA06) вне возрастных показаний назначается по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение #таурина** (S01XA) в виде капель по 1 - 2 капли 2 раза в день или #декспантенола** (D03AX03) - в виде глазного геля 1 раз в день под веко на ночь курсами по 2 мес. с перерывами по 2 мес. пациентам с дистрофическими изменениями в глазах с целью уменьшения выраженности дистрофических изменений в глазах [32, 356]. (УДД 5, УУР C)
Комментарии: режим назначения #таурина** (S01XA) и #декспантенола** (D03AX03) определяется врачом-офтальмологом.
#Таурин** (S01XA) и #декспантенол** (D03AX03) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение #метотрексата** (L01BA) в дозе 10 - 15 мг/м2/нед. перорально или подкожно 1 раз в нед. при неэффективности местного лечения увеита (недостижение ремиссии в течение 3 мес.) или при тяжелом течении увеита (независимо от длительности местной терапии) с целью индукции ремиссии увеита, ассоциированного с ЮА [3, 17, 332, 333, 356, 458 - 460]. (УДД 5, УУР C)
Комментарии: подкожный способ введения #метотрексата** (L01BA) является предпочтительным, так как обеспечивает стабильную биодоступность.
При непереносимости #метотрексата** для подкожного введения назначается #метотрексат** для перорального приема.
Контроль эффективности терапии - см. Приложения Г3, Г4
- Не рекомендуется увеличение дозы #метотрексата** (L01BA) > 15 мг/м2/нед. (не более 25 мг/нед.) пациентам с активным увеитом с целью предотвращения развития токсических реакций [17, 332, 333, 356]. (УДД 5, УУР C)
Комментарии: повышение дозы #метотрексата** (L01BA) не ассоциировано с дополнительными терапевтическими преимуществами.
- Рекомендуется назначение #фолиевой кислоты** (B03BB) в дозе 1 мг каждый день кроме дня приема #метотрексата** или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема #метотрексата** (L01BA) с целью предотвращения побочных эффектов применения #метотрексата** (L01BA) [3, 32, 358, 377, 381 - 384]. (УДД 5, УУР C)
Комментарии: #фолиевая кислота** (B03BB) вне возрастных показаний назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется переключение на один из следующих препаратов на любом этапе лечения:
- #циклоспорин** (L04DA01) [461] (УДД 4, УУР C)
- #микофенолата мофетил** (L04AA06) [17, 462, 463] (УДД 4, УУР C)
- ингибиторы ФНО альфа (L04AB) [372, 462 - 465] (УДД 4, УУР C)
- #тоцилизумаб** (L04AC) [463, 466] (УДД 4, УУР C)
- #тофацитиниб** (L04AA) [467 - 469] (УДД 4, УУР C)
- #упадацитиниб** (L04AA) [372, 395, 397 - 402] (УДД 5, УУР C)
- #барицитиниб** (L04AA) [614 - 617] (УДД 5, УУР C)
- #абатацепт** (LO4AA24) [463, 470] (УДД 5, УУР C)
при непереносимости #метотрексата** (L01BA) с целью индукции/поддержания ремиссии увеита.
Комментарии: аналогично проводится переключение с одного из указанных препаратов на другой на любом этапе лечения при их непереносимости. Режимы дозирования - см. ниже.
- Рекомендуется назначение #циклоспорина** (L04DA01) в дозе 3 - 5 мг/кг/сут. перорально в 2 приема в сочетании с местной терапией при неэффективности #метотрексата** (L01BA) пациентам с низкой или средней степенью активности увеита или при нарастании активности увеита на любом этапе лечения в качестве монотерапии или в комбинации с #метотрексатом** (L01BA) с целью индукции ремиссии увеита [17, 332, 333, 461, 463, 473]. (УДД 5, УУР C)
Комментарии: критерий неэффективности - недостижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Циклоспорин** (L04DA01) назначается по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение монотерапии #микофенолата мофетилом** (L04AA06) перорально в дозе 600 мг/м2/сут. в два приема в сочетании с местной терапией при неэффективности #метотрексата** (L01BA) и/или неэффективности #циклоспорина** (L04DA01) в качестве монотерапии или в комбинации с #метотрексатом** (L01BA), или при нарастании активности увеита на любом этапе лечения с целью индукции ремиссии увеита [17, 332, 333, 462, 463, 474]. (УДД 4, УУР C)
Комментарии: критерий неэффективности - недостижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Микофенолата мофетил** (L04AA06) назначается по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение ингибитора ФНО альфа (L04AB) (#адалимумаба** или #голимумаба**) в сочетании с местной терапией при неэффективности #метотрексата** (L01BA) и/или неэффективности #циклоспорина** (L04DA01) в качестве монотерапии или в комбинации с #метотрексатом** (L01BA), или монотерапии #микофенолата мофетилом** (L04AA06), или при нарастании активности увеита на любом этапе лечения с целью индукции ремиссии увеита [372, 462 - 465]. (УДД 4, УУР C)
Комментарии: критерий неэффективности - недостижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом). Режимы дозирования ниже.
- Рекомендуется незамедлительное назначение ингибитора ФНО-альфа (L04AB) в комбинации с #метотрексатом** (L01BA) и/или #циклоспорином** (L04DA01), или #микофенолата мофетилом** (L04AA06) в сочетании с местной терапией на любом этапе лечения при тяжелом течении увеита, панувеите, угрозе развития слепоты, с целью индукции ремиссии увеита [372, 462 - 465]. (УДД 5, УУР C)
- Рекомендуется назначение:
- #адалимумаба** (L04AB) безцитратной формы (40 мг/0,4 мл) пациентам в возрасте >= 2 лет с массой тела 10 - 30 кг - в дозе 20 мг подкожно 1 раз в 2 нед.; > 30 кг - 40 мг подкожно 1 раз в 2 недели [372, 404 - 407, 462 - 465] (УДД 4, УУР C) или
- #голимумаба** (L04AB) в дозе 30 мг/м2 (максимальная доза 50 мг) подкожно 1 раз в 4 нед. с целью индукции ремиссии увеита [372, 404 - 407, 462 - 465]. (УДД 4, УУР C)
в комбинации с #метотрексатом** (L01BA) и/или #циклоспорином** (L04DA01), или #микофенолата мофетилом** (L04AA06) в сочетании с местной терапией с целью индукции ремиссии увеита.
Комментарии: критерий эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
Дозы и порядок назначения #метотрексата** (L01BA), #циклоспорина** (L04DA01), #микофенолата мофетила** (L04AA06) см. выше.
#Адалимумаб** (L04AB) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей детям младше 2-х лет.
Для лечения пациентов с увеитом, ассоциированным с ЮА, целесообразно применять лекарственный препарат #адалимумаб** безцитратную форму 40 мг/0,4 мл с целью избежания причинения детям необоснованной боли, которая развивается при применении лекарственного препарата адалимумаб цитратной формы 40 мг/0,8 мл [404 - 407].
Учитывая выраженный болевой синдром при применении лекарственной формы 40 мг/0,8 мл применение данной формы препарата у пациентов детского возраста является невозможным [404 - 407].
#Голимумаб** (L04AB) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется переключение с ингибитора ФНО-альфа (L04AB) на один из следующих препаратов с новым механизмом действия:
- #тоцилизумаб** (L04AC) [463, 466] (для тоцилизумаба в форме для внутривенного введения - УДД 5, УУР C, в форме для подкожного введения - УДД 4, УУР C)
- #тофацитиниб** (L04AA) [467 - 469] (УДД 4, УУР C)
- #упадацитиниб** (L04AA) [398, 400 - 402, 421, 475] (УДД 4 УУР C)
- #барицитиниб** (L04AA) [614 - 617] (УДД 5, УУР C)
- #абатацепт** (LO4AA24) [463, 470]. (УДД 4, УУР C)
при неэффективности ингибитора ФНО альфа (L04AB) в комбинации с #метотрексатом** (L01BA) и/или #циклоспорином** (L04DA01), или #микофенолата мофетилом** (L04AA06), или при нарастании активности увеита на любом этапе лечения с целью индукции ремиссии увеита.
Комментарии: критерий неэффективности - недостижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
Аналогично проводится переключение с одного из указанных препаратов на другой при их неэффективности и на любом этапе лечения при их непереносимости.
#Тоцилизумаб** (L04AC), #тофацитиниб** (L04AA), #абатацепт** (LO4AA24), #упадацитиниб** (L04AA) назначаются по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет. Режимы дозирования - см. ниже.
- Рекомендуется назначение #тоцилизумаба** (L04AC)
- детям с массой тела < 30 кг в дозе 10 мг/кг/введение, детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно, внутривенно 1 раз в 4 нед. [332, 333, 463, 466] (УДД 5, УУР C) или
- детям с массой тела < 30 кг в дозе 162 мг подкожно 1 раз в 3 нед., детям с массой тела >= 30 кг - в дозе 162 мг подкожно 1 раз в 2 нед. [332, 333, 463, 466] (УДД 4, УУР C)
в комбинации с #метотрексатом** (L01BA) и/или #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) с целью индукции ремиссии увеита [332, 333, 463, 466]. (УДД 5, УУР C)
Комментарии: критерий эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Тоцилизумаб** (L04AC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение
- #тофацитиниба** (L04AA) перорально в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) или
- #упадацитиниба** (L04AA) перорально пациентам в возрасте >= 12 лет и массой тела >= 40 кг 15 мг 1 раз в сут.
- #барицитиниба** (L04AA) перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. (УДД 5, УУР C)
в комбинации с метотрексатом** (L01BA) и/или #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) с целью индукции ремиссии увеита [398, 401, 402, 421, 467 - 469, 475, 614 - 617]. (УДД 4, УУР C)
Комментарии: критерий эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Тофацитиниб** (L04AA), #упадацитиниб** (L04AA), #барицитиниб** (L04AA) назначаются по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет [401, 415, 475, 614 - 617].
Контроль эффективности терапии - см. Приложения Г3, Г4
- Рекомендуется назначение #абатацепта** (LO4AA24) в дозе 10 мг/кг/ведение внутривенно по схеме 0, 2, 4-я нед, далее каждые 4 нед. в комбинации с метотрексатом** (L01BA) и/или #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) с целью индукции ремиссии увеита [32, 332, 333, 463, 470, 476]. (УДД 5, УУР C)
Комментарии: критерий эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Абатацепт** (LO4AA24) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
Контроль эффективности терапии - см. Приложения Г3, Г4.
- Рекомендуется переключение на #ритуксимаб** (L01XC) в комбинации с метотрексатом** (L01BA) и/или #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) при неэффективности ингибиторов ФНО-альфа (L04AB), #тоцилизумаба** (L04AC), #абатацепта** (LO4AA24), #тофацитиниба** (L04AA), #упадацитиниба** (L04AA), #барицитиниба** (L04AA) в сочетании с #метотрексатом** (L01BA) и/или #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) или в качестве монотерапии с целью индукции ремиссии увеита [17, 333, 463]. (УДД 5, УУР C)
Комментарии: эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется переключение на #ритуксимаб** (L01XC) на любом этапе лечения при непереносимости ингибиторов ФНО-альфа (L04AB), #тоцилизумаба** (L04AC), #тофацитиниба** (L04AA), #упадацитиниба** (L04AA), #барицитиниба** (L04AA), #абатацепта** (LO4AA24) в комбинации с #метотрексатом** (L01BA) и/или с #циклоспорином** (L04DA01), и/или #микофенолата мофетилом** (L04AA06) с целью индукции/поддержания ремиссии увеита [17, 333, 400, 421, 463, 475]. (УДД 5, УУР C)
Комментарии: критерий эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
#Ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение #ритуксимаба** (L01XC) в дозе 375 мг/м2 поверхности тела внутривенно 1 раз в неделю в течение 4-х последовательных нед. с целью поддержания/индукции ремиссии увеита [1, 3, 17, 32, 333, 463]. (УДД 5, УУР C)
Комментарии: курсы лечения #ритуксимабом** (L01XC) (4 инфузии в течение 4-х последовательных недель) проводятся 1 раз в 22 - 24 недели при сохраняющейся активности заболевания с учетом инфекционных и неинфекционных осложнений.
#Ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение #ритуксимаба** (L01XC) в комбинации с #ко-тримоксазолом** (J01EE) в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно с целью профилактики пневмоцистной пневмонии в соответствии с международными рекомендациями по лечению иммунокомпрометированных пациентов [303, 3, 32, 276]. (УДД 5, УУР C)
- Рекомендуется отмена ГИБП или #тофацитиниба** (L04AA), или #упадацитиниба** (L04AA), или #барицитиниба** (L04AA), при их непереносимости и назначение глюкокортикоидов (H02AB) для перорального приема в дозе 0,25 мг/кг в сут. в сочетании с метотрексатом** (L01BA) и/или #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) на любом этапе лечения с целью индукции ремиссии увеита [17, 30, 32, 332, 333, 356]. (УДД 5, УУР C)
Комментарии: дозы и порядок назначения #метотрексата** (L01BA), #циклоспорина** (L04AA01) и #микофенолата мофетила** (L04AA06) см. выше.
Дозы и порядок назначения ГК см. ниже.
- Рекомендуется дополнительное назначение ГК (H02AB): преднизолона** (H02AB) для перорального приема в дозе 0,25 мг/кг в сут. или метилпреднизолона** (H02AB) в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** (L01BA) и/или #циклоспорина** (L04AA01), или #микофенолата мофетила** (L04AA06) в комбинации с ГИБП или #тофацитинибом** (L04AA), или #упадацитинибом** (L04AA), #барицитинибом** (L04AA) или при нарастании активности увеита на любом этапе лечения с целью индукции ремиссии увеита [17, 30, 32, 332, 333, 356]. (УДД 5, УУР C)
Комментарии: резистентность к терапии всеми ГИБП, #тофацитинибом** (L04AA), #упадацитинибом** (L04AA), #барицитинибом** (L04AA) в комбинации с #метотрексатом** (L01BA) и/или с #циклоспорином** (L04AA01), или #микофенолата мофетилом** (L04AA06) является показанием для назначения ГК.
Критерий эффективности - достижение ремиссии увеита через 3 месяца лечения (оценка проводится врачом-офтальмологом).
3.1.5 Лечение юношеского артрита с гемофагоцитарным синдромом
- Рекомендуется назначение и проведение терапии в условиях ревматологического стационара после проведения диагностики, в том числе дифференциальной диагностики, и установления/подтверждения диагноза ЮА с вторичным гемофагоцитарным синдромом всем пациентам с целью обеспечения возможности профилактики и своевременного купирования тяжелых осложнений [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется назначение таргетной этиотропной терапии антибактериальными препаратами системного действия (JO1) и/или противогрибковыми препаратами системного действия (JO2A), и/или противовирусными препаратами системного действия (J05) пациентам с известным этиологическим инфекционным фактором с целью прекращения активизации врожденной иммунной системы [1, 237, 238, 252]. (УДД 5, УУР C)
- Рекомендуется назначение ГК (HO2AB) в комбинации с #циклоспорином** (L04AD) и #иммуноглобулином человека нормальным** (J06BA) всем пациентам с целью купирования вГФС [237, 238, 250, 477 - 481]. (УДД 5, УУР C)
- Рекомендуется проведение пульс-терапии #метилпреднизолоном** (HO2AB) в дозе 20 - 30 мг/кг/введение внутривенно или назначение #дексаметазона** (HO2AB) в дозе 10 - 20 мг/м2/сут. внутривенно всем пациентам с целью купирования ГФС [237, 250, 477, 478, 480 - 484]. (УДД 5, УУР C)
Комментарии: #дексаметазон** (HO2AB) и #циклоспорин** (L04AD) назначаются по жизненным показаниям по решению врачебной комиссии, после получения информированного согласия родителей и детей в возрасте старше 15 лет.
- Рекомендуется постепенное снижение дозы внутривенных ГК после купирования клинических и лабораторных признаков вГФС по следующим схемам:
- #дексаметазон** (HO2AB) с исходной дозы - 10 - 20 мг/м2/сут. в течение 1 - 2 нед., 5 - 10 мг/м2/сут. в течение 3 - 4 нед., 2,5 - 5 мг/м2/сут. в течение 5 - 6 нед., 1,25 - 2,5 мг/м2/сут. в течение 7 - 8 нед.;
- #метилпреднизолон** с исходной дозы - 20 - 30 мг/кг/введение в течение 3 - 5 дней снижение дозы на 25% 1 раз в 2 - 3 дня с целью профилактики синдрома отмены [1, 3, 237, 478, 481, 485 - 488]. (УДД 5, УУР C)
- Рекомендуется назначение #циклоспорина** в дозе 3 - 5 мг/кг/сут. внутривенно или перорально всем пациентам с целью купирования вГФС [237, 238, 250, 477, 478, 480, 481, 485, 489]. (УДД 4, УУР C)
- Рекомендуется назначение #иммуноглобулина человека нормального** (J06BA) в дозе 1 - 2 г/кг/курс в течение 2-х дней внутривенно всем пациентам с целью достижения иммуносупрессивного эффекта и купирования вГФС [250, 481, 485, 490 - 492]. (УДД 5, УУР C)
Комментарии: введение всей курсовой дозы #иммуноглобулина человека нормального** осуществляется путем непрерывной продленной инфузии одномоментно для обеспечения блокирования Fc-рецепторов IgG на фагоцитирующих клетках; подавления пролиферации T лимфоциты и продукции иммуноглобулинов; взаимодействия с системой комплемента; блокирования активации и действия цитокинов; блокирования экспрессии молекул адгезии на эндотелиальных клетках.
#Иммуноглобулин человека нормальный** (J06BA) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется проведение оценки эффективности применяемой схемы лечения вГФС в соответствии с критериями достижения ответа на терапию (купирование лихорадки, уменьшение размеров селезенки, повышение числа тромбоцитов крови >= 100 x 109/л, нормализация уровня фибриногена крови, снижение концентрации ферритина сыворотки крови на 25%) каждые 48 часов с целью решения вопроса о продолжении/смене схемы индукционной терапии [237, 238]. (УДД 5, УУР C)
Комментарии: при достижении ответа следует продолжить терапию до достижения стадии неактивной болезни.
- Рекомендуется назначение #анакинры** (L04AC) в дозе 5 - 10 мг/кг/сут. внутривенно в 2 введения в течение 3 - 10 дней при необходимости дольше при нарастании активности вГФС в первые 48 часов проведения терапии ГК в комбинации с #циклоспорином** (L04AD) и #иммуноглобулином человека нормальным** (J06BA) с целью купирования ГФС [237, 238, 254, 493 - 498]. (УДД 4, УУР C)
Комментарии: #анакинра** (L04AC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется при неэффективности комбинации #анакинры** (L04AC) с ГК, #циклоспорином** (L04AD) и #иммуноглобулином человека нормальным** (J06BA) дополнительное назначение:
- #руксолитиниба** перорально
- детям с весом до 10 кг - 2,5 мг x 2 раза/сут.;
- детям с весом от 10 до 25 кг - 5 мг x 2 раза/сут.;
- детям с весом > 25 кг - 10 мг x 2 раза/сут. (УДД 4, УУР C)
- или #тофациниба** (L04AA) перорально в дозе 10 мг x 2 раза/сут. с целью купирования ГФС [237, 499, 500]. (УДД 4, УУР C)
Комментарии: #руксолитиниб** и #тофацитиниб** назначаются по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется переключение на #ритуксимаб** (L01XC) в дозе 375 мг/м2 в нед. внутривенно в течение 1 - 4 последовательных недель при неэффективности комбинации #анакинры** (L04AC) с ГК, #циклоспорином** (L04AD), #иммуноглобулином человека нормальным** (J06BA) и #руксолитинибом** или #тофацинибом** (L04AA) с целью купирования ГФС [237, 485, 501]. (УДД 5, УУР C)
Комментарии: #ритуксимаб** (L01XC), назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение #ко-тримоксазола** (JO1EE) в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно в комбинации с #ритуксимабом** (L01XC) с целью профилактики пневмоцистной пневмонии [303, 3, 32, 276, 502]. (УДД 5, УУР C)
- Рекомендуется назначение #преднизолона** в дозе 1 - 2 мг/кг/перорально или #метилпреднизолона** (HO2AB) в дозе эквивалетной преднизолону, при неэффективности комбинированной терапии вГФС или реактивации вГФС на фоне снижения/отмены внутривенных ГК с целью купирования ГФС [236 - 238, 250]. (УДД 4, УУР C)
- Рекомендуется назначение #ацикловира** (JO5AB) детям в возрасте < 1 года в дозе 10 мг/кг/введение внутривенно каждые 8 часов; детям в возрасте >= 1 года - в дозе 500 мг/м2 внутривенно каждые 8 часов при развитии инфекции Herpes zoster с целью подавления триггерного фактора вГФС [3, 32, 213, 503 - 506]. (УДД 5, УУР C)
- Рекомендуется назначение #ацикловира** (JO5AB) в дозе 5 - 10 мг/кг/введение внутривенно каждые 8 часов в течение 7 - 10 дней при подтверждении активной инфекции, вызванной Herpes simplex virus с целью подавления триггерного фактора вГФС [3, 32, 504, 507]. (УДД 5, УУР C)
Комментарии: #ацикловир** (JO5AB) детям < 3 лет назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Лечение проводится до полного купирования герпетической инфекции.
- Рекомендуется назначение #ганцикловира** (JO5AB) в дозе 6 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при подтверждении активной цитомегаловирусной инфекции с целью подавления триггерного фактора вГФС [3, 508 - 511]. (УДД 5, УУР C)
Комментарии: #ганцикловир** (JO5AB) детям < 12 лет назначается по решению врачебной комиссии, после получения информированного согласия родителей и разрешения локального этического комитета медицинской организации.
- Рекомендуется назначение #ганцикловира** (JO5AB) в дозе 10 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при подтверждении активной Эпштейна-Барр вирусной инфекции с целью подавления триггерного фактора вГФС [3, 32, 512]. (УДД 5, УУР C)
Комментарии: #ганцикловир** (JO5AB) детям < 12 лет назначается по решению врачебной комиссии, после получения информированного согласия родителей и разрешения локального этического комитета медицинской организации.
- Рекомендуется назначение #ритуксимаба** в качестве ГИБП первого выбора в сочетании с #циклоспорином**, #иммуноглобулином человека нормальным** и #ко-тримоксазолом** при активной Эпштейна-Барр вирусной инфекции с целью подавления репликации вируса в B-лимфоцитах и купирования вГФС [3, 32, 250, 513]. (УДД 5, УУР C)
Комментарии:
Режимы применения:
- #ритуксимаб** (L01XC) - в дозе 375 мг/м2/нед. внутривенно в течение 1 - 4 последовательных недель [513];
- #циклоспорин** (L04AD) - 3 - 5 мг/кг/сут. [250, 513];
- #иммуноглобулин человека нормальный** (J06BA) - 1 - 2 г/кг/курс в течение 2-х дней [250, 513];
- #ко-тримоксазол** (JO1EE) - порядок назначения и дозы #ко-тримоксазола** (JO1EE) см. выше [303, 502].
#Ритуксимаб** (L01XC) назначается по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей/пациентов в возрасте старше 15 лет.
- Рекомендуется назначение антитромботических средств (B01A): препаратов из группы гепарина (B01B) или прямых ингибиторов фактора Xa (B01AF); антиагрегантов, кроме гепарина (B01AC); антифибринолитических средств (B02A) всем пациентам с целью предотвращения тромботических осложнений и купирования коагулопатии [46, 47, 51, 150, 238, 245, 356, 514, 515]. (УДД 5, УУР C)
Комментарии: антитромботические средства (B01A) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется проведение гемотрансфузии при развитии коагулопатии потребления, кровотечения с целью восстановления баланса в системе гемостаза [242, 516]. (УДД 5, УУР C)
Комментарии: при развитии коагулопатии потребления проводятся гемотрансфузия в виде трансфузии крови и препаратов крови (B05A): эритроцитарной массы, свежезамороженной плазмы, фактора свертывания крови VII, тромбомассы, криопреципитата и др. в соответствии с показаниями.
- Рекомендуется назначение колониестимулирующего фактора #филграстима** (LO3AA) в дозе 5 - 10 мкг/кг/сут. подкожно в течение 3 - 5 дней (при необходимости - дольше) при снижении абсолютного числа нейтрофилов <= 1,0 x 109/л с целью восстановления числа нейтрофилов в крови профилактики развития инфекционных осложнений [1, 3, 32, 517, 518]. (УДД 5, УУР C)
- Рекомендуется назначение антибактериальных препаратов системного действия (JO1) в сочетании с противогрибковыми препаратами системного действия (JO2A) до разрешения агранулоцитоза при снижении абсолютного числа нейтрофилов <= 1,0 x 109/л плановое с целью профилактики развития инфекционных осложнений [3, 32, 150, 151, 519, 520]. (УДД 5, УУР C)
- Рекомендуется назначение эмпирической антибактериальной терапии препаратами системного действия (JO1), влияющими на грамположительную, грамотрицательную и анаэробную флору, и/или противогрибковыми препаратами системного действия (JO2A), и/или противовирусными препаратами системного действия (JO5) при развитии сепсиса/инфекционного осложнения до подтверждения этиологического фактора с целью купирования/предотвращения прогрессирования инфекционного процесса [81, 150, 151, 154 - 156, 237, 238, 516, 519 - 523]. (УДД 5, УУР C)
Комментарии: антибактериальные препараты системного действия (JO1), противогрибковые препараты системного действия (JO2A) и противовирусные препараты (JO5) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
- Рекомендуется назначение таргетной терапии по чувствительности микрофлоры при подтверждении этиологического фактора сепсиса/инфекционного осложнения в зависимости от клинической ситуации антибактериальными препаратами системного действия (JO1) (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз (JO1CR) и/или цефалоспорины 4-го поколения (JO1DE), и/или карбапенемы (JO1DH), и/или другие антибактериальные препараты (JO1XX), и/или антибиотики гликопептидной структуры (J01XA), и/или другие аминогликозиды (J01GB)) в сочетании или без/с противогрибковыми препаратами системного действия (JO2A), и/или противовирусными препаратами системного действия (J05) с целью купирования сепсиса/инфекционного осложнения [81, 150, 151, 154 - 156, 238, 516, 519 - 522]. (УДД 5, УУР C)
- Рекомендуется проведение лечения вГФС до достижения критериев неактивной стадии (отсутствие лихорадки, спленомегалии, цитопении (HB >= 90 г/л, тромбоциты >= 100 x 109/л, нейтрофилы >= 0,5 x 109/л), уровень триглицеридов крови < 3 ммоль/л или < 265 мг/дл, ферритина <= 500  , нормализация показателей цереброспинальной жидкости (при поражении ЦНС)) с целью предотвращения развития полиорганной недостаточности и летального исхода [524]. (УДД 5, УУР C)
, нормализация показателей цереброспинальной жидкости (при поражении ЦНС)) с целью предотвращения развития полиорганной недостаточности и летального исхода [524]. (УДД 5, УУР C)
Комментарии: после купирования вГФС рекомендуется проведение терапии в соответствии с установленным вариантом ЮА (см. выше).
3.1.6 Основные принципы лечения ювенильного идиопатического артрита
1. Главной целью лечения пациентов с ЮИА является клиническая ремиссия - отсутствие симптомов воспалительной активности, включая системные проявления (2bC)* (см. Приложения Г1 - Г4).
2. Минимальная (или низкая) активность болезни может быть альтернативной целью исключительно у пациентов с длительно текущим заболеванием (2cB)* (см. Приложения Г1 - Г4).
3. Определение цели, выбор терапии должен базироваться на индивидуальных особенностях ребенка и согласовываться с родителем/пациентом (5D)*.
4. Активность болезни должна регулярно оцениваться и документироваться с использованием валидированных комплексных инструментов (2cC)* (см. Приложения Г1 - Г4).
5. Частота проведения контроля зависит от типа ЮИА, активности заболевания, наличия системных проявлений (5 C)*.
6. Снижение активности болезни на 50% должно быть достигнуто у всех пациентов по крайней мере через 3 месяца, а цель (неактивная болезнь/ремиссия) - через 6 месяцев лечения. У пациентов с сЮИА с активными системными проявлениями лихорадка должна купироваться через 1 неделю (2bB)*.
7. Терапия должна корректироваться до тех пор, пока цель не будет достигнута (2bC)*.
8. Мониторирование должно быть постоянным для обеспечения контроля сохранения ремиссии (цели) (2bC)*.
A. Терапевтическая стратегия лечения ЮИА основана на сотрудничестве родителей/пациента, детской ревматологической команды, осуществляющей лечение и реабилитацию пациента.
B. Ювенильный идиопатический артрит - гетерогенная группа болезней, что предусматривает различные терапевтические подходы.
C. Основные цели лечения ЮИА - контроль над клиническими и лабораторными проявлениями болезни, предотвращение прогрессирования костно-хрящевой деструкции, поражения глаз; избежание развития коморбидных состояний и побочных эффектов лекарственных препаратов; обеспечение функциональной активности, роста, развития, высокого качества жизни и социальной адаптации ребенка.
D. Прекращение воспалительного процесса - необходимое условие достижения поставленных целей.
E. Длительное применение системных ГК неприемлемо для достижения цели.
F. Для достижения цели необходим мониторинг активности болезни и коррекция терапии.
* Критерии PRES [347].
3.2. Хирургическое лечение
- Рекомендовано эндопротезирование сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) детям с 3 - 4 стадией вторичного коксартроза с учетом возрастных ограничений с целью восстановления функциональной активности и предотвращения прогрессирования инвалидизации [1, 3, 32, 214, 525]. (УДД 4, УУР C)
3.3. Немедикаментозное лечение
- Рекомендуется ограничение двигательного режима ребенка в периоды обострения заболевания [1, 3, 32, 214, 427, 526]. (УДД 5, УУР C)
Комментарии: полная иммобилизация суставов с наложением лангет противопоказана, это способствует развитию контрактур, атрофии мышечной ткани, усугублению остеопороза, быстрому развитию анкилоза. Физические упражнения способствуют сохранению функциональной активности суставов. Полезны езда на велосипеде, плавание, прогулки. Бег, прыжки, активные игры нежелательны. Рекомендуется сохранять прямую осанку при ходьбе и сидении, спать на жестком матрасе и тонкой подушке.
Исключить психоэмоциональные нагрузки, пребывание на солнце.
- Рекомендуется всем пациентам с ЮА употребление пищи с повышенным содержанием кальция и витамина D с целью профилактики остеопороза [1, 3, 32, 327, 328, 371, 527, 528]. (УДД 5, УУР C)
- Рекомендуется применение шин, лонгет, стелек пациентам с деформациями в суставах и нарушением роста нижних конечностей с целью коррекции ортопедических нарушений [1, 3, 32, 214]. (УДД 5, УУР C)
Комментарии: для статических ортезов необходима прерывистость иммобилизации - их следует носить или надевать в свободное от занятий время и в течение дня обязательно снимать для стимуляции мышечной системы во время физических упражнений, занятий, трудотерапии, туалета. При выраженном остеопорозе в грудном и поясничном отделах позвоночника следует носить корсет или реклинатор; при поражении суставов шейного отдела позвоночника - головодержатель (мягкий, жесткий).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется проведение (реализация услуг) медицинской реабилитации пациентам с системными поражениями соединительной ткани, воспалительными артропатиями, спондилопатиями [337, 371, 529 - 544]. (УДД 2, УУР B)
Комментарии: проводится у всех пациентов; разрабатывается индивидуальная программа реабилитации; формулируются цели и задачи проведения реабилитационных мероприятий на основе реабилитационного диагноза и реабилитационного потенциала на день, на неделю, на весь период реабилитации; определяются двигательный режим, индивидуальные границы интенсивности применяемых воздействий на пациента, имеющего нарушения функций; разрабатывается индивидуальная программы ЛФК; определяются методы реабилитации: медикаментозные средства, кинезотерапия, механотерапия, в том числе лечебная механотерапия в воде, физиотерапия, робототехника, экзоскелеты, информационные технологии, психологическая коррекция, эрготерапия,; выбираются формы медицинской реабилитации на различных этапах ее применения, в различные периоды течения заболевания (индивидуальное, групповое занятие, занятие с применением телемедицинских технологий); осуществляется консультирование законных представителей детей, нуждающихся в медицинской реабилитации, и обучение их реабилитационным методикам, разрешенным к применению в домашних условиях, и навыкам ухода за тяжелобольными детьми.
- Рекомендуется проведение физиотерапии пациентам с поражением суставов, мышечной атрофией, стероидной миопатией при достижении низкой степени активности заболевания, стадии неактивной болезни/ремиссии [3, 32, 337, 529 - 531, 545]. (УДД 5, УУР C)
Комментарии: разрабатывается план, формулируются цель и задачи применения физиотерапии у пациента с ЮА при реализации индивидуальной программы реабилитации; методы физиотерапии (электро-, магнито-, свето-, механо-, гидро-, термотерапия) и санаторно-курортного лечения (климато-, бальнео-пелоидотерапия) выбираются в зависимости от различных периодов течения заболевания.
- Рекомендуется проведение школы психологической реабилитации для пациентов с ЮА и их родственников [3, 32, 221, 222, 549]. (УДД 3, УУР C)
Комментарии: медицинская реабилитация обязательно сочетается с психологической реабилитацией детей и их родителей; разрабатывается индивидуальная программа психологической реабилитации и психотерапевтической программы с учетом клинической картины заболевания, выявленных психологических и психосоциальных механизмов психического расстройства, с учетом клинической картины, особенностей личности, психотерапевтической гипотезы, психотерапевтических мишеней, выбираются методы психологической интервенции (психологической терапии, психологического консультирования, психологической коррекции и психологической реабилитации); виды психотерапии (динамическая, когнитивно-поведенческая, экзистенциально-гуманистическая, психотерапии с помощью неосновных ее направлений - арт-терапия, телесноориентированная психотерапия, психодрама, суггестивная психотерапия и т.п.); формы психотерапии (индивидуальная, семейно-супружеская, групповая, психотерапии в условиях естественной среды, средовой психотерапии).
- Рекомендуется проведение "Школы для детей с ревматическими болезнями и их родителей" с целью информирования об особенностях профилактики осложнений заболевания, вариантах его течения и принципах безопасности противоревматической терапии [3, 32, 221, 222, 549]. (УДД 3, УУР C)
Комментарии: задачей "Школы для детей с ревматическими болезнями и их родителей" является информировать родителей и детей об особенностях, механизмах развития, клинической картине болезни, лечении, механизмах действия лекарственных препаратов, их эффективности, возможных побочных эффектах; методах медицинской и психологической реабилитации, исходах заболевания; вакцинации, профилактике обострений, осложнений болезни и нежелательных эффектов противоревматических препаратов. Обучение методам контроля эффективности и безопасности лекарственных препаратов по общепринятым ревматологическим шкалам и опросникам.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Профилактика
Первичная профилактика не разработана, поскольку этиология ЮА окончательно не установлена.
- Рекомендуется проведение профилактики осложнений и обострений ЮА, побочных эффектов противоревматической терапии с целью обеспечения высокого качества медицинской помощи [1, 3, 32, 430, 550]. (УДД 5, УУР C)
Комментарии: для профилактики обострений и осложнений ЮА под постоянным контролем клинических и лабораторных показателей активности заболевания проводится длительная поддерживающая терапия, разработанная с учетом индивидуальных особенностей пациента и варианта болезни, а при необходимости ее коррекция; обеспечивается охранительный режим (ограничиваются психо-эмоциональные и физические нагрузки, в период обострения дети обучаются на дому и посещают школу в стадии неактивной болезни/ремиссии, ограничиваются контакты с целью уменьшения риска развития инфекционных заболеваний); исключаются инсоляция, поездки в регионы с высоким уровнем инсоляции и применение УФО, обязательно используются солнцезащитные кремы, рекомендуется ношение одежды, максимально закрывающей кожу, головных уборов с полями; предупреждается переохлаждение; разрабатывается индивидуальный подход к вакцинации; исключается применение живых вакцин и иммуномодуляторов.
Для снижения риска развития побочных эффектов противоревматических препаратов проводится регулярный мониторинг клинических и лабораторных показателей безопасности; исключается применение лекарственных препаратов, усиливающих токсичность ГК, иммунодепрессантов и ГИБП.
- Не рекомендуется проведение вакцинации живыми и живыми ослабленными вакцинами одновременно с терапией ГИБП и иммунодепрессантами пациентам, получающим ГИБП [1, 3, 32, 551 - 553]. (УДД 5, УУР C)
Комментарии: безопасность подобного сочетания не установлена. Может развиться обострение ЮА. Отсутствуют данные о вторичной передаче инфекции от пациентов, иммунизированных живыми вакцинами, к пациентам, получающих ГИБП.
- Рекомендуется проведение доконтактной профилактики новой коронавирусной инфекции, пациентам в возрасте 12 лет и старше с массой тела не менее 40 кг, до назначения или на любом этапе терапии иммунодепрессантами и/или ГИБП в сочетании или без ГК, путем проведения пассивной иммунизации препаратами противовирусных моноклональных антител (J06BD) [554]. (УДД 4, УУР C)
- Рекомендуется проведение вакцинации вакциной для профилактики пневмококковой инфекции полисахаридной, конъюгированной, адсорбированной**, содержащей капсулярные полисахариды 13 серотипов пневмококка всех пациентов с ЮА, до назначения или на любом этапе терапии иммунодепрессантами и/или ГИБП в сочетании или без ГК (за исключением #ритуксимаба**) с целью профилактики пневмококковой инфекции, повышения приверженности лечению и профилактики обострений в соответствии с международными рекомендациями [552, 555 - 558]. (УДД 3, УУР B)
Комментарии: вакцинация вакциной для профилактики пневмококковой инфекции, содержащей капсулярные полисахариды 13 серотипов пневмококка пациентов, получающих тоцилизумаб**, проводится за 2 нед. до планируемой инфузии или через 2 нед. после; пациентов, получающих #этанерцепт**, - за 1 неделю до планируемой инъекции или через 1 нед. после; пациентов, получающих #адалимумаб** и #голимумаб**, - за 2 и 4 нед. до планируемой инъекции или через 2 и 4 нед. после, соответственно, пациентов, которым планируется назначение #ритуксимаба** - до проведение первой инфузии для профилактики инфекционных осложнений, повышения приверженности лечению и профилактики обострений ЮА.
5.2. Контрольное обследование пациентов с юношеским артритом в условиях стационара/дневного стационара, инициировавшего назначение ГИБП/иммунодепрессанта.
Обследование проводится 1 раз в 3 - 6 мес: через 3 и 6 мес. после назначения терапии; далее каждые 6 мес. с целью контроля эффективности и безопасности терапии, выявления осложнений заболевания, сопутствующей патологии.
Жалобы и анамнез см. пункт 2.1.
Физикальное обследование см. пункт 2.2.
- Рекомендуется проведение оценки эффективности лечения и безопасности противоревматической терапии всем пациентам с установленным диагнозом ЮА в условиях ревматологического стационара, через 3 мес. после назначения терапии; через 6 мес. после назначения терапии; далее каждые 6 мес. с целью решения вопроса о продолжении/коррекции терапии [1, 3, 32, 347, 423, 430]. (УДД 5, УУР C)
Комментарии: основная цель лечения - достижение 50% улучшений по критериям Американского колледжа ревматологов через 3 мес. и стадии неактивной болезни по критериям неактивной болезни/ремиссии C. Wallace через 6 мес.
Контроль эффективности терапии - см. Приложения Г1 - Г4.
- Рекомендуется общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови) всем пациентам с целью выявления активности болезни и контроля безопасности противоревматических препаратов [1, 3, 32, 42, 65, 430, 561]. (УДД 5, УУР C)
Комментарии: показатели общего (клинического) анализа крови развернутого должны быть в пределах нормальных значений. Одно-, двух или трехростковая цитопения может быть, в числе прочего, нежелательным проявлением лечения ГИБП и/или иммунодепрессанта.
Лейкопения наиболее часто развивается при применении тоцилизумаба** и #ритуксимаба**, реже - на фоне абатацепта**, ингибиторов ФНО-альфа, метотрексата**, лефлуномида**, микофенолата мофетила** (L04AA6).
Тромбоцитопения может развиваться на фоне лечения любым ГИБП и иммунодепрессантом. При наличии данных о повторных эпизодах развитии тромбоцитопении проводится коррекция терапии ГИБП и/или иммунодепрессантом.
- Рекомендуется прекращение инфузий ГИБП и/или инъекций/приема иммунодепрессантов (в течение 7 дней) всем пациентам при снижении числа тромбоцитов <= 150 > 100 x 109/л, числа нейтрофилов < 1,5 >= 1,0 x 109/л, в общем (клиническом) анализе крови с целью контроля нежелательных явлений на фоне терапии [1, 3, 32, 430]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК перорально следует продолжить. Общий (клинический) анализ крови повторить через нед.
- Рекомендуется отмена иммунодепрессанта и/или ГИБП всем пациентам при снижении абсолютного числа нейтрофилов < 1,0 x 109/л и/или числа тромбоцитов < 100 x 109/л в общем (клиническом) анализе крови, с целью предотвращения прогрессирования цитопении [1, 3, 32, 430]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК перорально следует продолжить. Общий (клинический) анализ крови повторить через нед.
- Рекомендуется назначение колониестимулирующего фактора #филграстима** (LO3AA) в дозе 5 - 10 мкг/кг/сут. подкожно при лейкопении с абсолютным числом нейтрофилов <= 1,0 x 109/л в течение 3 - 5 дней (при необходимости - дольше) до полной нормализации числа лейкоцитов и нейтрофилов [1, 3, 32, 430, 517 - 519]. (УДД 5, УУР C)
Комментарии: детям в возрасте < 1 года #филграстим** (LO3AA) назначается по решению врачебной комиссии, после получения информированного согласия родителей
- Рекомендуется назначение колониестимулирующего фактора #филграстима** (LO3AA) 5 - 10 мкг/кг/сут. подкожно в сочетании с антибактериальными препаратами системного действия (JO1) внутривенно при фебрильной нейтропении (нейтропения, сопровождающаяся лихорадкой) с абсолютным числом нейтрофилов <= 1,0 x 109/л [1, 3, 32, 430, 517 - 519]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК перорально следует продолжить.
Детям < 1 года #филграстим** (LO3AA) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Лечение #филграстимом** (LO3AA) проводится в течение 3 - 5 дней (при необходимости - дольше) до полной нормализации числа лейкоцитов и нейтрофилов.
- Рекомендуется продолжение лечения антибактериальными препаратами системного действия (JO1) всем пациентам с фебрильной нейтропенией (нейтропенией, сопровождающейся лихорадкой) с целью купирования фебрильной лихорадки и нормализации лейкоцитарной формулы по данным общего (клинического) анализа крови [1, 3, 32, 430, 517 - 519]. (УДД 5, УУР C)
- Рекомендуется возобновление лечения иммунодепрессантом, и/или ГИБП в той же дозе всем пациентам после восстановления числа нейтрофилов >= 1,5 x 109/л. по данным общего (клинического) анализа крови с целью поддержания ремиссии с ЮА [1, 3, 32, 430]. (УДД 5, УУР C)
- Рекомендуется проведение коррекции терапии иммунодепрессантом, и/или ГИБП всем пациентам при наличии данных о повторных эпизодах снижения числа клеток крови в общем (клиническом) анализе крови, с целью контроля нежелательных явлений на фоне терапии [1, 3, 32, 430]. (УДД 5, УУР C)
- Рекомендуется назначение флуконазола** внутривенно 3 - 12 мг/кг/сут. в зависимости от выраженности и длительности сохранения индуцированной нейтропении пациентам с нейтропенией с целью профилактики грибковых инфекций, развившихся результате лечения иммунодепрессантами и/или #ритуксимабом** [1, 3, 32, 430, 562]. (УДД 4, УУР C)
- Рекомендуется исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня холестерина липопротеинов высокой плотности в крови, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови всем пациентам с целью контроля активности заболевания, функции печени, почек, поджелудочной железы, электролитного баланса в условиях проведения терапии в условиях проведения иммуносупрессивной и/или генно-инженерной биологической терапии [1, 3, 32, 42, 64, 65, 430, 561]. (УДД 5, УУР C)
Комментарии: повышение уровня креатинина и/или мочевины, и/или мочевой кислоты, и/или общего билирубина, и/или К, и/или холестерина, и/или триглицеридов; повышение активности ЛДГ и/или АЛТ, и/или АСТ, и/или ГГТ, и/или ЩФ, и/или амилазы может быть нежелательным проявлением лечения НПВП и/или иммунодепрессантом, и/или ГИБП, и/или ГК. Железо сыворотки крови в стадии ремиссии заболевания соответствует референсным значениям.
- Рекомендуется временная отмена иммунодепрессанта и/или ГИБП при повышении уровня АЛТ, АСТ в сыворотке крови >= 1,5 раза выше верхней границы нормы и/или повышении уровня общего билирубина, свободного (неконъюгированного) и/или связанного (конъюгированного) билирубина, и/или мочевины, и/или креатинина, и/или мочевой кислоты и/или другого(их) биохимического(их) показателя(ей) выше верхней границы нормы всем пациентам с целью предотвращения развития жизнеугрожающего осложнения [1, 3, 32, 356, 430]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК перорально следует продолжить. Повторить анализ крови биохимический общетерапевтический через нед.
- Рекомендуется возобновление терапии иммунодепрессантом и/или ГИБП всем пациентам в той же дозе после нормализации показателей биохимического анализа крови общетерапевтического с целью поддержания ремиссии ЮА [1, 3, 32, 213, 356, 430]. (УДД 5, УУР C)
- Рекомендуется проведение коррекции терапии иммунодепрессантом и/или ГИБП всем пациентам при наличии данных о повторных эпизодах повышения биохимического(их) показателя(ей) с целью контроля нежелательных явлений на фоне терапии [1, 3, 32, 430]. (УДД 5, УУР C)
- Рекомендуется исследование уровня C-реактивного белка в сыворотке крови всем пациентам с целью контроля степени активности основного заболевания и развития инфекционных осложнений [1, 3, 32, 42, 44, 68, 356, 430, 561]. (УДД 3, УУР C)
Комментарии: при неактивной стадии болезни/ремиссии и отсутствии инфекционных осложнений уровень C-реактивного белка в сыворотке крови соответствует референсным значениям.
При повышении уровня C-реактивного белка в сыворотке крови необходимо оценить клинические и другие маркеры воспалительной активности ЮА, при их отсутствии - исключить инфекционные осложнения и/или развитие ГФС.
- Рекомендуется исследование уровня прокальцитонина в крови пациентам с подозрением на развитие инфекционных осложнений с целью исключения острого воспалительного ответа в условиях проведения иммуносупрессивной и/или генно-инженерной биологической терапии [1, 3, 32, 150 - 153, 430]. (УДД 3, УУР C)
Комментарии: повышение уровня прокальцитонина крови в сочетании с лейкоцитозом/лейкопенией, повышением уровня C-реактивного белка в сыворотке крови свидетельствует о развитии острого воспалительного ответа (сепсиса). При ЮА без инфекционных осложнений - в пределах референсных значений.
- Рекомендуется проведение комплекса исследований для исключения сепсиса: общий (клинический) анализ крови развернутый, анализ крови биохимический общетерапевтический, исследование уровня C-реактивного белка в сыворотке крови, микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование мочи на бактериальные патогены с применением автоматизированного посева с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам, микробиологическое (культуральное) исследование отделяемого из ануса, тромбоэластография, коагулограмма (ориентировочное исследование системы гемостаза); компьютерная томография органов грудной полости, ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование почек, эхокардиография, магнитно-резонансная томография органов брюшной полости, магнитно-резонансная томография органов малого таза и магнитно-резонансная томография забрюшинного пространства) в соответствии с клиническими рекомендации по лечению сепсиса у детей пациентам с фебрильной, гектической лихорадкой, лейкоцитозом/лейкопенией, тромбоцитопенией, повышением уровня C-реактивного белка в сыворотке крови и прокальцитонина сыворотки крови, несвязанными с активностью ЮА с целью исключения сепсиса [81, 150, 151, 154 - 156, 207, 247, 521, 563]. (УДД 4, УУР C)
Комментарии: проводится пациентам с фебрильной, гектической лихорадкой, лейкоцитозом/лейкопенией, тромбоцитопенией, повышением уровня C-реактивного белка в сыворотке крови и прокальцитонина сыворотки крови, несвязанными с активностью ЮА.
- Рекомендуется при развитии сепсиса назначение сначала эмпирической антибактериальной терапии, а в дальнейшем, в зависимости от клинической ситуации, внутривенно антибактериальных препаратов системного действия (JO1), влияющих на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз (JO1CR) и/или цефалоспорины 4-го поколения (JO1DE), и/или карбапенемы (JO1DH), и/или другие антибактериальные препараты (JO1XX), и/или антибиотики гликопептидной структуры (J01XA), и/или другие аминогликозиды (J01GB), и/или макролиды (J01FA)) в сочетании или без/с противогрибковыми препаратами системного действия (JO2A) по чувствительности микрофлоры в сочетании с #иммуноглобулином человека нормальным** (JO6BA) в дозе 400 мг/кг/курс (5 дней) в соответствии с клиническими рекомендация по лечению сепсиса у детей [81, 150, 151, 154 - 156, 521, 522, 564]. (УДД 5, УУР C)
Комментарии: вне возрастных показаний антибактериальные препараты системного действия (JO1) назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей в возрасте старше 15 лет.
При развитии сепсиса введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на весь период лечения антибиотиками. Прием ранее назначенных ГК перорально следует продолжить.
При нарастании активности ЮА проводится пульс-терапия #метилпреднизолоном** (см. выше) и/или назначаются (повышается доза) ГК для перорального приема (см. лечение ЮА).
- Рекомендуется временная отмена иммунодепрессанта и/или ГИБП и продолжение приема ранее назначенных ГК перорально на весь период этиотропной терапии при развитии сепсиса/инфекционного осложнения с целью предотвращения развития токсических реакций и прогрессирования инфекционного процесса [1, 3, 32, 565]. (УДД 5, УУР C)
- Рекомендуется возобновление терапии иммунодепрессантом, и/или ГИБП не раньше, чем через неделю после полного купирования клинических и лабораторных признаков сепсиса и окончания антибактериальной терапии всем пациентам с целью поддержания ремиссии ЮА [1, 3, 32, 213, 430, 565]. (УДД 5, УУР C)
- Рекомендуется определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение, активности антитромбина III в крови пациентам с признаками васкулита и/или сепсисом, и/или в ГФС с целью оценки состояния системы гемостаза [3, 32, 42, 46 - 49, 51, 53 - 55, 65, 561]. (УДД 5, УУР C)
- Рекомендуется проведение тромбоэластографии пациентам с признаками васкулита и/или сепсисом, и/или в ГФС, признаками гипер- и/или гипокоагуляции, пациентам, получающим антитромботические средства (B01A) с целью оценки эффективности антикоагулянтной терапии и определения дальнейшей тактики лечения [47, 50, 51, 56 - 59, 246, 247, 563]. (УДД 4, УУР C)
- Рекомендуется исследование уровня гепарина в крови пациентам с васкулитом с целью оценки состояния системы гемостаза и эффективности антикоагулянтной терапии [47, 50, 51, 56, 57, 244, 563]. (УДД 5, УУР C)
- Рекомендуется назначение/коррекция терапии антитромботическими средствами (B01A): препаратами из группы гепарина (B01B) или прямыми ингибиторами фактора Xa (B01AF); антиагрегантами кроме гепарина (B01AC); антифибринолитическими средствами (B02A) при развитии гиперкоагуляции, коагулопатии, внутрисосудистого диссеминированного свертывания по данным коагулограммы (ориентировочное исследование системы гемостаза) и тромбоэластограммы с целью нормализации гемокоагуляции [46, 47, 50, 51, 57, 245, 356]. (УДД 5, УУР C)
Комментарии: вне возрастных показаний антитромботические средства (B01A) назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей в возрасте старше 15 лет.
- Рекомендуется проведение гемотрансфузии в соответствии с показаниями пациентам с коагулопатией потребления/кровотечением [3, 46, 47, 150, 156, 566]. (УДД 5, УУР C)
Комментарии: при развитии коагулопатии потребления проводятся гемотрансфузия в виде трансфузии крови и препаратов крови (B01A): эритроцитарной массы, свежезамороженной плазмы, фактора свертывания крови VII, тромбомассы и др. в соответствии с показаниями.
- Рекомендуется определение содержания ревматоидного фактора (РФ) в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-CCP) в крови, определение содержания антител к антигенам ядра клетки и ДНК, всем пациентам с целью контроля иммунологической активности заболевания и нежелательных явлений лечения ингибиторами ФНО-альфа [1, 3, 4, 32, 44, 65, 66, 70, 71]. (УДД 3, УУР C)
Комментарии: нарастание уровня антител к антигенам ядра клетки и/или антител к двуспиральной ДНК наблюдается в условиях лечения ингибиторами ФНО-альфа и свидетельствует о развитии волчаночно-подобного синдрома.
При развитии волчаночно-подобного синдрома ингибиторы ФНО-альфа отменяются, проводится переключение на ГИБП с другим механизмом действия.
Нарастание уровня РФ и анти-CCP свидетельствует о нарастании иммунологической активности заболевания.
- Рекомендуется исследование уровня иммуноглобулинов в крови всем пациентам с целью выявления вторичного иммунодефицитного состояния в условиях иммуносупрессивной и/или генно-инженерной биологической терапии [1, 3, 4, 32, 65, 430, 567 - 569]. (УДД 5, УУР C)
Комментарии: снижение уровня иммуноглобулинов развивается при вторичном иммунодефицитном состоянии, преимущественно на фоне лечения #ритуксимабом** в условиях деплеции B лимфоцитов.
- Рекомендуется назначение #иммуноглобулина человека нормального** (J06BA) в дозе 400 мг/кг, при недостижении достаточного уровня иммуноглобулинов крови в дозе 500 мг/кг не реже 1 раза в 2 - 4 нед. до нормализации уровня иммуноглобулинов крови в случае снижения уровня иммуноглобулинов крови с целью коррекции уровня иммуноглобулинов крови и профилактики развития инфекционных осложнений в условиях развития иммунодефицитного состояния на фоне проведения иммуносупрессивной и/или генно-инженерной биологической терапии [1, 3, 32, 430, 567 - 571]. (УДД 5, УУР C)
- Рекомендуется пропустить плановую инфузию #ритуксимаба**, продолжить лечение иммунодепрессантом и прием ранее назначенных ГК перорально при снижении уровня иммуноглобулинов крови с целью контроля нежелательных явлений на фоне терапии [1, 3, 32, 430, 567 - 571]. (УДД 4, УУР C)
- Рекомендуется возобновление инфузий #ритуксимаба**, после восстановления уровня иммуноглобулинов крови с целью поддержания ремиссии ЮА [1, 3, 32, 430, 567 - 571]. (УДД 4, УУР C)
- Рекомендуется исследование популяций лимфоцитов всем пациентам, получающим #ритуксимаб** (L01XC), а также пациентам, часто болеющим вирусными, гнойными бактериальными инфекциями, в том числе оппортунистическими инфекциями для выявления субпопуляционного состава лимфоцитов (основных) [1, 3, 32, 83, 84, 112, 295 - 297, 417, 418, 572 - 574]. (УДД 4, УУР C)
Комментарии: снижение уровня субпопуляций T и/или B лимфоцитов, и/или натуральных киллеров свидетельствует о развитии вторичного иммунодефицитного состояния в условиях лечения иммунодепрессантом и/или ГИБП. Полная деплеция CD19+B лимфоцитов развивается в условиях лечения моноклональными антителами CD20+B лимфоцитам #ритуксимабом**.
- Рекомендуется определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче, пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной Эпштейна-Барр вирусной инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [1, 3, 32, 81, 113 - 118, 299, 575]. (УДД 4, УУР C)
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР качественное исследование, пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной цитомегаловирусной инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этитиотропной терапии [1, 3, 32, 115, 116, 119 - 122]. (УДД 4, УУР C)
- Рекомендуется определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями герпетической инфекции, и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной герпетической инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [1, 3, 32, 115, 116, 119, 123, 576]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной цитомегаловирусной инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [1, 115, 119, 121, 122, 124, 125]. (УДД 4, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной Эпштейна-Барр вирусной инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [3, 32, 113, 115, 119, 126]. (УДД 4, УУР C)
- Рекомендуется определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной Эпштейна-Барр вирусной инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [3, 32, 113, 115, 119, 126]. (УДД 5, УУР C)
- Рекомендуется определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной Эпштейна-Барр вирусной инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [3, 32, 113, 115, 119, 126]. (УДД 5, УУР C)
- Рекомендуется определение антител к вирусу простого герпеса (Herpes simplex virus) в крови пациентам с клиническими проявлениями герпетической инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления активной герпетической инфекции как инфекционного осложнения, развившегося в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК и решения вопроса о проведении этиотропной терапии [1, 3, 32, 81, 115, 119, 127, 128, 130, 577]. (УДД 4, УУР C)
- Рекомендуется назначение #ацикловира** (JO5AB) в дозе 200 мг перорально 5 раз в сутки (не более 1000 мг/сут.) детям в возрасте старше 2 лет или в дозе 5 - 10 мг/кг/введение внутривенно каждые 8 часов при развитии локальной герпетической инфекции; назначение #ацикловира** в дозе 10 мг/кг/введение внутривенно каждые 8 часов у детей в возрасте < 1 года; в дозе 500 мг/м2 внутривенно каждые 8 часов у детей в возрасте >= 1 года при развитии Herpes zoster в соответствии с клиническими рекомендациями по лечению герпесвирусных инфекций у детей, в том числе имеющих иммунокомпрометированный статус [3, 32, 213, 503, 504, 507, 508]. (УДД 5, УУР C)
Комментарии: #ацикловир** (JO5AB) у детей в возрасте < 3 лет назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Лечение #ацикловиром** проводится в течение 7 - 10 дней до полного исчезновения герпетических высыпаний.
- Рекомендуется назначение #ганцикловира** (JO5AB) в дозе 6 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при развитии цитомегаловирусной инфекции или #ганцикловира** (JO5AB) в дозе 10 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при развитии Эпштейна-Барр вирусной инфекции в соответствии с клиническими рекомендациями по лечению иммунокомпрометированных детей [3, 32, 508, 510 - 512]. (УДД 5, УУР C)
Комментарии: #ганцикловир** (JO5AB) у детей в возрасте < 12 лет назначается по решению врачебной комиссии, после получения информированного согласия родителей и разрешения локального этического комитета медицинской организации.
- Рекомендуется временная отмена иммунодепрессанта и/или ГИБП всем пациентам при развитии инфекции, вызванной герпес-вирусами [1, 3, 32, 430, 565, 578]. (УДД 5, УУР C)
Комментарии: прием иммунодепрессанта, и/или ГИБП прекращается на время проведения противовирусной терапии. Прием ранее назначенных ГК перорально следует продолжить.
- Рекомендуется возобновление терапии иммунодепрессантом и/или ГИБП всем пациентам не ранее, чем через 1 нед. после полного купирования клинических и лабораторных признаков инфекции и окончания противовирусной терапии [1, 3, 32, 213, 430, 565, 574, 578, 579]. (УДД 5, УУР C)
- Рекомендуется проведение обследования на наличие/отсутствие туберкулеза (очаговая проба с туберкулином, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**, исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, компьютерная томография органов грудной полости) всем пациентам, получающим ГИБП и/или иммунодепрессанты в сочетании (или без) с ГК, не реже 2 раз в год [1, 3, 32, 88, 90, 91, 91, 94, 212, 213, 430, 580]. (УДД 5, УУР C)
- Рекомендуется отмена иммунодепрессанта и/или ГИБП всем пациентам с выявленной положительной внутрикожной пробой с туберкулином (папула > 5 мм) и/или повышением уровня интерферона-гамма, и/или поражения легких, и/или внутригрудных лимфатических узлов [1, 3, 32, 88, 90, 91, 91, 94, 212, 213, 430, 580]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК перорально следует продолжить.
- Рекомендуется прием (осмотр, консультация) врача-фтизиатра первичный всем пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или поражением легких и/или внутригрудных лимфатических узлов с целью решения вопроса о дальнейшем обследовании и проведении специфической терапии [1, 3, 32, 88, 90, 91, 212, 213, 422, 430, 580, 581]. (УДД 5, УУР C)
Комментарии: при выявлении туберкулезной инфекции без очага проводится специфическая противотуберкулезная химиотерапия в течение 3 - 6 мес. (по решению врача-фтизиатра). Лечение иммунодепрессантом продолжается под контролем врача-ревматолога, общего (клинического) и биохимического общетерапевтического анализов крови; вопрос о продолжении терапии ГИБП решается в индивидуальном порядке.
- Рекомендуется назначение ГК перорально всем пациентам при развитии обострения ЮА на время проведения специфической противотуберкулезной терапии с целью поддержания ремиссии ЮА [1, 3, 32, 88, 90, 91, 212, 213, 430, 580, 581]. (УДД 5, УУР C)
Комментарии: вопрос о возобновлении и выборе ГИБП и/или иммунодепрессанта решается после окончания специфической химиотерапии и консультации врача-фтизиатра.
- Рекомендуется возобновление терапии иммунодепрессантом и/или ГИБП всем пациентам после завершения специфической противотуберкулезной терапии и консультации врача-фтизиатра [1, 3, 32, 88, 90, 91, 212, 580]. (УДД 5, УУР C)
Комментарии: вопрос о продолжении терапии ГИБП решается в индивидуальном порядке.
- Рекомендуется определение антител к сальмонелле кишечной (Salmonella enterica) в крови, определение антител к сальмонелле тифи (Salmonella typhi) в крови, определение антител классов M, G (IgM, IgG) к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis) в крови, определение антител к сероварам иерсинии энтероколитика (Yersinia enterocolitica) в крови всем пациентам с целью выявления инфицированности бактериями кишечной группы, развившейся в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК [1, 3, 32, 124, 582 - 589]. (УДД 5, УУР C)
- Рекомендуется определение антител классов M, G (IgM, IgG) к шигелле Боуди (Shigella boydii) в крови, определение антител классов к шигелле дизентерии (Shigella dysenteriae) в крови, определение антител классов M, G (IgM, IgG) к шигелле Зонне (Shigella sonnei) в крови, определение антител классов M, G (IgM, IgG) к шигелле Флекснера (Shigella flexneri) в крови всем пациентам с целью выявления инфицированности бактериями кишечной группы, развившейся в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК [1, 3, 32, 124, 582 - 589]. (УДД 5, УУР C)
- Рекомендуется проведение этиотропной терапии при выявлении антител классов A и M в диагностическом титре, а также антител класса G в высоком титре к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis), к сероварам иерсинии энтероколитика (Yersinia enterocolitica), к сальмонелле кишечной (Salmonella enterica), к сальмонелле тифи (Salmonella typhi), к шигелле Боуди (Shigella boydii), к шигелле дизентерии (Shigella dysenteriae), к шигелле Зонне (Shigella sonnei), к шигелле Флекснера (Shigella flexneri) в крови в соответствии с клиническими рекомендациями по диагностике и лечению кишечной инфекции у детей [1, 3, 32, 124, 582 - 589]. (УДД 5, УУР C)
Комментарии: введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на весь период лечения антибактериальными препаратами системного действия. Прием ранее назначенных ГК перорально следует продолжить.
Лечение ГИБП и/или иммунодепрессантом возобновляется не раньше, чем через 1 нед. после снижения лабораторных маркеров инфекции и окончания антибактериальной терапии.
- Рекомендуется определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci) в крови; определение антител к хламидии трахоматис (Chlamydia trachomatis) в крови; определение антител к хламидии пневмонии (Chlamydophila pneumoniae) в крови, определение антител классов M, G (IgM, IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови всем пациентам с целью выявления инфицированности микоплазмами и хламидиями, развившейся в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК [1, 3, 32, 95, 582, 585 - 590]. (УДД 5, УУР C)
- Рекомендуется проведение этиотропной терапии при выявлении антител классов A и M в диагностическом титре, а также антител класса G в высоком титре к микоплазме пневмонии (Mycoplasma pneumoniae), к хламидии трахоматис (Chlamydia trachomatis), к хламидии птичьей (Chlamydia Psittaci), хламидии пневмонии (Chlamydophila pneumoniae) в крови всем пациентам в соответствии с клиническими рекомендациями по диагностике и лечению микоплазменной и хламидийной инфекции у детей [1, 3, 32, 95, 582, 585 - 590]. (УДД 5, УУР C)
Комментарии: введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на весь период лечения антибактериальными препаратами системного действия. Прием ранее назначенных ГК перорально следует продолжить.
Лечение ГИБП и/или иммунодепрессантом возобновляется не раньше, чем через 1 нед. после снижения лабораторных маркеров инфекции и окончания антибактериальной терапии.
- Рекомендуется микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы всем пациентам для выявления контаминации носоглотки патогенными или условно патогенными микроорганизмами, развившейся в условиях лечения иммунодепрессантами и/или ГИБП в сочетании с ГК [1, 32, 81, 95, 3, 157, 158, 585 - 589]. (УДД 5, УУР C)
Комментарии: при выявлении контаминации носоглотки патогенными и/или условно патогенными микроорганизмами проводится прием (осмотр, консультация) врача-оториноларинголога для решения вопроса о санации.
При отсутствии клинических проявлений терапия ГИБП и/или иммунодепрессантом не прекращается.
При наличии воспалительных изменений в носоглотке проводится антибактериальная терапия. Лечение ГИБП и инъекции/прием иммунодепрессанта прекращаются на время проведения противовирусной терапии. Прием ранее назначенных ГК перорально следует продолжить. Лечение ГИБП и/или иммунодепрессантом возобновляется не раньше, чем через 1 нед. после полного купирования клинических и лабораторных признаков инфекции и окончания противовирусной терапии.
- Рекомендуется общий (клинический) анализ мочи и исследование мочи методом Нечипоренко всем пациентам с целью контроля состояния функции почек [1, 3, 4, 32, 65, 159]. (УДД 5, УУР C)
Комментарии: наличие изолированной микрогематурии может быть нежелательным явлением лечения НПВП и/или метотрексатом**.
При развитии стойкой микрогематурии метотрексат** отменяется. Введение ГИБП следует продолжить, проводится коррекция терапии иммунодепрессантом.
Наличие протеинурии может свидетельствовать о развитии вторичного амилоидоза почек.
- Рекомендуется регистрация электрокардиограммы (ЭКГ) всем пациентам с целью контроля функции сердца [1, 3, 32, 34]. (УДД 5, УУР C)
Комментарии: проводится всем пациентам. У пациентов с ремиссией ЮА патологические изменения по данным ЭКГ не выявляются
- Рекомендуется проведение холтеровского мониторирования сердечного ритма пациентам с аритмией, патологическими изменениями по данным электрокардиографии с целью выявления характера аритмии [1, 3, 32, 34, 315, 317, 430]. (УДД 5, УУР C)
- Рекомендуется проведение суточного мониторирования артериального давления пациентам с артериальной гипертензией с целью выявления отклонений артериального давления от нормы и разработки стратегии гипотензивной терапии [1, 3, 32, 34, 317, 430, 591]. (УДД 5, УУР C)
- Рекомендуется проведение комплексного ультразвукового исследования внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек) всем пациентам с целью выявления/исключения патологических изменений [1, 3, 32, 430]. (УДД 5, УУР C)
Комментарии: проводится всем пациентам. При обследовании могут выявляться: незначительное увеличение печени, дискинезия желчевыводящих путей, реактивные изменения в поджелудочной железе, утолщение стенок желчного пузыря, утолщение стенок желудка, кишечника. Все изменения могут быть связаны с нежелательными явлениями лечения НПВП и/или ГК, и/или иммунодепрессантов.
- Рекомендуется проведение эхокардиографии всем пациентам с целью контроля состояния функции сердца, выявления поражения миокарда, перикарда, эндокарда [1, 3, 32, 34]. (УДД 5, УУР C)
Комментарии: проводится всем пациентам. У пациентов с ремиссией ЮА патологические изменения по данным эхокардиографии не выявляются.
- Рекомендуется проведение эзофагогастродуоденоскопии с применением анестезиологического пособия (включая ранее послеоперационное ведение) или без его применения пациентам, получающим НПВП (M01A) и/или глюкокортикоиды (H02AB), пациентам с диспепсическими явлениями с целью исключения воспалительных заболеваний верхних отделов ЖКТ, связанных с основным заболеванием и/или с Helicobacter pylori и/или с применением НПВП, и/или ГК [3, 32, 160, 161, 183 - 191]. (УДД 4, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений по данным эзофагогастродуоденоскопии с целью исключения патологии ЖКТ, связанной с Helicobacter pylori [3, 32, 160, 161, 184 - 188, 190 - 193]. (УДД 4, УУР C)
- Рекомендуется назначение препаратов для лечения язвенной болезни желудка и двенадцатиперстной кишки и гастроэзофагеальной рефлюксной болезни (A02B) при выявлении рефлюксной болезни и/или воспалительной гастропатии, эрозивных, и/или язвенных процессов в пищеводе и/или желудке, и/или 12-перстной кишки по данным эзофагогастродуоденоскопии в соответствии с клиническими рекомендации по лечению воспалительной гастропатии и гастроэзофагеальной рефлюксной болезни у детей в соответствии с международными рекомендациями [3, 32, 184]. (УДД 5, УУР C)
Комментарии: на время проведения противовоспалительной терапии введение ГИБП и/или инъекции/прием иммунодепрессанта прекращаются, прием ранее назначенных ГК следует продолжить.
Возобновление лечения ГИБП и/или иммунодепрессантом проводится после окончания противовоспалительной терапии.
- Рекомендуется проведение эрадикационной терапии с назначением ингибиторов протонного насоса (A02BC), антибактериальных препаратов системного действия (JO1), висмута трикалия дицитрата** в дозе 8 мг/кг/сут. в 1 - 2 приема (для пациентов в возрасте от 4 до 8 лет), в течение 4 - 8 нед., в дозе 120 мг 2 раза/сут. (для пациентов от 8 до 12 лет), в дозе 120 мг 4 раза/сут. или 240 мг 2 раза/сут. (для пациентов старше 12 лет) при воспалительной гастропатии, эрозивных и/или язвенных процессах в желудке, и/или 12-перстной кишке, ассоциированных с Helicobacter pylori, в соответствии с клиническими рекомендациями [184, 187, 188]. (УДД 5, УУР C)
Комментарии: эрадикационная терапия вне возрастных показаний назначается по решению врачебной комиссии, после получения информированного согласия родителей, детей в возрасте >= 15 лет.
- Рекомендуется временная отмена иммунодепрессанта, и/или ГИБП всем пациентам на время проведения эрадикационной терапии [1, 3, 32, 430]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК следует продолжить. Возобновление лечения иммунодепрессантом, и/или ГИБП проводится после окончания эрадикационной терапии.
- Рекомендуется проведение магнитно-резонансной томографии суставов (один сустав) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с целью контроля эффективности терапии [1, 3, 32, 166, 170, 318, 319]. (УДД 1, УУР B)
- Рекомендуется проведение компьютерной томографии органов грудной полости всем пациентам с применением анестезиологического пособия (включая раннее послеоперационное ведение) с целью контроля инфекционной безопасности противоревматической терапии, исключения пневмонии, туберкулеза [32, 88, 90, 200, 201, 212]. (УДД 4, УУР C)
Комментарии: при лечении ГИБП, особенно в сочетании с иммунодепрессантами и ГК, может развиваться пневмония (интерстициальная, очаговая, долевая, полисегментарная).
Интерстициальная пневмония наиболее часто развивается на фоне применения #ритуксимаба**, реже, тоцилизумаба**, крайне редко на фоне лечения ингибиторами ФНО-альфа и абатацепта**.
Интерстициальную пневмонию следует заподозрить при появлении субфебрильной/фебрильной лихорадки, сухого кашля/кашля с незначительным количеством мокроты/одышки, крепитаций/ослабления дыхания при аускультации.
Очаговая или долевая пневмония чаще развивается при применении тоцилизумаба**, ингибиторов ФНО-альфа, реже #ритуксимаба** и абатацепта**.
Для пневмонии, развивающейся в условиях лечения тоцилизумабом**, реже ингибиторами ФНО-альфа характерны субфебрильная лихорадка или ее полное отсутствие, скудная клиническая картина, отсутствие повышения острофазовых показателей воспаления: СОЭ, числа лейкоцитов крови, уровня C-реактивного белка в сыворотке крови.
Очаговую пневмонию следует заподозрить при появлении сухого/влажного кашля/подкашливания.
- Рекомендуется проведение бронхоскопии с применением анестезиологического пособия (включая раннее послеоперационное ведение) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью получения бронхоальвеолярной лаважной жидкости и ее исследования [90, 124, 212, 267, 270, 271, 273, 300, 313, 314]. (УДД 3, УУР B)
- Рекомендуется микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью подтверждения/исключения пневмоцистной этиологии пневмонии и решения вопроса о проведении этиотропной терапии [267, 270 - 273, 276, 277, 279, 280, 301 - 303]. (УДД 4, УУР C)
- Рекомендуется определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью подтверждения/исключения пневмоцистной этиологии пневмонии и решения вопроса о проведении этиотропной терапии [112, 270 - 273, 276 - 278, 301 - 304]. (УДД 4, УУР C)
- Рекомендуется определение антител класса M, G к Pneumocystis jirovecii в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [112, 270 - 273, 276 - 278, 301 - 304, 592]. (УДД 4, УУР C)
- Рекомендуется микробиологическое (культуральное) исследование мокроты на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 267, 270 - 273, 313, 314]. (УДД 3, УУР B)
- Рекомендуется микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 267, 270 - 273, 313, 314]. (УДД 3, УУР B)
- Рекомендуется микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 267, 270 - 273, 313, 314]. (УДД 3, УУР B)
- Рекомендуется определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270 - 273, 282, 313, 314, 593, 594]. (УДД 3, УУР B)
- Рекомендуется определение маннана, галактоманнана в лаважной жидкости и в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [124, 270 - 273, 282, 313, 314, 593, 594]. (УДД 3, УУР B)
- Рекомендуется определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [256 - 259, 267, 270, 271, 273]. (УДД 4, УУР C)
- Рекомендуется определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [116, 124, 267, 270, 271, 311]. (УДД 5, УУР C)
- Рекомендуется определение ДНК Mycobacterium tuberculosis complex (M. tuberculosis, M. bovis, M. bovis BCG) с дифференциацией вида в мокроте, бронхоальвеолярной лаважной жидкости или промывных водах бронхов методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости с целью выявления этиологии пневмонии и решения вопроса о проведении этиотропной терапии [90, 112, 124, 212, 267, 270, 271, 305 - 310, 595]. (УДД 4, УУР C)
- Рекомендуется назначение эмпирической антибактериальной терапии: #ко-тримоксазола** (JO1EE) в комбинации с антибактериальными препаратами системного действия (JO1), влияющими на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз (JO1CR) и/или цефалоспорины 4-го поколения (JO1DE), и/или карбапенемы (JO1DH), и/или другие антибактериальные препараты (JO1X)) в сочетании с противогрибковыми препаратами системного действия (JO2A), в сочетании с противовирусными препаратами системного действия (JO5) до выявления этиологического фактора интерстициальной пневмонии в зависимости от клинической ситуации в соответствии с рекомендациями по лечению пневмонии у иммунокомпрометированных детей с целью предотвращения прогрессирования инфекционного процесса [150, 151, 276, 303, 521, 585 - 589, 596 - 598]. (УДД 5, УУР C)
Комментарии: антибактериальные препараты системного действия (JO1), противогрибковые препараты системного действия (JO2A) и противовирусные препараты системного действия (JO5) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей и детей старше 15 лет.
Введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на время проведения антибактериальной терапии. Прием ранее назначенных ГК перорально следует продолжить. При появлении признаков дыхательной недостаточности пациент переводится в отделение реанимации и интенсивной терапии;
Лечение ГИБП и иммунодепрессантом возобновляется не раньше, чем через 1 нед. после полного купирования пневмонии по данным лабораторных исследований, контрольной компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая ранее послеоперационное ведение) или без его применения и окончания антибактериальной терапии назначение/коррекция ГИБП проводится после купирования клинических рентгенологических и лабораторных признаков интерстициальной пневмонии.
- Рекомендуется назначение таргетной антибактериальной терапии: #ко-тримоксазола** (JO1EE) в комбинации с антибактериальными препаратами системного действия (JO1), влияющими на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз (JO1CR) и/или цефалоспорины 4-го поколения (JO1DE), и/или карбапенемы (JO1DH), и/или другие антибактериальные препараты (JO1X)) в сочетании с противогрибковыми препаратами системного действия (JO2A), в сочетании с противовирусными препаратами системного действия (JO5) при подтверждении этиологического фактора пневмонии в зависимости от клинической ситуации в соответствии с рекомендациями по лечению пневмонии у иммунокомпрометированных детей с целью предотвращения прогрессирования инфекционного процесса [150, 151, 276, 303, 521, 585 - 589, 596 - 598]. (УДД 5, УУР C)
- Рекомендуется назначение ГК внутривенно, #ко-тримоксазола** (JO1EE) в дозе 3,75 - 5,0 мг/кг/массы тела/введение (15 - 20 мг/кг/сут.) (по триметоприму) внутривенно каждые 8 часов при развитии среднетяжелой пневмоцистной пневмонии или в дозе 3,75 - 5,0 мг/кг/массы тела/введение (15 - 20 мг/кг/сут.) (по триметоприму) внутривенно каждые 6 - 8 часов при развитии тяжелой пневмоцистной пневмонии в соответствии с международными рекомендациями по лечению иммунокомпрометированных детей [3, 32, 276, 303]. (УДД 5, УУР C)
Комментарии: #ко-тримоксазол** (JO1EE) вне возрастных показаний назначается по решению врачебной комиссии, после получения информированного согласия родителей. При появлении признаков дыхательной недостаточности пациент переводится в отделение реанимации и интенсивной терапии. Введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на время проведения антибактериальной терапии. Прием ранее назначенных ГК перорально следует продолжить. Лечение ГИБП и иммунодепрессантом возобновляется не раньше, чем через 1 нед. после полного купирования пневмонии по данным лабораторных исследований, контрольной компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения и окончания антибактериальной терапии назначение/коррекция ГИБП проводится после купирования клинических рентгенологических и лабораторных признаков интерстициальной пневмонии.
- Рекомендуется назначение #вориконазола** в дозе 6 мг/кг/введение внутривенно каждые 12 часов в первые 24 часа и 4 мг/кг начиная со вторых суток в соответствии с международными рекомендациями по лечению иммунокомпрометированных детей при выявлении галактаманнана в лаважной жидкости и/или в крови, и/или антител к грибам рода аспергиллы (Aspergillus spp.) в крови [594, 598]. (УДД 5, УУР C)
Комментарии: введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на время проведения антибактериальной терапии. Прием ранее назначенных ГК перорально следует продолжить. При появлении признаков дыхательной недостаточности пациент переводится в отделение реанимации и интенсивной терапии. Лечение ГИБП и иммунодепрессантом возобновляется не раньше, чем через 1 нед. после полного купирования пневмонии по данным лабораторных исследований, контрольной компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения и окончания антибактериальной терапии назначение/коррекция ГИБП проводится после купирования клинических рентгенологических и лабораторных признаков интерстициальной пневмонии.
- Рекомендуется назначение флуконазола** внутривенно в дозе 6 - 12 мг/кг/сут. в соответствии с международными рекомендациями по лечению иммунокомпрометированных детей при выявлении маннана в лаважной жидкости и/или в крови [1, 3, 32, 562]. (УДД 4, УУР C)
Комментарии: введение ГИБП и инъекции/прием иммунодепрессанта прекращаются на время проведения антибактериальной терапии. Прием ранее назначенных ГК перорально следует продолжить. При появлении признаков дыхательной недостаточности пациент переводится в отделение реанимации и интенсивной терапии. Лечение ГИБП и иммунодепрессантом возобновляется не раньше, чем через 1 нед. после полного купирования пневмонии по данным лабораторных исследований, контрольной компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения и окончания антибактериальной терапии назначение/коррекция ГИБП проводится после купирования клинических рентгенологических и лабораторных признаков интерстициальной пневмонии.
- Рекомендуется назначение антибактериальных препаратов системного действия (JO1), влияющих на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз (JO1CR) и/или цефалоспорины 4-го поколения (JO1DE), и/или карбапенемы (JO1DH), и/или другие антибактериальные препараты (JO1X)) в сочетании с противогрибковыми препаратами системного действия (JO2A) при развитии очаговой или долевой пневмонии, или полисегментарной пневмонии в соответствии с клиническими рекомендациями по лечению пневмонии у иммунокомпрометированных детей с целью купирования пневмонии [3, 112, 150, 151, 276, 303, 521, 585 - 589, 596 - 600]. (УДД 5, УУР C)
Комментарии: антибактериальные препараты системного действия (JO1) вне возрастных показаний назначаются по решению врачебной комиссии, после получения информированного согласия родителей.
- Рекомендуется временная отмена терапии иммунодепрессантом и/или ГИБП, всем пациентам, продолжение приема ранее назначенных ГК перорально при подозрении/развитии пневмонии и на весь период проведения этиотропной терапии с целью предотвращения развития токсических реакций и прогрессирования инфекционного процесса [1, 3, 32, 45, 430, 574, 579]. (УДД 5, УУР C)
- Рекомендуется возобновление терапии иммунодепрессантом и/или ГИБП всем пациентам не ранее, чем через 1 нед. после полного купирования пневмонии по данным лабораторных исследований, контрольной компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения, и окончания антибактериальной терапии с целью предотвращения нарастания активности/поддержания ремиссии заболевания [1, 3, 32, 45, 213, 430, 574, 579]. (УДД 5, УУР C)
Комментарии: назначение/коррекция терапии проводится после купирования клинических, рентгенологических и лабораторных признаков интерстициальной пневмонии.
- Рекомендуется проведение рентгенографии височно-нижнечелюстного сустава и/или рентгенографии межпозвоночных сочленений, и/или рентгенографии локтевого сустава, и/или рентгенографии лучезапястного сустава, и/или рентгенографии коленного сустава, и/или рентгенографии плечевого сустава, и/или рентгенографии тазобедренного сустава, и/или рентгенографии голеностопного сустава, и/или рентгенографии акромиально-ключичного сочленения, и/или рентгенографии грудинно-ключичного сочленения, и/или рентгенографии кисти и/или рентгенографии стопы в двух проекциях или компьтерной томографии сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с активным артритом в анамнезе с целью определения степени костно-хрящевой деструкции [1, 3, 32, 163, 167]. (УДД 5, УУР C)
Комментарии: проводится не чаще 1 раза в 12 мес, при наличии показаний раньше.
- Рекомендуется проведение рентгенденситометрии всем пациентам, получающим или получавшим ГК, с целью выявления остеопении/остеопороза [327, 328]. (УДД 5, УУР C)
- Рекомендуется назначение препаратов кальция (A12A) и витамина D и его аналогов (A11CC) пациентам с остеопенией/остеопорозом в соответствии с клиническими рекомендациями по диагностике и лечению вторичного остеопороза у детей с целью предотвращения прогрессирования остеопороза и развития его осложнений [327, 328, 528, 601]. (УДД 5, УУР C)
- Рекомендуется назначение #памидроновой кислоты или #алендроновой кислоты**, или #золедроновой кислоты**, или #ибандроновой кислоты пациентам с остеопенией/остеопорозом с целью лечения остеопороза [328, 512, 602 - 605]. (УДД 5, УУР C)
Комментарии: бифосфонаты (M05BA) назначаются по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей, детей в возрасте >= 15 лет.
- Рекомендуются следующие режимы назначения бифосфонатов (M05BA):
- #памидроновая кислота (максимальная доза 60 мг/введение) [602]:
- пациентам < 1 года в дозе 0,5 мг/кг в/в каждые 2 мес.,
- пациентам в возрасте 1 - 2 лет в дозе 0,25 - 0,5 мг/кг/сут. в/в в течение 3 дней каждые 3 мес.,
- пациентам в возрасте 2 - 3 лет в дозе 0,375 - 0,75 мг/кг/сут. в/в в течение 3 дней каждые 3 мес.,
- пациентам старше 3 лет в дозе 0,5 - 1 мг/кг/сут. в/в в течение 3-х дней каждые 4 мес.
- или #алендроновая кислота** (максимальная доза 70 мг/нед.) [602]:
- в дозе 1 - 2 мг/кг/нед. перорально,
- пациентам с массой тела < 40 кг в дозе 5 мг/сут. или 35 мг/нед.,
- пациентам с массой тела > 40 кг в дозе 10 мг/сут. или 70 мг/нед.
- или #золедроновая кислота** в дозе 0,0125 - 0,05 мг/кг/введение в/в каждые 6 - 12 мес. (максимальная доза 4 мг) [602];
- или #ибандроновая кислота:
- в дозе 3 мг/введение в/в 1 раз в 3 мес. [603]
- или 150 мг перорально 1 раз в мес. [604]
- пациентам с остеопенией/остеопорозом с целью лечения остеопороза [328, 512, 602 - 605]. (УДД 5, УУР C)
Комментарии: бифосфонаты (M05BA) назначаются по жизненным показаниям, по решению врачебной комиссии, после получения информированного согласия родителей, детей в возрасте >= 15 лет.
- Рекомендуется прием (осмотр, консультация) врача-оториноларинголога первичный всем пациентам для выявления очагов хронической инфекции ЛОР органов и решения вопроса об их санации для профилактики инфекционных осложнений в условиях лечения иммунодепрессантами и/или ГИБП в сочетании (или без) с ГК; с целью оценки эффективности санации ЛОР органов у пациентов, у которых она проведена [1, 3, 32, 45, 95, 329, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-стоматолога детского первичный всем пациентам, получающим иммунодепрессанты и/или ГИБП в сочетании (или без) с ГК, с целью определения состояния ротовой полости, решения вопроса о ее санации или оценки ее эффективности [1, 3, 32, 45, 330, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога первичный с обязательной биомикроскопией глаза всем пациентам для исключения увеита, а также пациентам, получающим ГК с целью исключения осложненной катаракты [1, 3, 4, 15, 32, 45, 332, 333, 430]. (УДД 5, УУР C)
Комментарии: дети с высоким риском развития увеита (пациенты с олиго- или полиартритом РФ-, положительным АНФ, ЮАС, началом болезни до 7 лет и длительностью болезни до 4 лет) должны осматриваться врачом-офтальмологом не реже 1 раза в 3 месяца.
Дети со средним и низким риском развития увеита (олиго- и полиартрит РФ+, с отрицательным АНФ, заболевшие после 7 лет и длительностью болезни более 4 лет) должны осматриваться окулистом не реже 1 раза в 6 мес.
На фоне терапии увеита, в том числе местными средствами - осмотр врача-офтальмолога не реже 1 раза в месяц.
У пациентов с осложненной катарактой проводится контроль эффективности терапии и решение вопроса о необходимости оперативного лечения.
- Рекомендуется прием (осмотр, консультация) врача-детского кардиолога первичный пациентам с нарушением сердечной деятельности и/или артериальной гипертензией с целью решения вопроса о проведении кардиотропной и/или гипотензивной терапии [3, 4, 34, 45, 334, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-фтизиатра первичный всем пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или очаговыми, инфильтративными изменениями в легких с целью решения вопроса о проведении химиопрофилактики или противотуберкулезной химиотерапии [1, 3, 4, 45, 45, 86, 88, 91, 92, 213, 580, 581]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-детского эндокринолога первичный пациентам с эндокринологической патологией, в том числе получающих ГК, с целью контроля эффективности терапии [1, 3, 4, 32, 327, 328, 335, 336]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-диетолога первичный пациентам с дефицитом массы тела, амиотрофией, остеопенией/остеопорозом, конституциональным ожирением и синдромом Кушинга, стероидным диабетом с целью разработки индивидуальной программы диетического питания и рекомендаций по пищевому поведению в амбулаторных условиях [1, 3, 32, 45, 340, 341, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-травматолога-ортопеда первичный всем пациентам с функциональной недостаточностью суставов, нарушением роста костей в длину, подвывихах, болью в спине, с целью решения вопроса о проведении реконструктивных операций и протезирования суставов [1, 3, 32, 45, 214, 430, 525]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-невролога первичный всем пациентам с неврологической симптоматикой, отставанием в психомоторном развитии, психотическими реакциями с целью решения вопроса о проведении терапии [1, 3, 4, 32, 45, 216, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-невролога повторный всем пациентам с неврологической симптоматикой, отставанием в психомоторном развитии, психотическими реакциями с целью оценки эффективности проведенной терапии [1, 3, 4, 32, 45, 216, 430]. (УДД 5, УУР C)
- Рекомендуется прием (тестирование, консультация) медицинского психолога первичный всем пациентам с возраста 1 года и их родителям с целью гармонизации процесса формирования детской личности в условиях тяжелого хронического заболевания и оптимизации детско-родительских отношений; повышения приверженности лечению, сотрудничеству с врачом и медицинским персоналом для достижения ремиссии заболевания и психологической адаптации в социуме [1, 3, 32, 221 - 227, 338, 430]. (УДД 2, УУР A)
- Рекомендуется осмотр (консультация) врача-физиотерапевта первичный всем пациентам с функциональной недостаточностью с целью разработки программы физиотерапевтических процедур в рамках индивидуальной программы реабилитации [1, 3, 32, 337, 430, 529 - 531, 606]. (УДД 5, УУР C)
- Рекомендуется осмотр (консультация) врача-физиотерапевта повторный пациентам после программы физиотерапевтических процедур с целью оценки ее эффективности [1, 3, 32, 48, 337, 430, 529, 530, 606]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача по лечебной физкультуре всем пациентам с функциональной недостаточностью с целью разработки комплекса ЛФК в рамках индивидуальной программы реабилитации [1, 3, 32, 337, 430, 529 - 531, 607]. (УДД 1, УУР C)
- Рекомендуется проведение медицинской реабилитации всем пациентам с функциональной недостаточностью с целью восстановления функциональной способности [1, 3, 32, 337, 430, 529 - 541]. (УДД 2, УУР B)
- Рекомендуется прием (осмотр, консультация) врача по лечебной физкультуре повторный всем пациентам с функциональной недостаточностью после окончания программы реабилитации с целью оценки ее эффективности [1, 3, 32, 337, 430, 529 - 531, 607]. (УДД 1, УУР C)
- Рекомендуется, проведение осмотра (консультации) врачом-анестезиологом-реаниматологом первичного пациентам, которым планируется проведение поднаркозных исследований, с целью оценки их состояния [60, 61, 218 - 220]. (УДД 5, УУР C)
- Рекомендуется проведение коррекции противоревматической терапии в ревматологическом отделении стационара, инициировавшем лечение ГИБП и/или иммунодепрессантом при недостижении стадии неактивной болезни через 6 мес., ремиссии - через 12 мес., и далее каждые 6 мес. [1, 3, 32, 430]. (УДД 5, УУР C)
Контроль эффективности терапии - см. Приложения Г1 - Г4
- Рекомендуется проведение коррекции противоревматической терапии в ревматологическом отделении стационара, инициировавшем лечение ГИБП и/или иммунодепрессантом на любом этапе лечения при развитии нежелательных явлений на фоне лечения ГИБП и/или иммунодепрессантом [1, 3, 32, 430]. (УДД 5, УУР C)
5.2.1. Онконастороженность у пациентов с юношеским артритом с системным началом в условиях лечения ГИБП/иммунодепрессантами
Учитывая, что одним из нежелательных эффектов терапии ГИБП являются онкологические/онкогематологические/лимфопролиферативные заболевания, необходимо помнить об онконастороженности на любом этапе лечения (в стационаре и условиях диспансерного наблюдения).
- Рекомендуется соблюдение онконастороженности в связи с возможным развитием онкологических/онкогематологических/лимфопролиферативных заболеваний на фоне терапии ГИБП на любом этапе лечения [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется немедленная отмена иммунодепрессанта/ГИБП и госпитализизация пациента при подозрении на онкологическое/онкогематологическое/лимфопролиферативное заболевание с целью проведения соответствующего обследования [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 5, УУР C)
- Рекомендуется получение цитологического препарата костного мозга с применением анестезиологического пособия (включая раннее послеоперационное ведение) путем пункции и гистологического препарата костного мозга с цитологическим исследованием мазка костного мозга (миелограмма), патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов пациентам, получающим иммунодепрессант и/или ГИБП, с нетипичным течением болезни с целью исключения онкологических/онкогематологических/лимфопролиферативных заболеваний/метастатического поражения костного мозга [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется проведение биопсии лимфатического узла (периферического, по показаниям - внутрибрюшного, внутригрудного) с применением анестезиологического пособия (включая раннее послеоперационное ведение) с цитологическим исследованием препарата тканей лимфоузла и патолого-анатомическим исследованием биопсийного (операционного) материала лимфоузла пациентам с выраженным увеличением размеров периферических и/или внутригрудных, и/или внутрибрюшных лимфатических узлов, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни с целью исключения онкологических/онкогематологических/лимфопролиферативных заболеваний/метастатического поражения лимфатического узла [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 5, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии головного мозга с контрастированием, магнитно-резонансной томографии органов брюшной полости с внутривенным контрастированием, магнитно-резонансной томографии забрюшинного пространства с внутривенным контрастированием и магнитно-резонансной томографии органов малого таза с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни с целью исключения онкологических/онкогематологических/лимфопролиферативных заболеваний [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется проведение компьютерной томографии органов грудной полости с внутривенным болюсным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни с целью исключения метастазов в легких/поражения органов средостения при онкологических/онкогематологических/лимфопролиферативных заболеваниях [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется проведение магнитно-резонансной томографии костной ткани (одна область) и магнитно-резонансной томографии суставов (один сустав) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения с внутривенным контрастированием пациентам, получающим иммунодепрессант и/или ГИБП, с нетипичным течением болезни с целью исключения онкологических/онкогематологических заболеваний [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется проведение компьютерной томографии кости и компьютерной томографии сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП, с очагами деструкции в костях, нетипичными для ЮА с целью исключения онкологических/онкогематологических заболеваний [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется проведение позитронной эмиссионной томографии, совмещенной с компьтерной томографией с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)), с контрастированием, при необходимости, позитронной эмиссионной томографии всего тела с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП с выраженной артралгией, миалгией, оссалгией, деструктивными изменениями в костях, инфильтратами в подкожно-жировой клетчатке, очагами в паренхиматозных органах, головном мозге, спинном мозге с целью исключения онкологических/онкогематологических/лимфопролиферативных заболеваний [1, 3, 32, 168, 210]. (УДД 5, УУР C)
- Рекомендуется проведение сцинтиграфии полипозиционной костей с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП, с очагами деструкции в костях, нетипичными для ЮА с целью исключения злокачественных новообразований/метастатического поражения костей [1, 3, 32, 168, 169, 210]. (УДД 5, УУР C)
- Рекомендуется проведение трепанобиопсии костей таза под контролем компьютерной томографии с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов; цитологическим исследованием отпечатков трепанобиоптата костного мозга; иммуноцитохимическим исследованием отпечатков трепанобиоптата костного мозга; иммунофенотипированием гемопоэтических клеток-предшественниц в костном мозге пациентам, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни с целью исключения гемобластозов/лимфопролиферативных заболеваний/метастатического поражения костного мозга [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется проведение биопсии кости с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическое исследованием биопсийного (операционного) материала костной ткани пациентам, получающим иммунодепрессант и/или ГИБП, с очагами деструкции в костях, не типичными для ЮА, с целью исключения злокачественных новообразований/метастатического поражения костей [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-детского онколога первичный пациентам, у которых по результатам обследования заподозрено/выявлено онкологическое/онкогематологическое/лимфопролиферативное заболевание, либо метастатическое поражение с целью решения вопроса о переводе ребенка в профильное учреждение для дальнейшего обследования и лечения [3, 32, 81, 168, 169, 204 - 208, 608]. (УДД 4, УУР C)
5.3. Контрольное обследование в рамках диспансерного наблюдения в амбулаторно-поликлинических условиях
- Рекомендуется прием (осмотр, консультация) врача-ревматолога первичный всем пациентам с ЮА с выполнением оценки эффективности и безопасности терапии [1, 3, 32, 430].
(УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-ревматолога повторный (с оценкой эффективности и безопасности терапии не реже 1 раза в мес. после инициации/коррекции терапии и не реже одного раза в 3 мес. после достижения ремиссии заболевания, с оценкой необходимости направления на внеплановую госпитализацию в ревматологическое отделение стационара, инициировавшего терапию генно-инженерным биологическим препаратом и/или иммунодепрессантом на любом этапе лечения при развитии обострения/осложнений, сопутствующих заболеваний, осложнений/побочных эффектов/стойкой непереносимости терапии и направлением на плановую госпитализацию в ревматологическое отделение стационара, инициировавшего терапию генно-инженерным биологическим препаратом и/или иммунодепрессантом через 3 и 6 мес. после назначения/коррекции терапии и далее каждые 6 мес. и с проведением дистанционной консультации с врачом-ревматологом стационара, инициировавшего назначение терапии, всем пациентам при развитии любых признаков неэффективности и/или непереносимости терапии) [1, 3, 32, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-педиатра всем пациентам с целью обеспечения преемственности терапии и направления на медико-социальную экспертизу [1, 3, 32, 430, 618]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-педиатра или диспансерный прием (осмотр, консультация) врача-педиатра участкового пациентам с юношеским артритом при отсутствии врача-ревматолога по месту жительства не реже 1 раза в мес. после инициации/коррекции терапии и не реже одного раза в 3 мес. после достижения ремиссии заболевания с целью организации диспансерного наблюдения, оценки эффективности и безопасности терапии [1, 3, 32, 430, 618]. (УДД 5, УУР C)
Комментарии: в соответствии с Порядком диспансерного наблюдения за детьми с ревматическими заболеваниями при отсутствии врача-ревматолога по месту жительства пациента, диспансерное наблюдение осуществляется врачом-педиатром участковым, врачом-педиатром или врачом общей практики (семейным врачом) медицинской организации.
- Рекомендуется переключение первично назначенных иммунодепрессанта и/или селективного иммунодепрессанта на дженерик, и/или ГИБП на биоаналог исключительно при доказанной терапевтической эффективности и безопасности дженерика или биоаналога у педиатрической популяции пациентов с аналогичной нозологической формой [342 - 344]. (УДД 5, УУР C)
Комментарии: в настоящее время зарегистрированы биоаналоги (биосимиляры) ингибиторов фактора некроза опухоли альфа (ФНО-альфа) анти-ФНО, а также дженерики ингибиторов янус-киназ, которые эквивалентны им по строению. Часть из этих препаратов в клинических испытаниях у взрослых пациентов показали схожую с оригинальными препаратами эффективность [345].
В детской популяции с юношеским артритом клинические испытания бионалагов и дженериков иммунодепрессантов и селективных иммунодепрессантов не проводились.
Показание к применению у детей и подростков с юношеским артритом в возрасте от 2 до 17 лет и с массой тела менее 62,5 кг имеет только лекарственный препарат этанерцепт "лиофилизат для приготовления раствора для подкожного введения". Лекарственный препарат этанерцепт "раствор для подкожного введения" имеет противопоказание к применению - детский возраст младше 12 лет и с массой тела менее 62,5 кг [408 - 411].
Согласно письму разъяснению ФАС N ТН/109573/21 от 22.12.2021 и медицинским инструкциям по применению лекарственного препарата Этанерцепт [412]:
использование лекарственной формы "раствор для подкожного введения" вместо "лиофилизат для приготовления раствора для подкожного введения" у детей младше 12 лет и массой тела менее 62,5 кг не признается приемлемым в связи с различиями в конечной концентрации растворов и отсутствии исследований, позволяющих оценить переносимость, эффективность и фармакокинетику применения у детей раствора в дозировке 50 мг/мл. Таким образом, замена лекарственной формы "лиофилизат для приготовления раствора для подкожного введения" у данного пациента является невозможной.
Оригинальный иммунодепрессант и/или селективный иммунодепрессант, и/или ГИБП не могут автоматически заменяться на дженерик и биоаналог. Замена препаратов может осуществляться только на основе консенсуса лечащего врача, инициировавшего терапию иммунодепрессантом и/или селективным иммунодепрессантом, и/или ГИБП, после получения информированного согласия родителей и детей старше 15 лет.
Автоматическая замена первично назначенного иммунодепрессанта и/или селективного иммунодепрессанта, и/или ГИБП может привести к "ускользанию" терапевтического эффекта и развитию нежелательных явлений [342 - 344].
- Рекомендуется немедленное прекращение инфузии/инъекции ГИБП и/или инъекции/приема иммунодепрессанта в случае развития аллергической реакции любой степени выраженности [1, 3, 32, 430, 609]. (УДД 4, УУР C)
Комментарии: аллергическая реакция может возникнуть на любом этапе лечения ГИБП и/или иммунодепрессантом.
- Рекомендуется назначение антигистаминных средств системного действия и/или ГК при развитии аллергической реакции на введение ГИБП и/или иммунодепрессанта [1, 3, 32, 430, 609]. (УДД 4, УУР C)
Комментарии: выбор препарата и путь его введения зависит от тяжести аллергической реакции.
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при развитии аллергической реакции на прием и/или введение ГИБП и/или иммунодепрессанта с целью принятия решения о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32, 430, 609]. (УДД 4, УУР C)
- Рекомендуется экстренная госпитализация при развитии аллергической реакции на прием и/или введение ГИБП, и/или иммунодепрессанта с целью принятия решения о необходимости коррекции терапии [1, 3, 32, 430, 609]. (УДД 4, УУР C)
- Рекомендуется общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови) всем пациентам не реже 1 раза в 2 - 4 нед. с целью контроля активности заболевания и побочных действий противоревматических препаратов на костный мозг [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется отмена иммунодепрессанта и/или ГИБП, продолжение приема ранее назначенных ГК перорально при снижении числа тромбоцитов <= 150 > 100 x 109/л, числа нейтрофилов < 1,5 >= 1,0 x 109/л по данным общего (клинического) анализа крови развернутого с целью предотвращения развития инфекционных осложнений [1, 3, 32, 574, 579]. (УДД 5, УУР C)
Комментарии: общий (клинический) анализ крови развернутый повторить через нед.
- Рекомендуется назначение колониестимулирующего фактора #филграстима** (LO3AA) в дозе 5 - 10 мкг/кг/сут. подкожно при снижении уровня лейкоцитов с абсолютным числом нейтрофилов < 1,0 x 109/л в течение 3 - 5 дней (при необходимости - дольше) с целью нормализации числа лейкоцитов крови [1, 3, 32, 430, 517 - 519]. (УДД 5, УУР C)
Комментарии: детям в возрасте < 1 года #филграстим** (LO3AA) назначается по решению врачебной комиссии, после получения информированного согласия родителей и разрешения локального этического комитета медицинской организации.
Нейтропения чаще развивается при применении #ритуксимаба** и тоцилизумаба**, реже - абатацепта**, ингибиторов ФНО-альфа, а также иммунодепрессантов.
- Рекомендуется назначение колониестимулирующего фактора #филграстима** (LO3AA) в дозе 5 - 10 мкг/кг/сут. подкожно, срочная госпитализация в стационар по месту жительства, назначение антибактериальных препаратов системного действия (J01) внутривенно при развитии фебрильной нейтропении (нейтропения, сопровождающаяся лихорадкой) с абсолютным числом нейтрофилов < 1,0 x 109/л с целью нормализации числа лейкоцитов крови и предотвращения развития инфекционных осложнений [1, 3, 32, 430, 517 - 519]. (УДД 5, УУР C)
Комментарии: прием ранее назначенных ГК перорально следует продолжить.
- Рекомендуется продолжение терапии иммунодепрессантом и/или ГИБП в прежней дозе после нормализации показателей общего (клинического) анализа крови и повышения числа нейтрофилов крови >= 1,5 x 109/л с целью предотвращения нарастания активности/поддержания ремиссии заболевания [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется назначение флуконазола** 3 - 12 мг/кг/сут., в зависимости от выраженности и длительности сохранения индуцированной нейтропении, перорально пациентам с нейтропенией с целью профилактики грибковых инфекций, развившихся результате лечения иммунодепрессантами и/или ГИБП [1, 3, 32, 430, 562]. (УДД 4, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, всем пациентам при повторном эпизоде снижения числа нейтрофилов, развитии фебрильной нейтропении и/или снижения числа тромбоцитов крови по данным общего (клинического) анализа крови с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови сыворотки крови всем пациентам не реже 1 раза в 2 - 4 нед. с целью контроля активности заболевания, функции печени, почек, поджелудочной железы, электролитного баланса в условиях проведения иммуносупрессивной и генно-инженерной биологической терапии [1, 3, 32, 574, 579]. (УДД 5, УУР C)
Комментарии: при повышении уровня ферритина крови >= 684 нг/мл, триглицеридов, активности АЛТ, АСТ, ЛДГ в крови в сочетании с двухростковой цитопенией необходимо заподозрить развитие гемофагоцитарного синдрома и срочно направить ребенка на госпитализацию в ревматологическое отделение стационара.
- Рекомендуется временная отмена терапии иммунодепрессантом, и/или ГИБП, продолжение приема ранее назначенных ГК при повышении активности АЛТ, АСТ в крови выше верхней границы нормы >= 1,5 раза и/или других биохимических показателей выше верхней границы нормы перорально с целью предотвращения прогрессирования токсической реакции [1, 3, 32]. (УДД 5, УУР C)
Комментарии: повторить биохимический анализ крови общетерапевтический следует через неделю.
- Рекомендуется продолжение терапии иммунодепрессантом и/или ГИБП в той же дозе после нормализации биохимического(их) показателя(ей) с целью предотвращения нарастания активности/поддержания ремиссии заболевания [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при наличии данных о повторных эпизодах повышения биохимического(их) показателя(ей) с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется определение содержания ревматоидного фактора (РФ) в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-CCP) в крови, не реже 1 раз в 3 мес. пациентам с серопозитивным ЮА с целью оценки иммунологической активности заболевания [1, 3, 4, 65, 68, 70, 71]. (УДД 5, УУР C)
- Рекомендуется определение содержания антител к антигенам ядра клетки и ДНК в крови всем пациентам, получающим ингибиторы ФНО-альфа, не реже 1 раз в 3 мес. с целью оценки иммунологической активности заболевания и контроля побочных эффектов, развивающихся в условиях лечения иммунодепрессантом и ГИБП [1, 3, 574, 610]. (УДД 5, УУР C)
Комментарии: содержание антител к антигенам ядра клетки и ДНК в сыворотке крови повышается у пациентов, получающих ингибиторы ФНО-альфа (чаще адалимумаб**) при развитии нежелательного явления - волчаночно-подобной реакции.
- Рекомендуется отмена терапии ингибитором ФНО-альфа, продолжение приема ранее назначенных иммунодепрессанта подкожно или перорально и/или ГК перорально при повышении содержания антител к антигенам ядра клетки и ДНК в сыворотке крови с целью предотвращения развития лекарственной волчанки [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при повышении содержания антител к антигенам ядра клетки и ДНК в сыворотке крови с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32].
Комментарии: при нарастании титра аутоантител, решение о необходимости коррекции терапии и условиях, в которых следует ее проводить, принимает врач-ревматолог стационара, инициировавшего назначение терапии по итогам приема (осмотра, консультации, в том числе дистанционной) врача-ревматолога стационара, инициировавшего назначение терапии.
- Рекомендуется исследование уровня C-реактивного белка в сыворотке крови всем пациентам не реже 1 раза в 3 мес. с целью контроля активности основного заболевания и развития инфекционных осложнений [1, 3, 4, 43, 44, 65, 68]. (УДД 3, УУР C)
Комментарий: при неактивной стадии болезни/ремиссии и отсутствии инфекционных осложнений уровень C-реактивного белка в сыворотке крови соответствует референсным значениям.
Уровень C-реактивного белка в сыворотке крови повышается при развитии инфекционного осложнения и обострении основного заболевания.
Проводится прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии.
Решение о необходимости коррекции терапии в условиях, в которых следует ее проводить, принимает врач-ревматолог стационара, инициировавшего назначение терапии, по итогам консультации (в том числе дистанционной).
- Рекомендуется исследование уровня иммуноглобулинов в крови не реже 1 раз в 3 мес. всем пациентам проведение с целью выявления/исключения иммунодефицитного состояния, развивающегося в условиях лечения иммунодепрессантом и ГИБП [1, 3, 4, 65, 574]. (УДД 5, УУР C)
Комментарии: снижение уровня иммуноглобулинов крови развивается при вторичном иммунодефицитном состоянии, преимущественно на фоне лечения #ритуксимабом** в условиях деплеции В лимфоцитов.
- Рекомендуется временная отмена терапии иммунодепрессантом и/или ГИБП, продолжение приема ранее назначенных ГК перорально при снижении уровня иммуноглобулинов крови с целью предотвращения развития инфекционных осложнений [1, 3, 32, 574, 579]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при снижении иммуноглобулинов крови с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется госпитализация в стационар пациентам со снижением уровня иммуноглобулинов крови с целью проведения заместительной терапии #иммуноглобулином человека нормальным** [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется определение антистрептолизина-O в сыворотке крови с целью выявления/исключения инфицированности  гемолитическим стрептококком группы A не реже 1 раза в 3 мес. [1, 3, 32, 44]. (УДД 5, УУР C)
гемолитическим стрептококком группы A не реже 1 раза в 3 мес. [1, 3, 32, 44]. (УДД 5, УУР C)
Комментарии: повышение уровня антистрептолизина-O в сыворотке крови свидетельствует об острой или хронической стрептококковой инфекции.
- Рекомендуется проявлять настороженность в отношении возможного развития инфекционных заболеваний у пациентов с ЮА, получающих ГИБП и/или иммунодепрессанты в сочетании или без ГК [1, 3, 32, 44, 582]. (УДД 5, УУР C)
- Рекомендуется временная отмена терапии иммунодепрессантом и/или ГИБП, продолжение приема ранее назначенных ГК перорально всем пациентам при появлении признаков инфекционного осложнения [1, 3, 32, 44, 578]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, всем пациентам при появлении признаков инфекционного осложнения с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32, 44, 578]. (УДД 5, УУР C)
- Рекомендуется экстренная госпитализация в стационар при подозрении/развитии пневмонии [1, 3, 32, 44]. (УДД 5, УУР C)
Комментарии: интерстициальная пневмония наиболее часто развивается на фоне применения #ритуксимаба**, реже - других иммунодепрессантов и ГИБП.
Пневмонию следует заподозрить при появлении субфебрильной/фебрильной лихорадки, сухого/влажного кашля/подкашливания и/или появлении субфебрильной/фебрильной лихорадки, не связанной с обострением основного заболевания, и/или одышки/затруднении дыхания, и/или крепитаций/ослабления дыхания при аускультации.
Ребенок срочно госпитализируется в ревматологическое отделение стационара для диагностики и лечения (см. выше).
- Рекомендуется временная отмена терапии иммунодепрессантом и/или ГИБП, продолжение приема ранее назначенных ГК перорально всем пациентам при подозрении/развитии пневмонии [1, 3, 32, 44, 578]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, всем пациентам при подозрении/развитии пневмонии с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32, 44]. (УДД 5, УУР C)
- Рекомендуется назначение #ацикловира** (JO5AB) в дозе 200 мг перорально 5 раз в сутки детям в возрасте старше 2 лет (не более 1000 мг/сут.) в соответствии с клиническими рекомендациями по лечению герпесвирусных инфекций у детей, в том числе имеющих иммунокомпрометированный статус, при развитии локальной герпетической инфекции [3, 32, 507, 508]. (УДД 5, УУР C)
Комментарии: детям в возрасте < 3 лет #ацикловир** (JO5AB) назначается по решению врачебной комиссии, после получения информированного согласия родителей.
Прием ранее назначенных ГК перорально следует продолжить.
Лечение противовирусными препаратами прямого и системного действия проводится до полного купирования вирусной инфекции и окончания противовирусной терапии.
Лечение #ацикловиром** проводится в течение 7 - 10 дней до полного исчезновения герпетических высыпаний.
- Рекомендуется временная отмена терапии иммунодепрессантом, и/или ГИБП, продолжение приема ранее назначенных ГК перорально при развитии инфекции, вызванной герпес-вирусами, на весь период проведения противовирусной терапии с целью предотвращения развития токсических реакций и прогрессирования инфекционного процесса [1, 3, 32, 574, 579]. (УДД 5, УУР C)
- Рекомендуется госпитализация в стационар всем пациентам при генерализации герпетической инфекции/подозрении на развитие цитомегаловирусной/Эпштейна-Барр вирусной инфекции с целью решения вопроса о дальнейшей тактике пациента [1, 3, 32]. (УДД 5, УУР C)
Комментарии: проводится прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, с целью решения вопроса о дальнейшем ведении пациента.
- Рекомендуется возобновление терапии иммунодепрессантом, и/или ГИБП в той же дозе всем пациентам не ранее, чем через 1 нед. после полного купирования клинических и лабораторных признаков герпетической инфекции и окончания противовирусной терапии продолжение с целью предотвращения нарастания активности/поддержания ремиссии заболевания [1, 3, 32, 574, 579]. (УДД 5, УУР C)
- Рекомендуется проведение очаговой пробы с туберкулином (реакция Манту, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**) всем пациентам не реже 1 раза в 6 мес. (по показаниям - чаще) с целью исключения инфицированности микобактериями туберкулеза на фоне противоревматической терапии [1, 3, 32, 44, 88, 90 - 92, 212, 430, 580, 581, 609]. (УДД 4, УУР C)
- Рекомендуется проведение общего (клинического) анализа мочи, исследование мочи методом Нечипоренко не реже 1 раза в мес. всем пациентам с целью контроля состояния функции почек с целью контроля состояния функции почек [1, 3, 32, 44]. (УДД 5, УУР C)
Комментарии: микрогематурия, редко макрогематурия развивается как нежелательное явление лечения метотрексатом**.
- Рекомендуется отмена терапии метотрексатом**, продолжение терапии ГИБП, приема ранее назначенных ГК перорально при появлении гематурии с целью предотвращения прогрессирования поражения почек [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при появлении гематурии с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32]. (УДД 5, УУР C)
- Рекомендуется проведение регистрации электрокардиограммы всем пациентам не реже 1 раза в 3 мес. в рамках диспансерного наблюдения с целью контроля за состоянием сердечно-сосудистой системы [1, 3, 32, 34]. (УДД 5, УУР C)
- Рекомендуется проведение ультразвукового исследования органов брюшной полости (комплексное), эхокардиографии, ультразвукового исследования почек всем пациентам не реже 1 раза в 6 мес. в рамках диспансерного наблюдения с целью контроля активности болезни и нежелательных явлений противоревматической терапии [1, 3, 4, 32]. (УДД 5, УУР C)
- Выполнен прием (осмотр, консультация) врача-оториноларинголога первичный (пациентам с патологией ЛОР-органов, не позднее чем через 7 дней после выписки из стационара) с целью выявления очагов хронической инфекции ЛОР органов и решения вопроса об их санации, а также с целью диагностики острой инфекции ЛОР органов, развившейся в условиях противоревматической терапии [1, 3, 32, 95, 329]. (УДД 5, УУР C)
- Выполнен диспансерный прием (осмотр, консультация) врача-оториноларинголога (не реже 1 раза в 6 мес.) с целью контроля за состоянием ЛОР органов, раннего выявления патологии, ее лечения и профилактики развития инфекционных осложнений в условиях противоревматической терапии [1, 3, 32, 95, 329]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-детского кардиолога первичный по медицинским показаниям с целью разработки индивидуальной программы терапии на основе рекомендаций врача-детского кардиолога стационара [1, 3, 32, 34, 334]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-детского кардиолога по медицинским показаниям с целью контроля эффективности индивидуальной программы терапии, разработанной на основе рекомендаций врача-детского кардиолога стационара [1, 3, 32, 34, 334]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-стоматолога детского первичный пациентам, которым необходима санация очагов хронической инфекции и лечение острой инфекции ротовой полости с целью выявления воспалительных изменений в полости рта [1, 3, 32, 215, 330, 331]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-стоматолога детского по медицинским показаниям с целью раннего выявления патологии ротовой полости, ее лечения, и профилактики развития инфекционных осложнений в условиях противоревматической терапии [1, 3, 32, 215, 330, 331]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога первичный (с проведением биомикроскопии глаза не позднее чем через 7 дней после выписки из стационара при наличии офтальмологической патологии) с целью разработки индивидуальной программы лечения на основе рекомендаций врача офтальмолога стационара [1, 3, 15, 332, 333, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-офтальмолога повторный с обязательной биомикроскопией глаза всем пациентам с офтальмологической патологией по индивидуальным показаниям с целью контроля эффективности лечения и при необходимости его коррекции [1, 3, 15, 332, 333, 430]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-офтальмолога (с проведением биомикроскопии глаза, не реже 1 раза в 3 мес.) с целью контроля за состоянием органа зрения [1, 3, 15, 332, 333, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-диетолога первичный по медицинским показаниям с целью разработки индивидуальной программы диетического питания [1, 3, 32, 340, 341, 527]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-диетолога повторный по индивидуальным показаниям с целью контроля/коррекции индивидуальной программы диетического питания [340, 341, 527]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-фтизиатра первичный (при наличии положительной очаговой пробы и/или внутрикожной пробы с туберкулезным аллергеном с туберкулином, и/или с инфильтративными очагами в легких) с целью решения вопроса о проведении химиопрофилактики или противотуберкулезной терапии [1, 3, 32, 86, 88, 91, 92, 213, 430, 581]. (УДД 5, УУР C)
Комментарии: решение о необходимости коррекции терапии условиях, в которых следует ее проводить, принимает врач-ревматолог стационара, инициировавшего назначение терапии, по итогам консультации (в том числе дистанционной).
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, пациентам с положительной внутрикожной пробой с туберкулином для решения вопроса о возможности продолжения лечения ГИБП и/или иммунодепрессантом [1, 3, 32, 86, 88, 91, 92, 213, 430, 581]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-фтизиатра повторный пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или очаговыми, инфильтративными изменениями в легких с целью контроля/коррекции химиопрофилактики или противотуберкулезной химиотерапии [1, 3, 32, 86, 88, 91, 92, 213, 430, 581]. (УДД 5, УУР C)
Комментарии: решение о необходимости коррекции терапии, условиях, в которых следует ее проводить, принимает врач-ревматолог стационара, инициировавшего назначение терапии по итогам консультации (в том числе дистанционной).
- Рекомендуется прием (осмотр, консультация) врача-детского эндокринолога первичный по медицинским показаниям с целью назначения индивидуальной программы, рекомендованной врачом-детским эндокринологом стационара [1, 3, 32, 327, 328, 335, 336, 430]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-детского эндокринолога по медицинским показаниям с целью контроля/коррекции индивидуальной программы, рекомендованной врачом-детским эндокринологом стационара [1, 3, 32, 327, 328, 335, 336, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-травматолога-ортопеда первичный по медицинским показаниям с целью решения вопроса о необходимости ортопедической коррекции [1, 3, 32, 214, 430]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-травматолога-ортопеда повторный по медицинским показаниям с целью контроля эффективности ортопедической коррекции [1, 3, 32, 214, 430]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача-травматолога-ортопеда по медицинским показаниям с целью выявления функциональных нарушений и контроля проведения ортопедической коррекции [1, 3, 32, 214, 430]. (УДД 5, УУР C)
- Рекомендуется прием (тестирование, консультация) медицинского психолога первичный по медицинским показаниям с целью разработки программы психологической реабилитации для пациента и его родителей [1, 3, 32, 221, 222, 337 - 339]. (УДД 5, УУР C)
- Рекомендуется прием (тестирование, консультация) медицинского психолога повторный по медицинским показаниям после завершения программы психологической реабилитации с целью оценки ее эффективности [1, 3, 32, 221, 222, 337 - 339]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (тестирование, консультация) медицинского психолога по медицинским показаниям с целью тестирования психологического состояния пациентов и их родителей [1, 3, 32, 221, 222, 337 - 339]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача-физиотерапевта первичный по медицинским показаниям с целью разработки программы физиотерапевтических процедур на основе рекомендаций врача-физиотерапевта стационара [1, 3, 32, 337, 529 - 531, 606]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача по лечебной физкультуре первичный по медицинским показаниям с целью разработки индивидуальной программы реабилитации на основе рекомендаций врача по лечебной физкультуре стационара [1, 3, 32, 337, 529 - 531]. (УДД 5, УУР C)
- Рекомендуется проведение медицинской реабилитации всем пациентам с функциональной недостаточностью в рамках индивидуальной программы реабилитации [1, 3, 32, 337, 430, 529 - 541]. (УДД 2, УУР B)
- Рекомендуется прием (осмотр, консультация) врача-физиотерапевта повторный всем пациентам, выполнившим программу медицинской реабилитации, с целью контроля ее эффективности [1, 3, 32, 337, 529 - 531, 606] (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация) врача по лечебной физкультуре повторный всем пациентам, выполнившим программу медицинской реабилитации, с целью контроля ее эффективности [1, 3, 32, 337, 529 - 531]. (УДД 5, УУР C)
- Рекомендуется диспансерный прием (осмотр, консультация) врача по лечебной физкультуре по медицинским показаниям с целью контроля эффективности/коррекции программы реабилитации [1, 3, 32, 337, 529 - 531]. (УДД 5, УУР C)
Комментарии: проводится всем пациентам с ЮА
- Рекомендуется плановая госпитализация в ревматологическое отделение стационара, инициировавшего терапию ГИБП и/или иммунодепрессанта, всех пациентов через 3 и 6 мес. после назначения терапии и далее каждые 6 мес. с целью контроля эффективности и безопасности терапии [1, 3, 4, 32]. (УДД 5, УУР C)
Комментарии: плановый контроль эффективности проводится через 3 и 6 мес после назначения терапии и далее каждые 6 мес для контроля эффективности и безопасности противоревматической терапии.
- Рекомендуется внеплановая госпитализация по показаниям в ревматологическое отделение стационара, инициировавшего назначение ГИБП/иммунодепрессанта с целью обследования и коррекции терапии на любом этапе лечения при развитии обострения/осложнений с ЮА, сопутствующих заболеваний, осложнений/побочных эффектов/стойкой непереносимости ГИБП/иммунодепрессанта [1, 3, 4, 32]. (УДД 5, УУР C)
- Рекомендуется проведение контроля эффективности ГИБП и/или иммунодепрессанта с целью своевременного решения вопроса о "переключении" на иммунодепрессант и/или ГИБП с другим механизмом действия с целью достижения ремиссии заболевания, предотвращения развития осложнений болезни и прогрессирования инвалидизации пациента [347, 423, 611]. (УДД 5, УУР C)
Комментарии: контроль эффективности противовоспалительных и противоревматических препаратов проводится не реже 1 раза в мес., особое внимание уделяется развитию вторичной неэффективности. Вторичная неэффективность ГИБП и/или иммунодепрессанта проявляется "ускользанием" эффекта и нарастанием активности заболевания на любом этапе лечения. При развитии вторичной неэффективности проводится срочный прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии.
Решение о необходимости коррекции терапии, условиях, в которых следует ее проводить, принимает врач-ревматолог стационара, инициировавшего назначение терапии по итогам консультации (в том числе дистанционной).
Контроль эффективности терапии - см. Приложения Г1 - Г4
- Рекомендуется проведение контроля переносимости ГИБП и/или иммунодепрессанта всем пациентам с целью предотвращения развития тяжелых токсических осложнений, своевременной отмены препарата и "переключение" на иммунодепрессант и/или ГИБП с другим механизмом действия [1, 3, 32, 347, 423, 609, 611, 612]. (УДД 5, УУР C)
Комментарии: непереносимость ГИБП и/или иммунодепрессанта может развиться на любом этапе лечения. При развитии непереносимости вне зависимости от степени выраженности ГИБП и/или иммунодепрессант отменяется. Прием ранее назначенных ГК перорально следует продолжить.
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии всем пациентам при развитии любых признаков непереносимости иммунодепрессанта и/или ГИБП с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32, 574]. (УДД 5, УУР C)
- Рекомендуется прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при повышении клинических и/или лабораторных показателей активности заболевания и/или развитии любых признаков непереносимости иммунодепрессанта, и/или ГИБП, с целью решения вопроса о необходимости коррекции терапии и условиях, в которых следует ее проводить [1, 3, 32]. (УДД 5, УУР C)
6. Организация оказания медицинской помощи
6.1. Показания к госпитализации и выписке пациентов.
Подозрение на ЮА.
Проведение диагностики, в том числе дифференциальной диагностики и назначение противоревматической терапии всем пациентам проводится в условиях ревматологического отделения стационара.
Показания к выписке
- Завершение обследования; постановка диагноза ЮА.
- Назначение противоревматической терапии.
- Отсутствие побочных эффектов, непереносимости.
- Стабилизация состояния на фоне лекарственной терапии: купирование лихорадки, других системных проявлений, снижение активности суставного синдрома.
- Выраженная тенденция к нормализации/нормализация лабораторных показателей активности.
Установленный диагноз ЮА, активная стадия.
Обследование и коррекция терапии при ее неэффективности всем пациентам проводится в условиях ревматологического отделения стационара.
Показания к выписке
- Завершение обследования.
- Коррекция терапии.
- Отсутствие побочных эффектов, непереносимости лекарственных препаратов. Стабилизация состояния на фоне лекарственной терапии: купирование лихорадки, других системных проявлений, снижение активности суставного синдрома.
- Выраженная тенденция к нормализации/нормализация лабораторных показателей активности.
Установленный диагноз ЮА, с активным гемофагоцитарным синдромом.
Диагностика, в том числе дифференциальная диагностика, и назначение терапии всем пациентам, внутривенное введение лекарственных средств, в том числе генно-инженерных биологических препаратов (противоревматических препаратов) проводится в условиях ревматологического отделения стационара.
Показания к выписке
- Завершение обследования.
- Назначение терапии.
- Отсутствие побочных эффектов, непереносимости лекарственных препаратов.
- Стабилизация состояния на фоне лекарственной терапии: купирование лихорадки, других системных проявлений, снижение активности суставного синдрома.
- Купирование клинических и лабораторных признаков гемофагоцитарного синдрома.
- Выраженная тенденция к нормализации/нормализация лабораторных показателей активности ЮА.
Установленный диагноз ЮА в стадии ремиссии.
Контроль эффективности и безопасности противоревматической терапии проводится в условиях ревматологического отделения стационара через 3 мес после назначения терапии; через 6 мес после назначения терапии; далее каждые 6 мес.
Показания к выписке
- 50% улучшение по критериям АКРпеди/стадия неактивной болезни по критериям C. Wallace через 3 мес.
- Стадия неактивной болезни через 6 мес; ремиссия по критериям C. Wallace через 12 мес и далее каждые 6 мес
- Отсутствие нежелательных явлений/непереносимости лекарственных препаратов
Установленный диагноз ЮА вне зависимости от стадии.
Обследование и коррекция терапии при развитии осложнений/непереносимости медикаментозного лечения проводится в условиях ревматологического отделения стационара.
Показания к выписке
- Завершение обследования.
- Купирование побочных эффектов.
- Коррекция терапии.
- Отсутствие побочных эффектов, непереносимости лекарственных препаратов.
- Отсутствие признаков активности заболевания.
Пациент с установленным диагнозом ЮА при развитии обострения/осложнений болезни, сопутствующих заболеваний, осложнений/побочных эффектов/стойкой непереносимости ГИБП/иммунодепрессанта должен быть в неотложном порядке госпитализирован в ревматологическое отделение стационара, инициировавшего назначение ГИБП/иммунодепрессанта, для обследования и коррекции терапии на любом этапе лечения.
Показания к проведению пациентам с юношеским артритом противоревматической терапии, в том числе генно-инженерными биологическими препаратами (внутримышечное и подкожное введение лекарственных средств) в медицинской организации (детском ревматологическом отделении в условиях круглосуточного стационара и (или) дневного стационара; процедурном кабинете медицинской организации, оказывающей первичную медико-санитарную помощь; процедурном кабинете фельдшерско-акушерского пункта (в случае отсутствия детского ревматологического кабинета):
Невозможность самостоятельного введения генно-инженерных биологических препаратов (внутримышечное и подкожное введение лекарственных средств) в домашних условиях родителями (законными представителями) и (или) самим пациентом в возрасте старше 15 лет, связанная с низкой комплаентностью и отсутствием навыков введения лекарственного средства.
Показания к проведению консультации с медицинской организацией федерального подчинения, в том числе с применением телемедицинских технологий:
назначение и (или) замена генно-инженерных биологических препаратов и (или) селективных иммунодепрессантов в сочетании или без пульс-терапии глюкокортикоидами, и (или) иммунодепрессантов, и (или) высокодозного иммуноглобулина человека нормального пациентам с юношеским артритом с системным началом высокой/средней степени активности воспалительного процесса, и (или) резистентностью к проводимому лекарственному лечению.
6.2. Нормативно-правовые документы, в соответствии с которыми оказывается медицинская помощь детям с юношеским артритом:
1. Приказ Министерства здравоохранения Российской Федерации от 07 октября 2015 г. N 700н (ред. от 09.12.2019 г.) "О номенклатуре специальностей специалистов, имеющих высшее медицинское и фармацевтическое образование", (Зарегистрирован в Министерстве юстиции Российской Федерации 12 ноября 2015 года, регистрационный N 39696).
2. Приказ Министерства здравоохранения РФ от 2 мая 2023 г. N 206н "Об утверждении Квалификационных требований к медицинским и фармацевтическим работникам с высшим образованием", (Зарегистрирован в Министерстве юстиции Российской Федерации 01 июня 2023 года, регистрационный N 73677).
3. Приказ Министерства здравоохранения Российской Федерации от 25 октября 2012 г. N 441н "Об утверждении Порядка оказания медицинской помощи детям по профилю "ревматология" (с изменениями на 21 февраля 2020 г.).
4. Приказ Министерства здравоохранения РФ от 21 апреля 2022 года N 274н "Об утверждении Порядка оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями" (Зарегистрировано в Министерстве юстиции Российской Федерации 13 июля 2022 года, регистрационный N 69251).
5. Приказ Министерства здравоохранения Российской Федерации от 23 октября 2019 г. N 878н "Об утверждении Порядка организации медицинской реабилитации детей", (Зарегистрирован в Министерстве юстиции Российской Федерации 23 декабря 2019 г., регистрационный N 56954).
6. Приказ Министерства здравоохранения Российской Федерации от 19.03.2021 г. N 231н (ред. от 21.02.2022 г.) "Об утверждении Порядка проведения контроля объемов, сроков, качества и условий предоставления медицинской помощи по обязательному медицинскому страхованию застрахованным лицам, а также ее финансового обеспечения" (Зарегистрирован в Министерстве юстиции Российской Федерации 13 мая 2021 г. N 63410).
7. Приказ Минздрава России от 28.02.2019 г. N 108н (ред. от 13.12.2022 г.) "Об утверждении Правил обязательного медицинского страхования" (Зарегистрирован в Министерстве юстиции Российской Федерации 17 мая 2019 года N 54643).
8. Приказ Министерства здравоохранения Российской Федерации от 13.12.2022 N 789н "О внесении изменений в Правила обязательного медицинского страхования, утвержденные приказом Министерства здравоохранения Российской Федерации от 28 февраля 2019 г. N 108н". (Зарегистрирован в Министерстве юстиции Российской Федерации 30 декабря 2022 г. N 71905).
9. Поправка 14.1. к Статье 37. Организация оказания медицинской помощи Федерального закона от 21.11.2011 N 323-ФЗ (ред. от 11.06.2022, с изм. от 13.07.2022) "Об основах охраны здоровья граждан в Российской Федерации" (с изм. и доп., вступ. в силу с 29.06.2022 г.) "В стандарты медицинской помощи детям и клинические рекомендации допускается включение зарегистрированного на территории Российской Федерации лекарственного препарата, применяемого в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению, в случае соответствия такого лекарственного препарата требованиям, установленным Правительством Российской Федерации. Перечень заболеваний или состояний (групп заболеваний или состояний), при которых допускается применение лекарственного препарата в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению, устанавливается Правительством Российской Федерации.
10. Распоряжение Правительства Российской Федерации от 16 мая 2022 г. N 1180-р "Перечень заболеваний или состояний (группы заболеваний или состояний), при которых допускается применение лекарственного препарата в соответствии с показаниями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению".
11. Постановление Правительства Российской Федерации от 27 октября 2023 г. N 1799 "Об утверждении требований к зарегистрированному на территории Российской Федерации лекарственному препарату, применяемому в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению, включение которого допускается в стандарты медицинской помощи детям и клинические рекомендации".
12. Приказ Министерства здравоохранения Российской Федерации от 23 сентября 2020 г. N 1008н "Об утверждении порядка обеспечения пациентов лечебным питанием" (Зарегистрирован в Министерстве юстиции Российской Федерации 30 сентября 2020 г., регистрационный N 60137).
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Рекомендуется направлять детей в бюро медико-социальной экспертизы для оформления статуса "ребенок-инвалид". Диагноз при направлении на МСЭ устанавливается в соответствии с рекомендациями (см. пункт 1.5).
Присвоение статуса "ребенок инвалид" детям с ЮА проводится в соответствии со следующими нормативно-правовыми документами:
1. Постановление Правительства РФ от 05.04.2022 N 588 (ред. 12.03.2024 г.) "О признании лица инвалидом" (в ред. Постановлений Правительства РФ от 23.11.2022 N 2121, 77, от 24.01.2023 N 77, от 10.11.2023 N 1887, от 28.11.2023 N 2003, от 12.04.2024 N 289).
2. Приказ Министерства труда и социального развития РФ от 27 августа 2019 г. N 585н (ред. 06.11.2021 г.) "О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы"
3. Подпункт 5.2.105 Положения о Министерстве труда и социальной защиты Российской Федерации, утвержденного постановлением Правительства Российской Федерации от 19 июня 2012 г. N 610 (Собрание законодательства Российской Федерации, 2012, N 26, ст. 3528; 2013, N 22, ст. 2809; N 36, ст. 4578; N 37, ст. 4703; N 45, ст. 5822; N 46, ст. 5952; 2014, N 21, ст. 2710; N 26, ст. 3577; N 29, ст. 4160; N 32, ст. 4499; N 36, ст. 4868; 2015, N 2, ст. 491; N 6, ст. 963; N 16, ст. 2384; 2016, N 2, ст. 325; N 4, ст. 534; N 23, ст. 3322; N 28, ст. 4741; N 29, ст. 4812; N 43, ст. 6038; N 47, ст. 6659; 2017, N 1, ст. 187; N 7, ст. 1093; N 17, ст. 2581; N 22, ст. 3149; N 28, ст. 4167; 2018, N 10, ст. 1494; N 24, ст. 3530; N 36, ст. 5634; N 46, ст. 7052; N 49, ст. 7600; N 53, ст. 8678; 2019, N 1, ст. 31; N 5, ст. 408; N 21, ст. 2563)
4. Приложение N 2 к классификациям и критериям, используемым при осуществлении медико-социальной экспертизы федеральными государственными учреждениями медико-социальной экспертизы, утвержденным приказом Министерства труда и социальной защиты Российской Федерации от 27 августа 2019 г. N 585н
Количественная система оценки степени выраженности стойких нарушений функций организма ребенка младше 18 лет, обусловленных заболеваниями, последствиями травм или дефектами (в процентах, применительно к клинико-функциональной характеристике стойких нарушений функций организма человека)
При наличии статуса "ребенок-инвалид" ребенок и его родители будут иметь права на ряд социальных услуг; льготный проезд; льготы на лечебные аппараты, инструменты, лекарства; льготы при поступлении в среднее и высшее учебные заведения; бесплатный проезд ребенку и сопровождающему его взрослому до места лечения (санаторий, курорт) и обратно; ежегодную путевку на санаторно-курортное лечение ребенку и взрослому, который его сопровождает.
В случае несвоевременного обеспечения ребенка с ЮА патогенетическим ГИБП, высока вероятность развития обострения/повышения активности заболевания, развития полиорганной недостаточности, прогрессирования поражения суставов и функциональной недостаточности пациента.
7.1. Исходы и прогноз
Олигоартикулярный юношеский артрит. Приблизительно у 40% пациентов развивается ремиссия. Более чем у 50% пациентов сохраняется активность болезни, у 40% из них олигоартрит трансформируется в полиартрит, но число пораженных суставов меньше, чем при полиартрите в дебюте заболевания. При длительном течении болезни после клинической ремиссии может развиться остеоартрит. Смертность очень низкая. У 10% больных с увеитом развивается слепота [1, 529, 613].
Факторы неблагоприятного прогноза (АКР, 2011) при олигоартикулярном ЮИА: Поражение тазобедренных суставов или шейного отдела позвоночника, поражение голеностопного или лучезапястного сустава, значительное или продолжительное повышение лабораторных показателей, деструкция суставов по данным радиологического обследования (эрозии суставных поверхностей или сужение межсуставных щелей) [347, 348, 423, 550].
Полиартикулярный РФ-негативный юношеский артрит. Течение артрита у большинства пациентов относительно доброкачественное. У 10% пациентов развиваются тяжелые деструктивные изменения, в основном в тазобедренных и челюстно-височных суставах. Все дети с ранним дебютом полиартикулярного ЮИА РФ-негативного имеют неблагоприятный прогноз, высокий риск развития тяжелого деструктивного артрита, инвалидизации по состоянию опорно-двигательного аппарата [347, 348, 423, 550].
Фактор неблагоприятного прогноза (АКР, 2011): поражение тазобедренных суставов.
Все дети с полиартикулярным ЮИА РФ-позитивным имеют неблагоприятный прогноз, высокий риск развития тяжелого деструктивного артрита, инвалидизации по состоянию опорно-двигательного аппарата. При своевременно начатой адекватной терапии частота ремиссии составляет до 65%. Летальные исходы связаны в первую очередь с развитием амилоидоза.
Факторы неблагоприятного прогноза при полиартикулярном РФ-позитивном ЮИА (АКР, 2011):
- Поражение тазобедренных суставов, положительный РФ или наличие АЦЦП [347, 348, 423, 550].
Факторы неблагоприятного прогноза течения увеита, ассоциированного с ЮА [31].
- Дебют увеита в раннем возрасте
- Короткий интервал между дебютом артрита и увеита (< 6 мес 2)
- Развитие увеита до дебюта артрита
- Высокая активность воспаления (> 2+ количества клеток во влаге передней камеры в период дебюта заболевания)
- Первично-осложненное течение в дебюте увеита
- Непрерывное течение увеита, короткая ремиссия
Наличие осложнений:
- Развитие синехий
- Высокая активность воспаления (> 2+ количества клеток в передней камере)
- Плотная инфильтрация стекловидного тела
- Катаракта
- Глаукома
- Макулярный отек
Критерии оценки качества медицинской помощи
Организационно-технические условия оказания медицинской помощи.
|
Вид медицинской помощи
|
Специализированная медицинская помощь
|
|
Условия оказания медицинской помощи
|
Стационарно/в дневном стационаре
|
|
Форма оказания медицинской помощи
|
Плановая
|
Таблица 1. Критерии оценки качества первичной диагностики для установления диагноза юношеский артрит.
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнена диагностика, в том числе дифференциальная диагностика, всем пациентам с подозрением на ЮА в условиях ревматологического стационара
|
C
|
|
2
|
Выполнен общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови)
|
C
|
|
3
|
Выполнено определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня протеина C в крови, определение активности протеина S в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение активности антитромбина III в крови пациентам с признаками васкулита
|
C
|
|
4
|
Выполнена тромбоэластография пациентам с признаками васкулита
|
C
|
|
5
|
Выполнено определение основных групп по системе AB0, определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy, определение антигена D системы Резус (резус-фактор) перед проведением инвазивных исследований (эзофагогастродуоденоскопия, колоноскопия с биопсией, получение цитологического препарата костного мозга путем пункции, цитологическое исследование отпечатков трепанобиоптата костного мозга, биопсия кости)
|
C
|
|
6
|
Выполнено исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня холестерина, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови
|
C
|
|
7
|
Выполнено исследование уровня C-реактивного белка в сыворотке крови
|
C
|
|
8
|
Выполнено определение содержания антител к антигенам ядра клетки и ДНК в крови; определение содержания ревматоидного фактора (РФ) в крови, определение маркеров ANCA-ассоциированных васкулитов: PR3 (c-ANCA), МПО (p-ANCA), определение содержания антицентромерных антител в крови, определение содержания антител к РНК в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-ССР) в крови; определение содержания антинуклеарных антител к Sm-антигену в крови; определение содержания антител к РНК-полимеразе (Ro-антигену) и протеину, входящему в состав РНК (La-антигену) в крови, определение содержания антител к фосфолипидам в крови, определение содержания антител к кардиолипину в крови, определение содержания антител к бета-2-гликопротеину в крови, определение содержания антител к Scl-70 в крови, исследование уровня C3, C4 фракции комплемента
|
C
|
|
9
|
Выполнено исследование уровня иммуноглобулинов в крови
|
C
|
|
10
|
Выполнено определение антистрептолизина-O в сыворотке крови
|
C
|
|
11
|
Выполнено определение HLA-антигенов (антигена HLA-B27)
|
C
|
|
12
|
Выполнен комплекс исследований для диагностики криопирин-ассоциированных синдромов и других аутовоспалительных синдромов пациентам с лихорадкой, сыпью, увеитом, а также детям с ранним началом и нетипичным течением болезни
|
C
|
|
13
|
Выполнено исследование популяций лимфоцитов пациентам, часто болеющим вирусными, гнойными бактериальными инфекциями, в том числе оппортунистическими инфекциями
|
C
|
|
14
|
Выполнена очаговая проба с туберкулином (реакция Манту, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**) и исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови
|
C
|
|
15
|
Выполнено определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci) в крови; определение антител к хламидии пневмонии (Chlamydophila pneumoniae) в крови, определение антител класса G (IgG) к хламидии трахоматис (Chlamydia trachomatis) в крови, определение антител классов M, G (IgM, IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови
|
C
|
|
16
|
Выполнено определение антител к сальмонелле кишечной (Salmonella enterica) в крови, определение антител к сальмонелле тифи (Salmonella typhi) в крови, определение антител классов M, G (IgM, IgG) к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis) в крови, определение антител к сероварам иерсинии энтероколитика (Yersinia enterocolitica) в крови
|
C
|
|
17
|
Выполнено определение антител классов M, G (IgM, IgG) к шигелле Боуди (Shigella boydii) в крови, определение антител классов M, G (IgM, IgG) к шигелле дизентерии (Shigella dysenteriae) в крови, определение антител классов M, G (IgM, IgG) к шигелле Зонне (Shigella sonnei) в крови, определение антител классов M, G (IgM, IgG) к шигелле Флекснера (Shigella flexneri) в крови
|
C
|
|
18
|
Выполнено определение дезоксирибонуклеиновой кислоты (ДНК) возбудителей иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови методом ПЦР; определение антител класса M (IgM) к возбудителям иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови; определение антител класса G (IgG) к возбудителям иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови, определение суммарных антител к возбудителям иксодовых клещевых боррелиозов группы Borrelia burgdorferi sensu lato в крови пациентам, у которых есть анамнестические данные о походе в лес, проживании в районах, эндемичных по распространению клеща, укусе клеща с целью исключения боррелиоза
|
C
|
|
19
|
Выполнено определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче пациентам с лихорадкой
|
C
|
|
20
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР качественное исследование пациентам с лихорадкой
|
C
|
|
21
|
Выполнено определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче пациентам с клиническими признаками активной герпетической инфекции и/или лихорадкой
|
C
|
|
22
|
Выполнено определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови пациентам с лихорадкой
|
C
|
|
23
|
Выполнено определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови пациентам с лихорадкой
|
C
|
|
24
|
Выполнено определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с лихорадкой
|
C
|
|
25
|
Выполнено определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с лихорадкой
|
C
|
|
26
|
Выполнено определение антител к вирусу простого герпеса (Herpes simplex virus) в крови пациентам с клиническими признаками герпетической инфекции и/или лихорадкой
|
C
|
|
27
|
Выполнено молекулярно-биологическое исследование крови на токсоплазмы (Toxoplasma gondii) пациентам, у которых есть данные о наличии контакта с животными
|
B
|
|
28
|
Выполнено определение антител к лейшмании (Leischmania) в крови пациентам, у которых есть данные о пребывании в эндемичных районах
|
B
|
|
29
|
Выполнено молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus) и молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) пациентам с клиническими и лабораторными признаками гепатита
|
C
|
|
30
|
Выполнено определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) и определение антител к вирусу гепатита C (Hepatitis C virus) в крови пациентам с клиническими и лабораторными признаками гепатита
|
C
|
|
31
|
Выполнено определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови пациентам с признаками иммунодефицита
|
C
|
|
32
|
Выполнено исследование уровня прокальцитонина в крови пациентам с лихорадкой
|
C
|
|
33
|
Выполнено микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы пациентам с лихорадкой
|
C
|
|
34
|
Выполнено микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы
|
C
|
|
35
|
Выполнено проведение общего (клинического) анализа мочи, исследование мочи методом Нечипоренко
|
C
|
|
36
|
Выполнено исследование уровня кальпротектина в кале
|
C
|
|
37
|
Выполнено комплексное ультразвуковое исследование (УЗИ) внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек)
|
C
|
|
38
|
Выполнена эхокардиография
|
C
|
|
39
|
Выполнена регистрация электрокардиограммы
|
C
|
|
40
|
Выполнено ультразвуковое исследование сустава
|
C
|
|
41
|
Выполнена рентгенография височно-нижнечелюстного сустава и/или рентгенография межпозвоночных сочленений, и/или рентгенография локтевого сустава, и/или рентгенография лучезапястного сустава, и/или рентгенография коленного сустава, и/или рентгенография плечевого сустава, и/или рентгенография тазобедренного сустава, и/или рентгенография голеностопного сустава, и/или рентгенография акромиально-ключичного сочленения, и/или рентгенография грудинно-ключичного сочленения, и/или рентгенография кисти и/или рентгенография стопы в двух проекциях или компьютерная томография сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с поражением суставов
|
C
|
|
42
|
Выполнена компьютерная томография сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с моно-олигоартритом, нетипичными для ЮА изменениями по данным МРТ
|
C
|
|
43
|
Выполнена магнитно-резонансная томография суставов (один сустав) с контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с артритом
|
A
|
|
44
|
Выполнена магнитно-резонансная томография позвоночника (один отдел), компьютерная томография позвоночника (один отдел), компьютерная томография костей таза с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с жалобами на боли в спине, наличием энтезопатий (по данным физикального осмотра), пациентам с положительным HLA-B27, при подозрении на юношеский анкилозирующий спондилит
|
C
|
|
45
|
Выполнено ультразвуковое исследования слюнных желез пациентам с положительным РФ и/или АЦЦП, пациентам с подозрением на развитие синдрома Шегрена
|
C
|
|
46
|
Выполнено магнитно-резонансная томография мягких тканей головы с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с положительным РФ и/или АЦЦП, пациентам с подозрением на развитие синдрома Шегрена
|
C
|
|
47
|
Выполнена эзофагогастродуоденоскопия с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
C
|
|
48
|
Выполнено микробиологическое (культуральное) исследование биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений по данным эзофагогастродуоденоскопии
|
C
|
|
49
|
Выполнена биопсия пищевода с помощью эндоскопии, биопсия желудка с помощью эндоскопии, биопсия двенадцатиперстной кишки с помощью эндоскопии, биопсия тощей кишки с помощью эндоскопии при наличии воспалительных и/или эрозивных, и/или язвенных изменений слизистой оболочки с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения с патолого-анатомическим исследованием биопсийного (операционного) материала пищевода, патолого-анатомическим исследованием биопсийного (операционного) материала желудка, патолого-анатомическим исследованием биопсийного (операционного) материала двенадцатиперстной кишки, патолого-анатомическим исследованием материала тощей кишки пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений слизистой оболочки
|
C
|
|
50
|
Выполнена колоноскопия с применением анестезиологического пособия (включая раннее послеоперационное ведение)
|
C
|
|
51
|
Выполнена биопсия толстой кишки с помощью эндоскопии и патолого-анатомическим исследованием биопсийного (операционного) материала толстой кишки пациентам, с воспалительными и/или эрозивными, и/или язвенными изменениями толстой кишки по данным колоноскопии
|
C
|
|
52
|
Выполнена тонкокишечная эндоскопия видеокапсульная пациентам с клиническими признаками воспалительных заболеваний кишечника и/или повышением уровня кальпротектина в кале при отсутствии изменений по данным эзофагогастродуоденоскопии и колоноскопии
|
C
|
|
53
|
Выполнена компьютерная томография органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
C
|
|
54
|
Выполнена магнитно-резонансная томография головного мозга с контрастированием, магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием, магнитно-резонансная томография забрюшинного пространства с внутривенным контрастированием, магнитно-резонансная томография органов малого таза с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов
|
C
|
|
55
|
Выполнена компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием, компьютерная томография забрюшинного пространства с внутривенным болюсным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения при наличии противопоказаний к проведению МРТ
|
C
|
|
56
|
Выполнено получение цитологического препарата костного мозга путем пункции и гистологического препарата костного мозга с применением анестезиологического пособия (включая раннее послеоперационное ведение) с цитологическим исследованием мазка костного мозга (миелограмма), патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов
|
C
|
|
57
|
Выполнена биопсия лимфатического узла (периферического, по показаниям - внутрибрюшного, внутригрудного) с применением анестезиологического пособия (включая раннее послеоперационное ведение) с цитологическим исследованием препарата тканей лимфоузла и патолого-анатомическим исследованием биопсийного (операционного) материала лимфоузла пациентам с выраженным увеличением размеров периферических и/или внутригрудных, и/или внутрибрюшных лимфатических узлов
|
C
|
|
58
|
Выполнена позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)) с контрастированием, при необходимости, позитронная эмиссионная томография всего тела с туморопротропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами (V09)) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с выраженной артралгией, миалгией, оссалгией, деструктивными изменениями в костях, инфильтратами в подкожно-жировой клетчатке, очагами в паренхиматозных органах, головном мозге, спинном мозге
|
C
|
|
59
|
Выполнена сцинтиграфия полипозиционная костей с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с очагами деструкции в костях, не типичными для ЮА
|
C
|
|
60
|
Выполнена трепанобиопсия костей таза под контролем компьютерной томографии с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов; цитологическим исследованием отпечатков трепанобиоптата костного мозга; иммуноцитохимическим исследованием отпечатков трепанобиоптата костного мозга; иммунофенотипированием гемопоэтических клеток-предшественниц в костном мозге пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов
|
C
|
|
61
|
Выполнена биопсия кости с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костной ткани пациентам с очагами деструкции в костях, не типичными для ювенильного артрита
|
C
|
|
62
|
Выполнен прием (осмотр, консультация) врача-детского онколога первичный пациентам, у которых по результатам обследований заподозрено онкологическое или онко-гематологическое заболевание
|
C
|
|
63
|
Выполнен прием (осмотр, консультация) врача-фтизиатра первичный пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или инфильтративными очагами в легких
|
C
|
|
64
|
Выполнен прием (осмотр, консультация) врача-травматолога-ортопеда первичный пациентам с объемными и деструктивными изменениями, а также с деформациями в костях, не типичными для ЮА
|
C
|
|
65
|
Выполнен прием (осмотр, консультация) врача-оториноларинголога первичный
|
C
|
|
66
|
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный с обязательной биомикроскопией глаза
|
C
|
|
67
|
Выполнен прием (осмотр, консультация) врача-стоматолога детского первичный
|
C
|
|
68
|
Выполнен прием (осмотр, консультация) врача-невролога первичный пациентам с неврологической симптоматикой выраженным болевым синдромом, отставанием в психомоторном развитии, психотическими реакциями
|
C
|
|
69
|
Выполнен прием (осмотр, консультация) врача сурдолога-оториноларинголога первичный и проведение аудиограммы пациентам с подозрением на аутовоспалительные синдромы
|
C
|
|
70
|
Выполнен осмотр (консультация) врача-анестезиолога-реаниматолога первичный пациентам, которым планируется проведение поднаркозных исследований
|
C
|
|
71
|
Выполнен осмотр (консультация) врача-анестезиолога-реаниматолога первичный всем пациентам, находящимся в тяжелом состоянии
|
C
|
|
72
|
Выполнено суточное наблюдение врачом-анестезиологом-реаниматологом всех пациентов, находящихся в критическом состоянии (полиорганная недостаточность, ГФС)
|
C
|
|
73
|
Выполнен прием (тестирование, консультация) медицинского психолога первичный всем пациентам с возраста 1 года и их родителям (вне зависимости от возраста ребенка)
|
A
|
Таблица 2. Критерии оценки качества диагностики гемофагоцитарного синдрома
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнена диагностика, в том числе дифференциальная диагностика, всем пациентам при подозрении на вторичный гемофагоцитарный синдром в условиях ревматологического стационара
|
C
|
|
2
|
Выполнен общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови)
|
C
|
|
3
|
Выполнено определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня протеина C в крови, определение активности протеина S в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение, активности антитромбина III в крови
|
C
|
|
4
|
Выполнена тромбоэластография
|
C
|
|
5
|
Выполнено исследование уровня гепарина в крови
|
C
|
|
6
|
Выполнено исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови
|
C
|
|
7
|
Выполнено исследование уровня C-реактивного белка в сыворотке крови
|
C
|
|
8
|
Выполнено микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы, микробиологическое (культуральное) исследование кала на аэробные и факультативно-анаэробные микроорганизмы с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам
|
C
|
|
9
|
Выполнено определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci); определение антител к хламидии трахоматис (Chlamydia trachomatis); определение антител к хламидии пневмонии (Chlamydophila pheumoniae) в крови; определение антител классов M, G (IgM, IgG) в крови к микоплазме пневмонии (Mycoplasma pneumoniae) в крови
|
C
|
|
10
|
Выполнено определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
11
|
Выполнено определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче
|
C
|
|
12
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР качественное исследование
|
C
|
|
13
|
Выполнено определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче
|
C
|
|
14
|
Выполнено определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови
|
C
|
|
15
|
Выполнено определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови
|
C
|
|
16
|
Выполнено определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
|
C
|
|
17
|
Выполнено определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
|
C
|
|
18
|
Выполнено определение антител к вирусу простого герпеса (Herpes simplex virus) в крови
|
C
|
|
19
|
Выполнено микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы с применением автоматизированного посева с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
20
|
Выполнено определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
21
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
22
|
Выполнено определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
23
|
Выполнено определение антител класса M, G к Pneumocystis jirovecii в крови при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
24
|
Выполнено микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii) при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
25
|
Выполнено микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные) при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
26
|
Выполнено определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в сыворотке крови методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
27
|
Выполнено определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в бронхоальвеолярном лаваже методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
28
|
Выполнено исследование уровня прокальцитонина в крови
|
C
|
|
29
|
Выполнены общий (клинический) анализ мочи, определение альбумина в моче, определение количества белка в суточной моче
|
C
|
|
30
|
Выполнено комплексное ультразвуковое исследование внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек)
|
C
|
|
31
|
Выполнена эхокардиография
|
C
|
|
32
|
Выполнена регистрация электрокардиограммы
|
C
|
|
33
|
Выполнена компьютерная томография органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
C
|
|
34
|
Выполнена магнитно-резонансная томография головного мозга с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам неврологической симптоматикой
|
C
|
|
35
|
Выполнена магнитно-резонансная томография органов брюшной полости, магнитно-резонансная томография забрюшинного пространства и магнитно-резонансная томография органов малого таза с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам при развитии полиорганной недостаточности
|
C
|
|
36
|
Выполнено получение цитологического препарата костного мозга путем пункции с применением анестезиологического пособия (включая раннее послеоперационное ведение) и гистологического препарата костного мозга с цитологическим исследованием мазка костного мозга (миелограмма), патологоанатомическим исследованием биопсийного (операционного) материала костного мозга
|
C
|
|
37
|
Выполнен прием (осмотр, консультация) врача-невролога первичный пациентам с неврологической симптоматикой
|
C
|
|
38
|
Выполнен осмотр (консультация) врача-анестезиолога-реаниматолога первичный пациентам, которым планируется проведение поднаркозных исследований
|
C
|
|
39
|
Выполнен осмотр (консультация) врача-анестезиолога-реаниматолога первичный пациентам, находящимся в тяжелом/критическом состоянии
|
C
|
|
40
|
Выполнено суточное наблюдение врачом-анестезиологом-реаниматологом пациентов, с панцитопенией, моноорганной и полиорганной недостаточностью, поражением ЦНС
|
C
|
|
41
|
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный пациентам с геморрагическим синдромом
|
C
|
Таблица 3. Критерии оценки качества обследования пациентов с уставленным диагнозом юношеский артрит перед назначением/коррекцией противоревматической терапии
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнено обследование перед назначением/коррекцией терапии всем пациентам с установленным диагнозом ЮА, активная стадия в условиях ревматологического стационара
|
C
|
|
2
|
Выполнен общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови)
|
C
|
|
3
|
Выполнено определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня протеина C в крови, определение активности протеина S в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение активности антитромбина III в крови пациентам с признаками васкулита
|
C
|
|
4
|
Выполнено исследование уровня гепарина в крови пациентам с признаками васкулита
|
C
|
|
5
|
Выполнена тромбоэластография пациентам с признаками васкулита
|
C
|
|
6
|
Выполнено исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы в крови
|
C
|
|
7
|
Выполнено определение основных групп по системе AB0, определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy, определение антигена D системы Резус (резус-фактор) всем пациентам перед проведением инвазивных исследований (эзофагогастрододеноскопия, колоноскопия с биопсией, биопсия почки) или гемотрансфузий
|
C
|
|
8
|
Выполнено исследование уровня прокальцитонина в крови всем пациентам с лихорадкой
|
C
|
|
9
|
Выполнено исследование уровня C-реактивного белка в сыворотке крови
|
C
|
|
10
|
Выполнено определение антистрептолизина-O в сыворотке крови
|
C
|
|
11
|
Выполнено определение содержания ревматоидного фактора (РФ) в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-CCP) в крови, определение содержания антител к антигенам ядра клетки и ДНК
|
C
|
|
12
|
Выполнено исследование популяций лимфоцитов всем пациентам, получающим #ритуксимаб**, а также пациентам, часто болеющим вирусными, гнойными бактериальными инфекциями, в том числе оппортунистическими инфекциями
|
C
|
|
13
|
Выполнена очаговая проба с туберкулином (реакция Манту, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**) и исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови
|
C
|
|
14
|
Выполнено определение антител к сальмонелле кишечной (Salmonella enterica) в крови, определение антител к сальмонелле тифи (Salmonella typhi) в крови, определение антител классов M, G (IgM, IgG) к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis) в крови, определение антител к сероварам иерсинии энтероколитика (Yersinia enterocolitica) в крови
|
C
|
|
15
|
Выполнено определение антител классов M, G (IgM, IgG) к шигелле Боуди (Shigella boydii) в крови, определение антител классов M, G (IgM, IgG) к шигелле дизентерии (Shigella dysenteriae) в крови, определение антител классов M, G (IgM, IgG) к шигелле Зонне (Shigella sonnei) в крови, определение антител классов M, G (IgM, IgG) к шигелле Флекснера (Shigella flexneri) в крови
|
C
|
|
16
|
Выполнено определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci); определение антител к хламидии трахоматис (Chlamydia trachomatis); определение антител к хламидии пневмонии (Chlamydophila pheumoniae) в крови; определение антител классов M, G (IgM, IgG) в крови к микоплазме пневмонии (Mycoplasma pneumoniae)
|
C
|
|
17
|
Выполнено определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекцией и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
18
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР, качественное исследование пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
19
|
Выполнено определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями герпетической инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
20
|
Выполнено определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
21
|
Выполнено определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
22
|
Выполнено определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
23
|
Выполнено определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
24
|
Выполнено определение антител к вирусу простого герпеса (Herpes simplex virus) в крови пациентам с клиническими признаками герпетической инфекции, и/или с лихорадкой, и/или получающим #ритуксимаб**
|
C
|
|
25
|
Выполнено микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
26
|
Выполнено определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование, всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
27
|
Выполнено определение ДНК Mycobacterium tuberculosis complex (M. tuberculosis, M. bovis, M. bovis BCG) с дифференциацией вида в мокроте, бронхоальвеолярной лаважной жидкости или промывных водах бронхов методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
28
|
Выполнено определение антител класса M, G к Pneumocystis jirovecii в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
29
|
Выполнено определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
30
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
31
|
Выполнено микробиологическое (культуральное) исследование мокроты на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
32
|
Выполнено микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
33
|
Выполнено микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
34
|
Выполнено определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
35
|
Выполнено определение маннана, галактоманнана в лаважной жидкости и крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
36
|
Выполнено определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в сыворотке крови методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
37
|
Выполнено определение маннанового антигена грибов рода Candida albicans и галактоманнанового антигена грибов рода аспергилл (Aspergillus spp.) в бронхоальвеолярном лаваже методом иммуноферментного анализа при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
38
|
Выполнено микробиологическое (культуральное) исследование слизи с миндалин и с задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы
|
C
|
|
39
|
Выполнено микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы пациентам с фебрильной и гектической лихорадкой
|
C
|
|
40
|
Выполнены общий (клинический) анализ мочи, исследование мочи методом Нечипоренко
|
C
|
|
41
|
Выполнено исследование уровня кальпротектина в кале пациентам с клиническими проявлениями воспалительных заболеваний кишечника
|
C
|
|
42
|
Выполнено комплексное ультразвуковое исследование (УЗИ) внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек)
|
C
|
|
43
|
Выполнена эхокардиография
|
C
|
|
44
|
Выполнена регистрация электрокардиограммы
|
C
|
|
45
|
Выполнено холтеровское мониторирование сердечного ритма пациентам с аритмией, патологическими изменениями по данным электрокардиограммы
|
C
|
|
46
|
Выполнено суточное мониторирование артериального давления пациентам с артериальной гипертензией
|
C
|
|
47
|
Выполнено ультразвуковое исследование сустава всем пациентам с активным артритом
|
C
|
|
48
|
Выполнена рентгенография височно-нижнечелюстного сустава и/или рентгенография межпозвоночных сочленений, и/или рентгенография локтевого сустава, и/или рентгенография лучезапястного сустава, и/или рентгенография коленного сустава, и/или рентгенография плечевого сустава, и/или рентгенография тазобедренного сустава, и/или рентгенография голеностопного сустава, и/или рентгенография акромиально-ключичного сочленения, и/или рентгенография грудинно-ключичного сочленения, и/или рентгенография кисти и/или рентгенография стопы в двух проекциях или компьютерная томография сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с активным артритом
|
C
|
|
49
|
Выполнена магнитно-резонансная томография суставов (один сустав) с контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с активным артритом
|
A
|
|
50
|
Выполнена магнитно-резонансная томография позвоночника (один отдел), компьютерная томография позвоночника (один отдел), компьютерная томография костей таза с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с жалобами на боли в спине, наличием энтезопатий (по данным физикального осмотра) при подозрении на юношеский анкилозирующий спондилит
|
C
|
|
51
|
Выполнена магнитно-резонансная томография головного мозга с контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с неврологической симптоматикой
|
C
|
|
52
|
Выполнена магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием, магнитно-резонансная томография забрюшинного пространства с внутривенным контрастированием, магнитно-резонансная томография органов малого таза с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов
|
C
|
|
53
|
Выполнена компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием, компьютерная томография забрюшинного пространства с внутривенным болюсным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения при наличии противопоказаний к проведению МРТ пациентам с тяжелым общим состоянием, лихорадкой и несоответствием общего состояния поражению суставов
|
C
|
|
54
|
Выполнена эзофагогастродуоденоскопия с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
C
|
|
55
|
Выполнена биопсия желудка/двенадцатиперстной кишки с помощью эндоскопии с патолого-анатомическим исследованием биопсийного (операционного) материала желудка и микробиологическим (культуральным) исследованием биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) при наличии воспалительных и/или эрозивных, и/или язвенных изменений слизистой оболочки
|
C
|
|
56
|
Выполнена бронхоскопия с применением анестезиологического пособия (включая раннее послеоперационное ведение) пациентам с поражением легких
|
B
|
|
57
|
Выполнена компьютерная томография органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
C
|
|
58
|
Выполнена рентгенденситометрия пациентам, получающим или получавшим ГК
|
C
|
|
59
|
Выполнено проведение флоуметрии дыхания всем пациентам с поражением легких
|
C
|
|
60
|
Выполнен прием (осмотр, консультация) врача-оториноларинголога первичный
|
C
|
|
61
|
Выполнен прием (осмотр, консультация) врача-стоматолога детского первичный
|
C
|
|
62
|
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный с обязательной биомикроскопией глаза
|
C
|
|
63
|
Выполнен прием (осмотр, консультация) врача - детского кардиолога первичный пациентам с нарушением сердечной деятельности и/или артериальной гипертензией
|
C
|
|
64
|
Выполнен прием (осмотр, консультация) врача-фтизиатра первичный пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или очаговыми, инфильтративными изменениями в легких
|
C
|
|
65
|
Выполнен прием (осмотр, консультация) врача - детского эндокринолога первичный пациентам с сопутствующей эндокринологической патологией в том числе стероидным диабетом
|
C
|
|
66
|
Выполнен прием (тестирование, консультация) медицинского психолога первичный пациентам с возраста 1 года и их родителям
|
A
|
|
67
|
Выполнен прием (осмотр, консультация) врача-невролога первичный пациентам с неврологической симптоматикой, отставанием в психомоторном развитии, психотическими реакциями
|
C
|
|
68
|
Выполнен прием (осмотр, консультация) врача-диетолога первичный пациентам с дефицитом массы тела, амиотрофией, остеопенией/остеопорозом, конституциональным ожирением и синдромом Кушинга, стероидным диабетом
|
C
|
|
69
|
Выполнен прием (осмотр, консультация) врача-травматолога-ортопеда первичный пациентам с функциональной недостаточностью суставов, нарушением роста костей в длину, подвывихами, болью в спине
|
C
|
|
70
|
Выполнен осмотр (консультация) врача-анестезиолога-реаниматолога первичный всем пациентам, которым планируется проведение поднаркозных исследований
|
C
|
|
71
|
Выполнен осмотр (консультация) врача-анестезиолога-реаниматолога первичный всем пациентам, находящимся в тяжелом состоянии
|
C
|
|
72
|
Выполнено суточное наблюдение врачом-анестезиологом-реаниматологом всех пациентов, находящихся в тяжелом/критическом состоянии (полиорганная недостаточность, в ГФС)
|
C
|
Таблица 4. Критерии оценки качества лечения юношеского полиартрита (полиартикулярный ювенильный идиопатический артрит серонегативный, полиартикулярный ювенильный идиопатический артрит серопозитивный)
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнено назначение патогенетической терапии в условиях ревматологического отделения стационара всем пациентам после проведения диагностики, в том числе дифференциальной диагностики, и установления/подтверждения диагноза ЮА
|
C
|
|
2
|
Выполнена коррекция терапии (переключение препаратов) до достижения эффективности или минимальной/низкой активности болезни у пациентов с длительно текущим заболеванием вне зависимости от применяемого препарата
|
C
|
|
3
|
Выполнено переключение на другой селективный иммунодепрессант (ингибитор янус-киназ) и/или дженерник исключительно по медицинским показаниям; не выполнено автоматическое переключение
|
C
|
|
4
|
Выполнено переключение на другой генно-инженерный биологический препарат и/или биоаналог исключительно по медицинским показаниям; не выполнено автоматическое переключение
|
C
|
|
5
|
Выполнено проведение контроля эффективности любого лекарственного препарата, применяемого для патогенетической терапии через 3 и 6, далее каждые 6 месяцев терапии (препарат эффективен при достижении 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace)
|
C
|
|
6
|
Выполнено назначение монотерапии НПВП длительностью не более 1 мес. пациентам с неустановленным диагнозом ЮА на этапе обследования
|
C
|
|
7
|
Выполнено назначение НПВП пациентам с установленным диагнозом ЮА
|
C
|
|
8
|
Выполнено проведение монотерапии НПВП длительностью не более 1 мес
|
C
|
|
9
|
Не выполнено назначение глюкокортикоидов перорально и/или внутривенно, и/или внутрисуставно, и/или иммунодепрессантов (метотрексата**, #лефлуномида**), и/или ГИБП (тоцилизумаба**, или адалимумаба**, или этанерцепта**, или абатацепта**, или #ритуксимаба**) и/или тофацитиниба**, или #упадацитиниба**, или барицитиниба** до завершения полного лабораторно-инструментального обследования, исключения онкологических, онко-гематологических, инфекционных заболеваний и установления диагноза ЮА
|
C
|
|
10
|
Выполнено внутрисуставное введение #бетаметазона** детям старше 3-х лет в соответствии с инструкцией по применению или #триамцинолона детям старше 12 лет в дозе 1 - 2 мг/кг (максимальная доза 80 мг) при введении в коленные суставы, 0,5 - 1 мг/кг (максимальная доза 40 мг) в голеностопные, локтевые суставы и 0,3 - 0,5 мг/кг (максимальная доза 40 мг) - в лучезапястные суставы, мелкие суставы кистей и стоп пациентам с активным моно- или олигоартритом не чаще 1 раза в 4 мес.
|
C
|
|
11
|
Выполнена пульс-терапии #метилпреднизолоном** в дозе 10 - 30 мг/кг/введение внутривенно в течение 3, при необходимости 5 дней подряд при фебрильной/гектической лихорадке, полиартрите, сопровождающемся болевым синдромом, не купирующимся приемом НПВП и выраженной функциональной недостаточностью
|
C
|
|
12
|
Выполнено назначение метотрексата** в дозе 15 мг/м2/нед 1 раз в нед. подкожно или перорально пациентам с активным полиартритом сразу после верификации диагноза при высокой активности болезни вне зависимости от наличия факторов неблагоприятного прогноза
|
B
|
|
13
|
Выполнено назначение метотрексата** 15 мг/м2/нед 1 раз в нед. подкожно или перорально пациентам с активным полиартритом сразу после верификации диагноза при средней активности болезни, при наличии факторов неблагоприятного прогноза
|
B
|
|
14
|
Выполнено назначение метотрексата** 15 мг/м2/нед 1 раз в нед. подкожно или перорально пациентам с активным полиартритом через 1 мес. лечения НПВП при низкой активности болезни и наличии факторов неблагоприятного прогноза или при средней степени активности болезни и отсутствии факторов неблагоприятного прогноза
|
B
|
|
15
|
Не выполнено увеличение дозы метотрексата** > 15 мг/м2/нед (не более 25 мг/нед) пациентам с активным артритом
|
B
|
|
16
|
Выполнено подкожное введение метотрексата** пациентам с активным артритом
|
B
|
|
17
|
Выполнено назначение #фолиевой кислоты** в дозе 1 мг каждый день кроме дня приема метотрексата** или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема метотрексата**
|
C
|
|
18
|
Выполнено переключение на #лефлуномид** при непереносимости или неэффективности метотрексата** пациентам с серопозитивным полиартритом
|
C
|
|
19
|
Выполнено назначение #лефлуномида** перорально детям массой тела < 20 кг - 10 мг в сут. однократно через день; детям массой тела 20 - 40 кг - 10 мг в сут.; детям массой тела > 40 кг - 20 мг в сут. ежедневно
|
C
|
|
20
|
Выполнено переключение на ГИБП или селективный иммунодепрессант при непереносимости метотрексата** или #лефлуномида**
|
C
|
|
21
|
Выполнено переключение на один из следующих препаратов: ингибиторы ФНО альфа, тоцилизумаб**, тофацитиниб**, #упадацитиниб**, барицитиниб**, абатацепт** при непереносимости метотрексата** или лефлуномида**
|
B, B, C, B, C, B, B
|
|
22
|
Выполнено назначение ГИБП или селективного иммунодепрессанта в комбинации с метотрексатом** при его неэффективности или #лефлуномидом** при его неэффективности, или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни
|
C
|
|
23
|
Выполнено назначение одного из следующих препаратов: ингибиторы ФНО альфа, тоцилизумаб**, тофацитиниб**, #упадацитиниб**, барицитиниб**, абатацепт** в комбинации с метотрексатом** при его неэффективности или #лефлуномидом** при его неэффективности
|
B, C, B, C, C
C, B, C, C, B, B, C
|
|
24
|
Выполнено назначение одного из следующих препаратов: адалимумаба** безцитратной формы (40 мг/0,4 мл) подкожно 1 раз в 2 нед. пациентам >= 2 лет с массой тела 10 - 30 кг - 20 мг, с массой тела; > 30 кг - 40 мг или этанерцепта** лиофилизата для приготовления раствора для подкожного введения пациентам >= 2 лет и массой тела менее 62,5 кг в дозе 0,4 мг/кг/введение 2 раза в нед. или 0,8 мг/кг/введение 1 раз в нед., или голимумаба** пациентам >= 2 лет с массой тела < 40 кг - в дозе 30 мг/м2 подкожно; >= 40 кг - 50 мг подкожно 1 раз в 4 нед. в комбинации с метотрексатом** или #лефлуномидом**, или в качестве монотерапии
|
B, C
|
|
25
|
Выполнено назначение тоцилизумаба** детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно 1 раз в 4 нед. или в дозе 162 мг подкожно 1 раз в 2 нед.; детям с массой тела < 30 кг - в дозе 10 мг/кг/введение внутривенно 1 раз в 4 нед. или 162 мг подкожно 1 раз в 3 нед. в комбинации с метотрексатом** или #лефлуномидом**, или в качестве монотерапии
|
B, B, C, C, C
|
|
26
|
Выполнено назначение тофацитиниба** перорально пациентам в возрасте >= 2-х лет и массой тела >= 40 кг 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) или #упадацитиниба** перорально пациентам в возрасте >= 12 лет и массой тела >= 40 кг 15 мг 1 раза в сут., или барицитиниба** перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. в комбинации с метотрексатом** или #лефлуномидом**, или в качестве монотерапии
|
B, B, C, C, C
|
|
27
|
Выполнено назначение абатацепта** внутривенно детям старше 6 лет с массой тела менее 75 кг в дозе 10 мг/кг/ведение, детям с массой тела от 75 - 100 кг - в дозе 750 мг, детям с массой тела более 100 кг - в дозе 1000 мг по схеме 0, 2, 4-я нед, далее каждые 4 нед. в комбинации с метотрексатом** или #лефлуномидом**, или в качестве монотерапии
|
B, B, C
|
|
28
|
Выполнено переключение на #ритуксимаб** в комбинации с метотрексатом** или с #лефлуномидом** при неэффективности ингибиторов ФНО-альфа, тоцилизумаба**, абатацепта**, тофацитиниба**, #упадацитиниба**, барицитиниба** в сочетании с метотрексатом** или с #лефлуномидом**, или в качестве монотерапии
|
B, C
|
|
29
|
Выполнено переключение на #ритуксимаб** в комбинации с метотрексатом** или с #лефлуномидом** на любом этапе лечения при непереносимости ингибиторов ФНО-альфа, тоцилизумаба**, абатацепта** или тофацитиниба**, #упадацитиниба**, барицитиниба**
|
C
|
|
30
|
Выполнено назначение #ритуксимаба** в дозе 375 мг/м2 поверхности тела внутривенно 1 раз в нед. в течение 4-х последовательных нед.
|
C
|
|
31
|
Выполнено назначение #ритуксимаба** в комбинации с #ко-тримоксазолом** в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно
|
C
|
|
32
|
Выполнена отмена ГИБП, тофацитиниба**, #упадацитиниба**, барицитиниба** при их непереносимости и назначение глюкокортикоидов для перорального приема в дозе 0,25 - 0,5 мг/кг/сут в комбинации с метотрексатом** или #лефлуномидом**
|
C
|
|
33
|
Выполнено дополнительное назначение ГК: преднизолона** для перорального приема в дозе 0,25 - 0,5 мг/кг в сутки или метилпреднизолона** в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** или #лефлуномида** в комбинации с ГИБП или тофацитинибом**, или #упадацитинибом**, **, или барицитинибом**, или при нарастании активности болезни на любом этапе лечения
|
C
|
|
34
|
Выполнено проведение коррекции терапии (переключение препаратов) до достижения эффективности
|
C
|
Таблица 5. Критерии оценки качества лечения пауциартикулярного юношеского артрита (олигоартикулярный ювенильный идиопатический артрит, персистирующий)
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнено назначение патогенетической терапии в условиях ревматологического отделения стационара всем пациентам после проведения диагностики, в том числе дифференциальной диагностики, и установления/подтверждения диагноза ЮА
|
C
|
|
2
|
Выполнена коррекция терапии (переключение препаратов) до достижения эффективности или минимальной/низкой активности болезни у пациентов с длительно текущим заболеванием вне зависимости от применяемого препарата
|
C
|
|
3
|
Выполнено переключение на другой селективный иммунодепрессант (ингибитор янус-киназ) и/или дженерник исключительно по медицинским показаниям; не выполнено автоматическое переключение
|
C
|
|
4
|
Выполнено переключение на другой генно-инженерный биологический препарат и/или биоаналог исключительно по медицинским показаниям; не выполнено автоматическое переключение
|
C
|
|
5
|
Выполнен контроль эффективности любого лекарственного препарата, применяемого для патогенетической терапии через 3 и 6, далее каждые 6 месяцев терапии (препарат эффективен при достижении 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace)
|
C
|
|
6
|
Выполнено назначение монотерапии НПВП длительностью не более 1 мес. пациентам с неустановленным диагнозом ЮА на этапе обследования
|
C
|
|
7
|
Выполнено назначение НПВП пациентам с установленным диагнозом ЮА
|
C
|
|
8
|
Выполнено проведение монотерапии НПВП длительностью не более 2 мес.
|
C
|
|
9
|
Не выполнено назначение глюкокортикоидов перорально и/или внутривенно, и/или внутрисуставно, метотрексата**, и/или ГИБП (тоцилизумаба**, или адалимумаба**, или этанерцепта**, или абатацепта**, или #ритуксимаба**) и/или тофацитиниба**, или #упадацитиниба**, или барицитиниба** до завершения полного лабораторно-инструментального обследования, исключения онкологических, онко-гематологических и инфекционных заболеваний и установления диагноза ЮА
|
C
|
|
10
|
Выполнено внутрисуставное введение #бетаметазона** детям старше 3-х лет в соответствии с инструкцией по применению или #триамцинолона детям старше 12 лет в дозе 1 - 2 мг/кг (максимальная доза 80 мг) при введении в коленные суставы, 0,5 - 1 мг/кг (максимальная доза 40 мг) в голеностопные, локтевые суставы и 0,3 - 0,5 мг/кг (максимальная доза 40 мг) - в лучезапястные суставы, мелкие суставы кистей и стоп пациентам с активным моно- или олигоартритом не чаще 1 раза в 4 мес.
|
C
|
|
11
|
Выполнено назначение метотрексата** в дозе 10 - 15 мг/м2/нед. 1 раз в нед. перорально или подкожно пациентам с активным олигоартритом сразу после верификации диагноза при высокой активности болезни вне зависимости от наличия факторов неблагоприятного прогноза
|
C
|
|
12
|
Выполнено назначение метотрексата** в дозе 10 - 15 мг/м2/нед. 1 раз в нед. перорально или подкожно пациентам с активным олигоартритом сразу после верификации диагноза при средней активности болезни, при наличии факторов неблагоприятного прогноза
|
C
|
|
13
|
Выполнено назначение метотрексата** в дозе 10 - 15 мг/м2/нед. 1 раз в нед. перорально или подкожно пациентам с активным олигоартритом в случае неэффективности лечения НПВП в течение 1 - 2 мес. и внутрисуставного введения ГК (необходимость инъекций чаще, чем 1 раз в 4 мес.), при низкой активности болезни и наличии факторов неблагоприятного прогноза или при средней активности болезни и отсутствии факторов неблагоприятного прогноза
|
C
|
|
14
|
Не выполнено увеличение дозы метотрексата** > 15 мг/м2/нед (не более 25 мг/нед) пациентам с активным артритом
|
C
|
|
15
|
Выполнено подкожное введение метотрексата** пациентам с активным артритом
|
B
|
|
16
|
Выполнено назначение #фолиевой кислоты** в дозе 1 мг каждый день кроме дня приема метотрексата** или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема метотрексата**
|
C
|
|
17
|
Выполнено переключение на ГИБП или селективный иммунодепрессант при непереносимости метотрексата**
|
C
|
|
18
|
Выполнено переключение на один из следующих препаратов: ингибиторы ФНО альфа, #тоцилизумаб**, #тофацитиниб**, #упадацитиниб**, барицитиниб**, #абатацепт** при непереносимости метотрексата**
|
C, C, C, C, B, C
|
|
19
|
Выполнено назначение ГИБП или селективного иммунодепрессанта в комбинации с метотрексатом** при его неэффективности или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни
|
C
|
|
20
|
Выполнено назначение одного из следующих препаратов: ингибиторы ФНО альфа, #тоцилизумаб**, #тофацитиниб**, #упадацитиниб**, барицитиниб**, #абатацепт** в комбинации с метотрексатом** при его неэффективности, или на любом этапе лечения при персистировании/нарастании активности болезни
|
C, C, C, C, B, C
|
|
21
|
Выполнено назначение одного из следующих препаратов: #адалимумаба** безцитратной формы (40 мг/0,4 мл) подкожно 1 раз в 2 нед. пациентам >= 2 лет с массой тела 10 - 30 кг - 20 мг, с массой тела; > 30 кг - 40 мг или #этанерцепта** в дозе 0,4 мг/кг/введение 2 раза в нед. или 0,8 мг/кг/введение 1 раз в нед., или #голимумаба** в дозе 30 мг/м2 подкожно (максимальная доза 50 мг) 1 раз в 4 нед. в комбинации с метотрексатом**, или в качестве монотерапии
|
C, C, C
|
|
22
|
Выполнено назначение #тоцилизумаба** детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно 1 раз в 4 нед. или в дозе 162 мг подкожно 1 раз в 2 нед.; детям с массой тела < 30 кг - в дозе 10 мг/кг/введение внутривенно 1 раз в 4 нед. или 162 мг подкожно 1 раз в 3 нед. в комбинации с метотрексатом**, или в качестве монотерапии
|
C
|
|
23
|
Выполнено назначение #тофацитиниба** перорально в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) или #упадацитиниба** перорально пациентам в возрасте >= 12 лет и массой тела >= 40 кг 15 мг 1 раза в сут., барицитиниба** перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. в комбинации с метотрексатом** или в качестве монотерапии
|
C, C, B
|
|
24
|
Выполнено назначение #абатацепта** внутривенно в дозе 10 мг/кг/ведение по схеме 0, 2, 4-я нед, далее каждые 4 нед. в комбинации с метотрексатом** или в качестве монотерапии
|
C
|
|
25
|
Выполнено переключение на #ритуксимаб** в комбинации с метотрексатом** при неэффективности ингибиторов ФНО-альфа, #тоцилизумаба**, #абатацепта**, #тофацитиниба**, #упадацитиниба**, барицитиниба** в сочетании с метотрексатом** или в качестве монотерапии
|
C
|
|
26
|
Выполнено переключение на #ритуксимаб** в комбинации с метотрексатом** на любом этапе лечения при непереносимости ингибиторов ФНО-альфа, #тоцилизумаба**, #абатацепта** или #тофацитиниба**, или #упадацитиниба**, или барицитиниба** на любом этапе лечения
|
C
|
|
27
|
Выполнено назначение #ритуксимаба** в дозе 375 мг/м2 поверхности тела внутривенно 1 раз в нед. в течение 4-х последовательных нед.
|
C
|
|
28
|
Выполнено назначение #ритуксимаба** в комбинации с #ко-тримоксазолом** в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно
|
C
|
|
29
|
Выполнено отмена ГИБП, #тофацитиниба** или #упадацитиниба**, или барицитиниба** при их непереносимости и назначение глюкокортикоидов для перорального приема в дозе 0,25 - 0,5 мг/кг/сут с в комбинации с метотрексатом**
|
C
|
|
30
|
Выполнено дополнительное назначение ГК: преднизолона** для перорального приема в дозе 0,25 - 0,5 мг/кг в сутки или метилпреднизолона** в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** в комбинации с ГИБП или #тофацитинибом**, или #упадацитинибом**, или барицитинибом** или при нарастании активности болезни на любом этапе лечения
|
C
|
|
31
|
Выполнено проведение коррекции терапии (переключение препаратов) до достижения эффективности
|
C
|
Таблица 6. Критерии оценки качества лечения юношеского анкилозирующего спондилита
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнено назначение патогенетической терапии в условиях ревматологического отделения стационара всем пациентам после проведения диагностики, в том числе дифференциальной диагностики, и установления/подтверждения диагноза ЮА
|
C
|
|
2
|
Выполнена коррекция терапии (переключение препаратов) до достижения эффективности или минимальной/низкой активности болезни у пациентов с длительно текущим заболеванием вне зависимости от применяемого препарата
|
C
|
|
3
|
Выполнено переключение на другой селективный иммунодепрессант (ингибитор янус-киназ) и/или дженерник исключительно по медицинским показаниям; не выполнено автоматическое переключение
|
C
|
|
4
|
Выполнено переключение на другой генно-инженерный биологический препарат и/или биоаналог исключительно по медицинским показаниям; не выполнено автоматическое переключение
|
C
|
|
5
|
Выполнен контроль эффективности любого лекарственного препарата, применяемого для патогенетической терапии через 3 и 6, далее каждые 6 месяцев терапии (препарат эффективен при достижении 50% улучшения по критериям АКРпеди через 3 мес. или стадии неактивной болезни через 6 мес, или ремиссии через 12 мес. по критериям C. Wallace)
|
C
|
|
6
|
Выполнено назначение монотерапии НПВП длительностью не более 1 мес. пациентам с неустановленным диагнозом ЮАС на этапе обследования
|
C
|
|
7
|
Выполнено назначение НПВП пациентам с установленным диагнозом ЮА
|
C
|
|
8
|
Выполнено проведение монотерапии НПВП длительностью не более 1 мес
|
C
|
|
9
|
Не выполнено назначение глюкокортикоидов перорально и/или внутривенно, и/или внутрисуставно, и/или иммунодепрессантов (метотрексата** или #сульфасалазина**), и/или ГИБП (#тоцилизумаба**, или #адалимумаба**, или #этанерцепта**, или #голимумаба**, или секукинумаба**) и/или #тофацитиниба**, или #упадацитиниба**, или барицитиниба** до завершения полного лабораторно-инструментального обследования, исключения онкологических, онко-гематологических и инфекционных заболеваний
|
C
|
|
10
|
Выполнено внутрисуставное введение #бетаметазона** детям старше 3-х лет в соответствии с инструкцией по применению или #триамцинолона детям старше 12 лет в дозе 1 - 2 мг/кг (максимальная доза 80 мг) при введении в коленные суставы, 0,5 - 1 мг/кг (максимальная доза 40 мг) в голеностопные, локтевые суставы и 0,3 - 0,5 мг/кг (максимальная доза 40 мг) - в лучезапястные суставы, мелкие суставы кистей и стоп пациентам с активным моно- или олигоартритом не чаще 1 раза в 4 мес.
|
C
|
|
11
|
Выполнено назначение одного из следующих препаратов: метотрексата** в дозе 10 - 15 мг/м2/нед. 1 раз в нед. перорально или подкожно или сульфасалазина** в дозе 30 - 50 мг/кг/сут. перорально пациентам с периферическим артритом сразу после верификации диагноза
|
C
|
|
12
|
Не выполнено увеличение дозы метотрексата** > 15 мг/м2/нед (не более 25 мг/нед) пациентам с активным артритом
|
B
|
|
13
|
Выполнено подкожное введение метотрексата** пациентам с активным артритом
|
B
|
|
14
|
Выполнено назначение #фолиевой кислоты** в дозе 1 мг каждый день кроме дня приема метотрексата** или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема метотрексата**
|
C
|
|
15
|
Выполнено переключение на ГИБП или селективный иммунодепрессант при непереносимости метотрексата** или сульфасалазина**
|
C
|
|
16
|
Выполнено переключение на один из следующих препаратов: ингибиторы ФНО альфа, секукинумаб**, #тофацитиниб**, #упадацитиниб**, барицитиниб** при непереносимости сульфасалазина** или метотрексата**
|
B, B, C, C, B
|
|
17
|
Выполнено назначение ГИБП или селективного иммунодепрессанта в комбинации с метотрексатом** при его неэффективности или #сульфасалазином** при его неэффективности, или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни
|
C
|
|
18
|
Выполнено назначение одного из следующих препаратов: ингибиторы ФНО альфа, секукинумаб**, #тофацитиниб**, #упадацитиниб**, барицитиниб** на фоне продолжения ранее назначенной терапии с сульфасалазином** или #метотрексатом**, или в качестве монотерапии, или на любом этапе лечения при персистировании/нарастании активности болезни
|
B, B, C, C, B
|
|
19
|
Выполнено назначение одного из следующих препаратов: #адалимумаба** безцитратной формы (40 мг/0,4 мл) подкожно 1 раз в 2 нед. пациентам >= 2 лет с массой тела 10 - 30 кг - 20 мг, с массой тела; > 30 кг - 40 мг или #этанерцепта** в дозе 0,4 мг/кг/введение 2 раза в нед. или 0,8 мг/кг/введение 1 раз в нед., или #голимумаба** в дозе 30 мг/м2 подкожно (максимальная доза 50 мг) 1 раз в 4 нед. в комбинации с сульфасалазином** или метотрексатом**, или в качестве монотерапии
|
C
|
|
20
|
Выполнено назначение секукинумаба** детям с массой тела > 50 кг - в дозе 75 мг, >= 50 кг - в дозе 150 мг на 0, 1, 2 и 3 нед. с последующим ежемесячным введением в качестве поддерживающей дозы, начиная с 4 недели подкожно в комбинации с сульфасалазином** или метотрексатом**, или в качестве монотерапии
|
B
|
|
21
|
Выполнено назначение #тоцилизумаба** при неэффективности и/или непереносимости ингибиторов ФНО-альфа, секукинумаба**, #тофацитиниба**, #упадацитиниба**, барицитиниба** детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно 1 раз в 4 нед. или в дозе 162 мг подкожно 1 раз в 2 нед.; детям с массой тела < 30 кг - в дозе 10 мг/кг/введение внутривенно 1 раз в 4 нед. или 162 мг подкожно 1 раз в 3 нед. в комбинации с метотрексатом** или сульфасалазином** или в качестве монотерапии в комбинации с сульфасалазином** или метотрексатом**, или в качестве монотерапии
|
C
|
|
22
|
Выполнено назначение #тофацитиниба** перорально в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) или #упадацитиниба** перорально пациентам в возрасте >= 12 лет и массой тела >= 40 кг 15 мг 1 раза в сут., или барицитиниба** перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут в комбинации с сульфасалазином** или метотрексатом**, или в качестве монотерапии
|
C, C. B
|
|
23
|
Выполнена отмена ГИБП, тофацитиниба** или упадацитиниба**, или барицитиниба** при их непереносимости и назначение глюкокортикоидов для перорального приема в дозе 0,25 - 1,0 мг/кг/сут в комбинации с сульфасалазином** или метотрексатом** на любом этапе лечения
|
C
|
|
24
|
Выполнено дополнительное назначение ГК: преднизолона** для перорального приема в дозе 0,25 - 0,5 мг/кг в сутки или метилпреднизолона** в дозе, эквивалентной преднизолону (не более 60 мг/сут.) при неэффективности метотрексата** или сульфасалазина** в комбинации с ГИБП или тофацитинибом**, или #упадацитинибом**, барицитинибом** или при нарастании активности болезни на любом этапе лечения
|
C
|
|
25
|
Выполнено проведение коррекции терапии (переключение препаратов) до достижения эффективности
|
C
|
Таблица 7. Критерии оценки качества лечения увеита, ассоциированного с юношеским артритом
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнено назначение местной терапии всем пациентам с увеитом, ассоциированным с юношеским артритом, после приема (осмотра, консультации) врача-офтальмолога
|
C
|
|
2
|
Выполнено переключение первично назначенных иммунодепрессанта и/или селективного иммунодепрессанта на дженерик, и/или ГИБП на биоаналог исключительно при доказанной терапевтической эффективности и безопасности дженерика или биоаналога у педиатрической популяции пациентов с аналогичной нозологической формой; не выполнено автоматическое переключение
|
C
|
|
3
|
Выполнен форсаж #дексаметазоном** по 1 капле 6 раз в день в комбинации с НПВП-содержащими каплями (диклофенак**) по 1 - 2 капле 4 - 6 раз в день с постепенным снижением дозы (по 1 капле 1 раз в 2 недели) при остром течении увеита
|
C
|
|
4
|
Выполнены инстилляции #дексаметазона** по 1 капле 2 - 3 раза в день с постепенным снижением дозы (по 1 капле 1 раз в 2 нед) в комбинации с инстилляциями НПВП-содержащих капель: по 1 капле 2 - 3 раза в день с постепенным снижением дозы (по 1 капле 1 раз в 2 нед) при подостром и вялотекущем течении увеита
|
C
|
|
5
|
Выполнены парабульбарные инъекции #бетаметазона** по 0,5 мл 1 раз в 10 - 14 дней при остром течении увеита и тяжелом течении панувеита при неэффективности местной терапии
|
C
|
|
6
|
Выполнено назначение #тропикамида** по 1 - 2 капли 2 раза в день в течение 1 мес. (при необходимости курс может быть продлен до 2 мес.) пациентам с иридо-хрусталиковыми синехиями
|
C
|
|
7
|
Выполнено назначение #таурина** в виде капель по 1 - 2 капли 2 раза в день или #декспантенола** - в виде глазного геля 1 раз в день под веко на ночь курсами по 2 мес. с перерывами по 2 мес. пациентам с дистрофическими изменениями в глазах
|
C
|
|
8
|
Выполнено назначение #метотрексата** в дозе 10 - 15 мг/м2/нед перорально или подкожно 1 раз в нед. при неэффективности местного лечения увеита (недостижение ремиссии в течение 3 мес.) или при тяжелом течении увеита (независимо от длительности местной терапии)
|
C
|
|
9
|
Не выполнено увеличение дозы #метотрексата** > 15 мг/м2/нед (не более 25 мг/нед) пациентам с активным увеитом
|
C
|
|
10
|
Выполнено назначение #фолиевой кислоты** в дозе 1 мг каждый день кроме дня приема #метотрексата** или 2,5 - 7,5 мг 1 раз в нед. перорально в период приема #метотрексата**
|
C
|
|
11
|
Выполнено переключение на один из следующих препаратов на любом этапе лечения: #циклоспорин** или #микофенолата мофетил**, или ингибиторы ФНО альфа, или #тоцилизумаб**, или #тофацитиниб**, или #упадацитиниб**, или #барицитиниб**, или #абатацепт** при непереносимости #метотрексата**
|
C, C, C, C, C,
C, C
|
|
12
|
Выполнено назначение #циклоспорина** в дозе 3 - 5 мг/кг/сут. перорально в 2 приема в сочетании с местной терапией при неэффективности #метотрексата** пациентам с низкой или средней степенью активности увеита или при нарастании активности увеита на любом этапе лечения в качестве монотерапии или в комбинации с #метотрексатом**
|
C
|
|
13
|
Выполнено назначение монотерапии #микофенолата мофетилом** перорально в дозе 600 мг/м2/сут. в два приема в сочетании с местной терапией при неэффективности #метотрексата** и/или неэффективности #циклоспорина** в качестве монотерапии или в комбинации с #метотрексатом**, или при нарастании активности увеита на любом этапе лечения
|
C
|
|
14
|
Выполнено назначение ингибитора ФНО альфа (#адалимумаба** или #голимумаба**) в сочетании с местной терапией при неэффективности #метотрексата** и/или неэффективности #циклоспорина** в качестве монотерапии или в комбинации с #метотрексатом**, или монотерапии #микофенолата мофетилом**, или при нарастании активности увеита на любом этапе лечения
|
C
|
|
15
|
Выполнено незамедлительное, назначение ингибитора ФНО-альфа в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом** в сочетании с местной терапией на любом этапе лечения при тяжелом течении увеита, панувеите, угрозе развития слепоты
|
C
|
|
16
|
Выполнено назначение #адалимумаба** безцитратной формы (40 мг/0,4 мл) пациентам в возрасте >= 2 лет с массой тела 10 - 30 кг - в дозе 20 мг подкожно 1 раз в 2 нед; > 30 кг - 40 мг подкожно 1 раз в 2 недели или #голимумаба** в дозе 30 мг/м2 (максимальная доза 50 мг) подкожно 1 раз в 4 нед. в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом** в сочетании с местной терапией
|
C, C
|
|
17
|
Выполнено переключение с ингибитора ФНО-альфа на один из следующих препаратов с новым механизмом действия: #тоцилизумаб**, #тофацитиниб**, #упадацитиниб**, #барицитиниб**, #абатацепт** при неэффективности ингибитора ФНО альфа в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом**, или при нарастании активности увеита на любом этапе лечения
|
C, C, C
|
|
18
|
Выполнено назначение #тоцилизумаба** детям с массой тела >= 30 кг - в дозе 8 мг/кг/введение внутривенно 1 раз в 4 нед или в дозе 162 мг подкожно 1 раз в 2 недели; детям с массой тела < 30 кг - в дозе 10 мг/кг/введение внутривенно 1 раз в 4 недели или 162 мг подкожно 1 раз в 3 нед в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом**
|
C, C
|
|
19
|
Выполнено назначение #тофацитиниба** перорально в дозе 5 мг 2 раза в сут. (суммарная суточная доза 10 мг) или #упадацитиниба** перорально пациентам >= 12 лет и массой тела >= 40 кг 15 мг 1 раз в сут., или #барицитиниба** перорально пациентам >= 2 лет с массой тела >= 10 кг - < 30 кг - 2 мг один раз в сут., детям с массой тела >= 30 кг - 4 мг один раз в сут. в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом**
|
C
|
|
20
|
Выполнено назначение #абатацепта** в дозе 10 мг/кг/ведение внутривенно по схеме 0, 2, 4-я нед, далее каждые 4 нед в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом**
|
C
|
|
21
|
Выполнено переключение на #ритуксимаб** в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом** при неэффективности ингибиторов ФНО-альфа, #тоцилизумаба**, #абатацепта**, #тофацитиниба**, #упадацитиниба**, #барицитиниба** в сочетании с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом** или в качестве монотерапии
|
C
|
|
22
|
Выполнено переключение на #ритуксимаб** в комбинации с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом** при непереносимости ингибиторов ФНО-альфа, #тоцилизумаба**, #абатацепта**, #тофацитиниба**, #упадацитиниба**, #барицитиниба** в сочетании с #метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом** или в качестве монотерапии
|
C
|
|
23
|
Выполнено назначение #ритуксимаба** в дозе 375 мг/м2 поверхности тела внутривенно 1 раз в неделю в течение 4-х последовательных нед.
|
C
|
|
24
|
Выполнено назначение #ритуксимаба** в комбинации с #ко-тримоксазолом** (J01EE) в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно
|
C
|
|
25
|
Выполнено отмена ГИБП или #тофацитиниба**, или #упадацитиниба**, или #барицитиниба** при их непереносимости и назначение глюкокортикоидов для перорального приема в дозе 0,25 мг/кг в сутки в сочетании с метотрексатом** и/или #циклоспорином**, или #микофенолата мофетилом**
|
C
|
|
26
|
Выполнено дополнительное назначение ГК: преднизолона** или метилпреднизолона** перорально в дозе 0,25 мг/кг в сутки при неэффективности #метотрексата** и/или #циклоспорина**, или #микофенолата мофетила** в комбинации с ГИБП или #тофацитинибом**, или #упадацитинибом**, или #барицитинибом**, или при нарастании активности увеита на любом этапе лечения
|
C
|
Таблица 8. Критерии оценки качества лечения юношеского артрита с гемофагоцитарным синдромом
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнено назначение и проведение терапии в условиях ревматологического стационара всем пациентам после проведения диагностики, в том числе дифференциальной диагностики, и установления/подтверждения диагноза ЮА с гемофагоцитарным синдромом
|
C
|
|
2
|
Выполнено назначение таргетной этиотропной терапии антибактериальными препаратами системного действия и/или противогрибковыми препаратами системного действия, и/или противовирусными препаратами системного действия пациентам с известным этиологическим инфекционным фактором
|
C
|
|
3
|
Выполнено назначение ГК в комбинации с #циклоспорином** и #иммуноглобулином человека нормальным**
|
C
|
|
4
|
Выполнено проведение пульс-терапии #метилпреднизолоном** в дозе 20 - 30 мг/кг/введение внутривенно или назначение #дексаметазона** в дозе 10 - 20 мг/м2/сут. внутривенно
|
C
|
|
5
|
Выполнено постепенное снижение дозы внутривенных ГК по после купирования клинических и лабораторных признаков ГФС по следующим схемам: #дексаметазон** с исходной дозы - 10 - 20 мг/м2/сут. в течение 1 - 2 нед., 5 - 10 мг/м2/сут. в течение 3 - 4 нед., 2,5 - 5 мг/м2/сут. в течение 5 - 6 нед., 1,25 - 2,5 мг/м2/сут. в течение 7 - 8 нед.; #метилпреднизолон** с исходной дозы - 20 - 30 мг/кг/введение в течение 3 - 5 дней снижение дозы на 25% 1 раз в 2 - 3 дня
|
C
|
|
6
|
Выполнено назначение #циклоспорина** в дозе 3 - 5 мг/кг/сут. внутривенно или перорально
|
C
|
|
7
|
Выполнено назначение #иммуноглобулина человека нормального** в дозе 1 - 2 г/кг/курс
|
C
|
|
8
|
Выполнена оценка эффективности применяемой схемы лечения ГФС в соответствии с критериями достижения ответа на терапию (купирование лихорадки, уменьшение размеров селезенки, повышение числа тромбоцитов крови >= 100 x 109/л, нормализацию уровня фибриногена крови, снижение концентрации ферритина сыворотки крови на 25%) каждые 48 часов
|
C
|
|
9
|
Выполнено назначение #анакинры** 5 - 10 мг/кг/сут. внутривенно в 2 введения в течение 3 - 10 дней, при необходимости дольше при нарастании активности ГФС в первые 48 часов проведения терапии ГК в комбинации с #циклоспорином** и #иммуноглобулином человека нормальным**
|
C
|
|
10
|
Выполнено дополнительное назначение #руксолитиниба** перорально детям с весом до 10 кг - 2,5 мг x 2 раза/сут.; детям с весом от 10 до 25 кг - 5 мг x 2 раза/сут.; детям с весом > 25 кг - 10 мг x 2 раза/сут. или #тофацитиниба** перорально в дозе 10 мг x 2 раза/сут. при неэффективности комбинации #анакинры** с ГК, #циклоспорином** и #иммуноглобулином человека нормальным**
|
C
|
|
11
|
Выполнено переключение на #ритуксимаб** в дозе 375 мг/м2 в нед. внутривенно в течение 1 - 4 последовательных недель при неэффективности комбинации #анакинры** с ГК, #циклоспорином**, #иммуноглобулином человека нормальным** и #руксолитинибом** или #тофацитинибом**
|
C
|
|
12
|
Выполнено назначение #ко-тримоксазола** в дозе 5 мг/кг по триметоприму перорально 3 раза в нед. или ежедневно в комбинации с #ритуксимабом**
|
C
|
|
13
|
Выполнено назначение #преднизолона** в дозе 1 - 2 мг/кг/перорально или #метилпреднизолона** в дозе эквивалетной преднизолону, при неэффективности комбинированной терапии ГФС или реактивации ГФС на фоне снижения/отмены внутривенных ГК
|
C
|
|
14
|
Выполнено назначение #ацикловира** детям в возрасте < 1 года в дозе 10 мг/кг/введение внутривенно каждые 8 часов; детям в возрасте >= 1 года - в дозе 500 мг/м2 внутривенно каждые 8 часов при развитии Herpes zoster
|
C
|
|
15
|
Выполнено назначение #ацикловира** в дозе 5 - 10 мг/кг/введение внутривенно каждые 8 часов в течение 7 - 10 дней при развитии герпетической инфекции, вызванной Herpes simplex virus
|
C
|
|
16
|
Выполнено назначение #ганцикловира** в дозе 6 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при подтверждении активной цитомегаловирусной инфекции
|
C
|
|
17
|
Выполнено назначение #ганцикловира** в дозе 10 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при подтверждении активной Эпштейна-Барр вирусной инфекции
|
C
|
|
18
|
Выполнено назначение в качестве ГИБП первого выбора #ритуксимаба** в сочетании с #циклоспорином**, #иммуноглобулином человека нормальным** и #ко-тримоксазолом** при активной Эпштейна-Барр вирусной инфекции
|
C
|
|
19
|
Выполнено назначение антитромботических средств: препаратов из группы гепарина или прямых ингибиторов фактора Xa; антиагрегантов, кроме гепарина; антифибринолитических средств, при гиперкоагуляции; развитии коагулопатии
|
C
|
|
20
|
Выполнено проведение гемотрансфузии при развитии коагулопатии потребления, кровотечения
|
C
|
|
21
|
Выполнено назначение колониестимулирующего фактора #филграстима** в дозе 5 - 10 мкг/кг/сут. подкожно в течение 3 - 5 дней (при необходимости - дольше) при снижении абсолютного числа нейтрофилов <= 1,0 x 109/л
|
C
|
|
22
|
Выполнено плановое назначение антибактериальных препаратов системного действия в сочетании с противогрибковыми препаратами системного действия при снижении абсолютного числа нейтрофилов <= 1,0 x 109/л до разрешения агранулоцитоза
|
C
|
|
23
|
Выполнено назначение эмпирической антибактериальной терапии препаратами системного действия, влияющими на грамположительную, грамотрицательную и анаэробную флору, и/или противогрибковыми препаратами системного действия и/или противовирусными препаратами системного действия при развитии сепсиса/инфекционного осложнения до подтверждения этиологического фактора
|
C
|
|
24
|
Выполнено назначение таргетной терапии по чувствительности микрофлоры антибактериальными препаратами системного действия (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз и/или цефалоспорины 4-го поколения, и/или карбапенемы, и/или другие антибактериальные препараты, и/или антибиотики гликопептидной структуры, и/или другие аминогликозиды в сочетании или без/с с противогрибковыми препаратами системного действия и/или противовирусными препаратами системного действия при подтверждении этиологического фактора сепсиса/инфекционного осложнения
|
C
|
|
25
|
Выполнено лечение ГФС до достижения неактивной стадии (отсутствие лихорадки, спленомегалии, цитопении (HB >= 90 г/л, тромбоциты >= 100 x 109/л, нейтрофилы >= 0,5 x 109/л), уровень триглицеридов в крови < 3 ммоль/л или < 265 мг/дл, ферритина <= 500
 , нормализации показатели цереброспинальной жидкости (при поражении ЦНС) , нормализации показатели цереброспинальной жидкости (при поражении ЦНС) |
C
|
Таблица 9. Критерии оценки качества контрольного обследования пациентов с юношеским артритом в условиях стационара/дневного стационара, инициировавшего назначение ГИБП/иммунодепрессанта
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнена оценка эффективности лечения и безопасности противоревматической терапии всем пациентам с установленным диагнозом ЮА в условиях ревматологического стационара, через 3 мес. после назначения терапии; через 6 мес. после назначения терапии; далее каждые 6 мес.
|
C
|
|
2
|
Выполнен общий (клинический) анализ крови развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула), исследование уровня общего гемоглобина в крови)
|
C
|
|
3
|
Выполнено прекращение инфузий ГИБП и/или инъекций/приема иммунодепрессантов (в течение 7 дней) при снижении числа тромбоцитов <= 150 > 100 x 109/л, числа нейтрофилов < 1,5 >= 1,0 x 109/л, в общем (клиническом) анализе крови
|
C
|
|
4
|
Выполнена отмена иммунодепрессанта и/или ГИБП при снижении абсолютного числа нейтрофилов < 1,0 x 109/л и/или числа тромбоцитов < 100 x 109/л в общем (клиническом) анализе крови
|
C
|
|
5
|
Выполнено назначение колониестимулирующего фактора #филграстима** в дозе 5 - 10 мкг/кг/сут. подкожно при лейкопении с абсолютным числом нейтрофилов <= 1,0 x 109/л в течение 3 - 5 дней (при необходимости - дольше) до полной нормализации числа лейкоцитов и нейтрофилов
|
C
|
|
6
|
Выполнено назначение колониестимулирующего фактора #филграстима** 5 - 10 мкг/кг/сут. подкожно в сочетании с антибактериальными препаратами системного действия внутривенно при фебрильной нейтропении (нейтропения, сопровождающаяся лихорадкой) с абсолютным числом нейтрофилов <= 1,0 x 109/л
|
C
|
|
7
|
Выполнено продолжение лечения антибактериальными препаратами системного действия всем пациентам с фебрильной нейтропенией (нейтропенией, сопровождающейся лихорадкой)
|
C
|
|
8
|
Выполнено возобновление лечения иммунодепрессантом, и/или ГИБП в той же дозе после восстановления числа нейтрофилов >= 1,5 x 109/л. по данным общего (клинического) анализа крови
|
C
|
|
9
|
Выполнена коррекция терапии иммунодепрессантом, и/или ГИБП при наличии данных о повторных эпизодах снижения числа клеток крови в общем (клиническом) анализе крови
|
C
|
|
10
|
Выполнено назначение флуконазола** внутривенно 3 - 12 мг/кг/сут. в зависимости от выраженности и длительности сохранения индуцированной нейтропении пациентам с нейтропенией
|
C
|
|
11
|
Выполнено исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня холестерина липопротеинов высокой плотности в крови, определение активности креатинкиназы в крови, определение активности панкреатической амилазы в крови, определение активности липазы
|
C
|
|
12
|
Выполнена временная отмена иммунодепрессанта и/или ГИБП при повышении уровня АЛТ, АСТ в сыворотке крови >= 1,5 раза выше верхней границы нормы и/или повышении уровня общего билирубина, свободного (неконъюгированного) и/или связанного (конъюгированного) билирубина, и/или мочевины, и/или креатинина, и/или мочевой кислоты и/или другого(их) биохимического(их) показателя(ей) выше верхней границы нормы
|
C
|
|
13
|
Выполнено возобновление терапии иммунодепрессантом, и/или ГИБП в той же дозе после нормализации показателей биохимического анализа крови общетерапевтического
|
C
|
|
14
|
Выполнена коррекция терапии иммунодепрессантом, и/или ГИБП при наличии данных о повторных эпизодах повышения биохимического(их) показателя(ей)
|
C
|
|
15
|
Выполнено исследование уровня C-реактивного белка в сыворотке крови
|
C
|
|
16
|
Выполнено исследование уровня прокальцитонина в крови пациентам с подозрением на развитие инфекционных осложнений
|
C
|
|
17
|
Выполнен комплекс исследований для исключения сепсиса (общий (клинический) анализ крови развернутый, анализ крови биохимический общетерапевтический, исследование уровня C-реактивного белка в сыворотке крови, микробиологическое (культуральное) исследование крови на стерильность, микробиологическое (культуральное) исследование слизи с миндалин и задней стенки глотки на аэробные и факультативно-анаэробные микроорганизмы, микробиологическое (культуральное) исследование мочи на бактериальные патогены с применением автоматизированного посева, микробиологическое (культуральное) исследование отделяемого из ануса с определением, чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам, тромбоэластография, коагулограмма (ориентировочное исследование системы гемостаза); компьютерная томография органов грудной полости, ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование почек, эхокардиография, магнитно-резонансная томография органов брюшной полости, магнитно-резонансная томография органов малого таза, магнитно-резонансная томография забрюшинного пространства) пациентам с фебрильной, гектической лихорадкой, лейкоцитозом/лейкопенией, тромбоцитопенией, повышением уровня C-реактивного белка в сыворотке крови и прокальцитонина сыворотки крови, несвязанными с активностью ЮА
|
C
|
|
18
|
Выполнено назначение сначала эмпирической антибактериальной терапии, а в дальнейшем, в зависимости от клинической ситуации, внутривенно антибактериальных препаратов системного действия, влияющих на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз и/или цефалоспорины 4-го поколения, и/или карбапенемы, и/или другие антибактериальные препараты, и/или антибиотики гликопептидной структуры, и/или другие аминогликозиды, и/или макролиды) в сочетании или без/с противогрибковыми препаратами системного действия по чувствительности микрофлоры в сочетании с #иммуноглобулином человека нормальным** в дозе 400 мг/кг/курс (5 дней) при развитии сепсиса
|
C
|
|
19
|
Выполнена временная отмена иммунодепрессанта и/или ГИБП и продолжение приема ранее назначенных ГК перорально на весь период этиотропной терапии при развитии сепсиса/инфекционного осложнения
|
C
|
|
20
|
Выполнено возобновление терапии иммунодепрессантом, и/или ГИБП не раньше, чем через неделю после полного купирования клинических и лабораторных признаков сепсиса и окончания антибактериальной терапии
|
C
|
|
21
|
Выполнено определение протромбинового индекса, исследование уровня растворимых фибринмономерных комплексов в крови, определение протромбинового (тромбопластинового) времени в крови или в плазме, определение активированного частичного тромбопластинового времени, определение тромбинового времени в крови, исследование уровня плазминогена в крови, исследование уровня фибриногена в крови, определение концентрации Д-димера в крови, исследование активности и свойств фактора Виллебранда в крови, определение, активности антитромбина III в крови пациентам с признаками васкулита и/или сепсисом, и/или в ГФС
|
C
|
|
22
|
Выполнена тромбоэластография с признаками васкулита и/или сепсисом, и/или в ГФС, признаками гипер- и/или гипокоагуляции, пациентам, получающим антитромботические средства
|
C
|
|
23
|
Выполнено исследование уровня гепарина в крови пациентам с васкулитом
|
C
|
|
24
|
Выполнено назначение/коррекция терапии антитромботическими средствами: препаратами из группы гепарина или прямыми ингибиторами фактора Xa; антиагрегантами кроме гепарина; антифибринолитическими средствами при развитии коагулопатии, внутрисосудистого диссеминированного свертывания по данным коагулограммы (ориентировочное исследование системы гемостаза) и тромбоэластограммы
|
C
|
|
25
|
Выполнена гемотрансфузия в соответствии с показаниями пациентам с коагулопатией потребления/кровотечением
|
C
|
|
26
|
Выполнено определение содержания ревматоидного фактора (РФ) в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-ССР) в крови, определение содержания антител к антигенам ядра клетки и ДНК
|
C
|
|
27
|
Выполнено исследование уровня иммуноглобулинов в крови
|
C
|
|
28
|
Выполнено назначение #иммуноглобулина человека нормального** в дозе 400 мг/кг, при недостижении достаточного уровня иммуноглобулинов крови в дозе 500 мг/кг не реже 1 раза в 2 - 4 нед. до нормализации уровня иммуноглобулинов крови в случае снижения уровня иммуноглобулинов крови
|
C
|
|
29
|
Выполнен пропуск плановой инфузии #ритуксимаба**, продолжено лечение иммунодепрессантом и прием ранее назначенных ГК перорально при снижении уровня иммуноглобулинов крови
|
C
|
|
30
|
Выполнено возобновление инфузий #ритуксимаба**, после восстановления уровня иммуноглобулинов крови
|
|
|
31
|
Выполнено исследование популяций лимфоцитов всем пациентам, получающим #ритуксимаб**, а также пациентам, часто болеющим вирусными, гнойными бактериальными инфекциями, в том числе оппортунистическими инфекциями
|
C
|
|
32
|
Выполнено определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
33
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование, определение ДНК цитомегаловируса (Cytomegalovirus) в моче методом ПЦР качественное исследование пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
34
|
Выполнено определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в мазках со слизистой ротоглотки качественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР качественное исследование в моче пациентам с клиническими проявлениями герпетической инфекции, и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
35
|
Выполнено определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови пациентам с клиническими проявлениями цитомегаловирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
36
|
Выполнено определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
37
|
Выполнено определение антител к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
38
|
Выполнено определение антител класса G (IgG) к ранним белкам (EA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови пациентам с клиническими проявлениями Эпштейна-Барр вирусной инфекции и/или с лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
39
|
Выполнено определение антител к вирусу простого герпеса (Herpes simplex virus) в крови пациентам с клиническими проявлениями герпетической инфекции и/или лихорадкой, и/или при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
40
|
Выполнено назначение #ацикловира** в дозе 200 мг перорально 5 раз в сутки (не более 1000 мг/сут.) детям в возрасте старше 2 лет или в дозе 5 - 10 мг/кг/введение внутривенно каждые 8 часов при развитии локальной герпетической инфекции; назначение #ацикловира** в дозе 10 мг/кг/введение внутривенно каждые 8 часов у детей в возрасте < 1 года; в дозе 500 мг/м2 внутривенно каждые 8 часов у детей в возрасте >= 1 года при развитии Herpes zoster
|
C
|
|
41
|
Выполнено назначение #ганцикловира** в дозе 6 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при развитии цитомегаловирусной инфекции или #ганцикловира** в дозе 10 мг/кг/введение внутривенно каждые 12 часов в течение 14 - 21 дня при развитии Эпштейна-Барр вирусной инфекции
|
C
|
|
42
|
Выполнена временная отмена иммунодепрессанта и/или ГИБП всем пациентам при развитии инфекции, вызванной герпес-вирусами
|
C
|
|
43
|
Выполнено возобновление терапии иммунодепрессантом и/или ГИБП всем пациентам не ранее, чем через 1 нед. после полного купирования клинических и лабораторных признаков инфекции и окончания противовирусной терапии
|
C
|
|
44
|
Выполнено обследование на наличие/отсутствие туберкулеза (очаговая проба с туберкулином, тест с аллергеном туберкулезным рекомбинантным в стандартном разведении**, исследование уровня интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, компьютерная томография органов грудной полости) всем пациентам, получающим ГИБП и/или иммунодепрессанты в сочетании с (или без) ГК не реже 2 раз в год
|
C
|
|
45
|
Выполнена отмена иммунодепрессанта и/или ГИБП всем пациентам с выявленной положительной внутрикожной пробой с туберкулином (папула > 5 мм) и/или повышением уровня интерферона-гамма, и/или поражения легких, и/или внутригрудных лимфатических узлов
|
C
|
|
46
|
Выполнен прием (осмотр, консультация) врача-фтизиатра первичный пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или поражением легких и/или внутригрудных лимфатических узлов
|
C
|
|
47
|
Выполнено назначение ГК перорально всем пациентам при развитии обострения ЮА на время проведения специфической противотуберкулезной терапии
|
C
|
|
48
|
Выполнено возобновление терапии иммунодепрессантом и/или ГИБП всем пациентам после завершения специфической противотуберкулезной терапии и консультации врача-фтизиатра
|
C
|
|
49
|
Выполнено определение антител к сальмонелле кишечной (Salmonella enterica) в крови, определение антител к сальмонелле тифи (Salmonella typhi) в крови, определение антител классов M, G (IgM, IgG) к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis) в крови, определение антител к сероварам иерсинии энтероколитика (Yersinia enterocolitica) в крови
|
C
|
|
50
|
Выполнено определение антител классов M, G (IgM, IgG) к шигелле Боуди (Shigella boydii) в крови, определение антител классов M, G (IgM, IgG) к шигелле дизентерии (Shigella dysenteriae) в крови, определение антител классов M, G (IgM, IgG) к шигелле Зонне (Shigella sonnei) в крови, определение антител классов M, G (IgM, IgG) к шигелле Флекснера (Shigella flexneri) в крови
|
C
|
|
51
|
Выполнено проведение этиотропной терапии при выявлении антител классов A и M в диагностическом титре, а также антител класса G в высоком титре к иерсинии псевдотуберкулеза (Yersinia pseudotuberculosis), к сероварам иерсинии энтероколитика (Yersinia enterocolitica), к сальмонелле кишечной (Salmonella enterica), к сальмонелле тифи (Salmonella typhi), к шигелле Боуди (Shigella boydii), к шигелле дизентерии (Shigella dysenteriae), к шигелле Зонне (Shigella sonnei), к шигелле Флекснера (Shigella flexneri) в крови
|
C
|
|
52
|
Выполнено определение антител классов A, M, G (IgA, IgM, IgG) к хламидии птичьей (Chlamydia psittaci) в крови; определение антител к хламидии трахоматис (Chlamydia trachomatis) в крови; определение антител к хламидии пневмонии (Chlamydophila pheumoniae) в крови, определение антител классов M, G (IgM, IgG) к микоплазме пневмонии (Mycoplasma pneumoniae) в крови
|
C
|
|
53
|
Выполнено проведение этиотропной терапии при выявлении антител классов A и M в диагностическом титре, а также антител класса G в высоком титре к микоплазме пневмонии (Mycoplasma pneumoniae), к хламидии трахоматис (Chlamydia trachomatis), к хламидии птичьей (Chlamydia Psittaci), хламидии пневмонии (Chlamydophila pheumoniae) в крови
|
C
|
|
54
|
Выполнено микробиологическое (культуральное) исследование слизи с миндалин и с задней стенки глотки на аэробные и факультативно анаэробные микроорганизмы
|
C
|
|
55
|
Выполнены общий (клинический) анализ мочи, исследование мочи методом Нечипоренко
|
C
|
|
56
|
Выполнена регистрация электрокардиограммы
|
C
|
|
57
|
Выполнено холтеровское мониторирование сердечного ритма пациентам с аритмией, патологическими изменениями по данным электрокардиографии
|
C
|
|
58
|
Выполнено суточное мониторирование артериального давления пациентам с артериальной гипертензией
|
C
|
|
59
|
Выполнено комплексное ультразвуковое исследование внутренних органов (включает УЗИ органов брюшной полости (комплексное), УЗИ почек)
|
C
|
|
60
|
Выполнена эхокардиография
|
C
|
|
61
|
Выполнена эзофагогастродуоденоскопия с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим НПВП и/или глюкокортикоиды, пациентам с диспепсическими явлениями
|
C
|
|
62
|
Выполнено микробиологическое (культуральное) исследование биоптатов слизистой желудка хеликобактер пилори (Helicobacter pylori) пациентам при наличии воспалительных и/или эрозивных, и/или язвенных изменений по данным эзофагогастродуоденоскопии
|
C
|
|
63
|
Выполнено назначение препаратов для лечения язвенной болезни желудка и двенадцатиперстной кишки и гастроэзофагеальной рефлюксной болезни при выявлении рефлюксной болезни и/или воспалительной гастропатии, эрозивных и/или язвенных процессов в пищеводе и/или желудке, и/или 12-перстной кишки по данным эзофагогастродуоденоскопии
|
C
|
|
64
|
Выполнено проведение эрадикационной терапии с назначением ингибиторов протонного насоса, антибактериальных препаратов системного действия, висмута трикалия дицитрата** в дозе 8 мг/кг/сут. в 1 - 2 приема (для пациентов в возрасте от 4 до 8 лет), в течение 4 - 8 нед., в дозе 120 мг 2 раза/сут. (для пациентов от 8 до 12 лет), в дозе 120 мг 4 раза/сут. или 240 мг 2 раза/сут. (для пациентов старше 12 лет) при воспалительной гастропатии, эрозивных и/или язвенных процессах в желудке и/или 12-перстной кишке, ассоциированных с Helicobacter pylori
|
C
|
|
65
|
Выполнена временная отмена иммунодепрессанта, и/или ГИБП всем пациентам на время проведения эрадикационной терапии
|
C
|
|
66
|
Выполнена магнитно-резонансная томография суставов (один сустав) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
B
|
|
67
|
Выполнена компьютерная томография органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения
|
C
|
|
68
|
Выполнена бронхоскопия с применением анестезиологического пособия (включая раннее послеоперационное ведение) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
69
|
Выполнено микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
70
|
Выполнено определение ДНК Pneumocystis jirovecii в мокроте, эндотрахеальном аспирате, бронхоальвеолярной лаважной жидкости методом ПЦР, количественное исследование всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
71
|
Выполнено определение антител класса M, G к Pneumocystis jirovecii всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
72
|
Выполнено микробиологическое (культуральное) исследование мокроты на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
73
|
Выполнено микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные) всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
74
|
Выполнено микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
75
|
Выполнено определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
76
|
Выполнено определение маннана, галактоманнана в лаважной жидкости и крови всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
B
|
|
77
|
Выполнено определение ДНК Mycoplasma pneumoniae в бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
78
|
Выполнено определение ДНК цитомегаловируса (Cytomegalovirus) в мокроте, бронхоальвеолярной лаважной жидкости методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
79
|
Выполнено определение ДНК Mycobacterium tuberculosis complex (M. tuberculosis, M. bovis, M. bovis BCG) с дифференциацией вида в мокроте, бронхоальвеолярной лаважной жидкости или промывных водах бронхов методом ПЦР всем пациентам при выявлении интерстициальных и/или очаговых, и/или инфильтративных изменений в легких по данным компьютерной томографии органов грудной полости
|
C
|
|
80
|
Выполнено назначение эмпирической антибактериальной терапии: #ко-тримоксазола** в комбинации с антибактериальными препаратами системного действия, влияющих на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз и/или цефалоспорины 4-го поколения, и/или карбапенемы, и/или другие антибактериальные препараты) в сочетании с противогрибковыми препаратами системного действия до выявления этиологического фактора интерстициальной пневмонии в зависимости от клинической ситуации
|
C
|
|
81
|
Выполнено назначение таргетной антибактериальной терапии: #ко-тримоксазола** в комбинации с антибактериальными препаратами системного действия, влияющими на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз и/или цефалоспорины 4-го поколения, и/или карбапенемы, и/или другие антибактериальные препараты) в сочетании с противогрибковыми препаратами системного действия, в сочетании с противовирусными препаратами системного действия при подтверждении этиологического фактора пневмонии в зависимости от клинической ситуации
|
C
|
|
82
|
Выполнено назначение ГК внутривенно, #ко-тримоксазола** в дозе 3,75 - 5,0 мг/кг/массы тела/введение (15 - 20 мг/кг/сут.) (по триметоприму) внутривенно каждые 8 часов при развитии среднетяжелой пневмоцистной пневмонии или в дозе 3,75 - 5,0 мг/кг/массы тела/введение (15 - 20 мг/кг/сут.) (по триметоприму) внутривенно каждые 6 - 8 часов при развитии тяжелой пневмоцистной пневмонии
|
C
|
|
83
|
Выполнено назначение #вориконазола** в дозе 6 мг/кг/введение внутривенно каждые 12 часов в первые 24 часа и 4 мг/кг начиная со вторых суток при выявлении галактаманнана в лаважной жидкости и/или в крови, и/или антител к грибам рода аспергиллы (Aspergillus spp.) в крови
|
C
|
|
84
|
Выполнено назначение флуконазола** внутривенно в дозе 6 - 12 мг/кг/сут. при выявлении маннана в лаважной жидкости и/или в крови
|
C
|
|
85
|
Выполнено назначение антибактериальных препаратов системного действия, влияющих на грамположительную, грамотрицательную и анаэробную флору (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз, и/или цефалоспорины 4-го поколения, и/или карбапенемы, и/или другие антибактериальные препараты) в сочетании с противогрибковыми препаратами системного действия при развитии очаговой или долевой пневмонии, или полисегментарной пневмонии
|
C
|
|
86
|
Выполнена временная отмена терапии ГИБП и/или иммунодепрессантом всем пациентам при подозрении/развитии пневмонии
|
C
|
|
87
|
Выполнено возобновление терапии ГИБП и/или иммунодепрессантом всем пациентам не ранее, чем через 1 нед. после полного купирования пневмонии по данным лабораторных исследований, контрольной компьютерной томографии органов грудной полости с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения и окончания антибактериальной терапии
|
C
|
|
88
|
Выполнена рентгенография височно-нижнечелюстного сустава и/или рентгенография межпозвоночных сочленений, и/или рентгенография локтевого сустава, и/или рентгенография лучезапястного сустава, и/или рентгенография коленного сустава, и/или рентгенография плечевого сустава, и/или рентгенография тазобедренного сустава, и/или рентгенография голеностопного сустава, и/или рентгенография акромиально-ключичного сочленения, и/или рентгенография грудинно-ключичного сочленения, и/или рентгенография кисти и/или рентгенография стопы в двух проекциях или компьютерная томография сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения всем пациентам с активным артритом в анамнезе
|
C
|
|
89
|
Выполнена рентгенденситометрия всем пациентам, получающим или получавшим ГК
|
C
|
|
90
|
Выполнено назначение препаратов кальция и витамина D и его аналогов пациентам с остеопенией/остеопорозом
|
C
|
|
91
|
Выполнено назначение #памидроновой кислоты или #алендроновой кислоты**, или #золедроновой кислоты**, или #ибандроновой кислоты
|
C
|
|
92
|
Выполнено назначение бифосфонатов в следующих режимах: #памидроновой кислоты пациентам < 1 года в дозе 0,5 мг/кг в/в каждые 2 мес., пациентам в возрасте 1 - 2 лет в дозе 0,25 - 0,5 мг/кг/сут. в/в в течение 3 дней каждые 3 мес., пациентам в возрасте 2 - 3- лет в дозе 0,375 - 0,75 мг/кг/сут. в/в в течение 3 дней каждые 3 месяца, пациентам старше 3 лет в дозе 0,5 - 1 мг/кг/сут. в/в в течение 3-х дней каждые 4 мес. (максимальная доза 60 мг/введение) или #алендроновой кислоты** в дозе 1 - 2 мг/кг/нед. перорально, пациентам с массой тела < 40 кг в дозе 5 мг/сут. или 35 мг/нед., пациентам с массой тела > 40 кг в дозе 10 мг/сут. или 70 мг/нед. (максимальная доза 70 мг/нед.), или #золедроновой кислоты** в дозе 0,0125 - 0,05 мг/кг/введение в/в каждые 6 - 12 мес. (максимальная доза 4 мг) с целью лечения остепороза или #ибандроновой кислоты в дозе 3 мг/введение в/в 1 раз в 3 мес. или 150 мг перорально 1 раз в мес.
|
C
|
|
93
|
Выполнена доконтактная профилактика новой коронавирусной инфекции, пациентам в возрасте 12 лет и старше с массой тела не менее 40 кг, до назначения или любом этапе терапии иммунодепрессантами и/или ГИБП, и/или ГК, путем проведения пассивной иммунизации препаратами противовирусных моноклональных антител
|
C
|
|
94
|
Выполнена вакцинация вакциной для профилактики пневмококковой инфекции полисахаридной, конъюгированной, адсорбированной**, содержащей капсулярные полисахариды 13 серотипов пневмококка до назначения или на любом этапе терапии иммунодепрессантами и/или ГИБП в сочетании или без с ГК
|
C
|
|
95
|
Выполнен прием (осмотр, консультация) врача-оториноларинголога первичный
|
C
|
|
96
|
Выполнен прием (осмотр, консультация) врача-стоматолога детского первичный всем пациентам, получающим иммунодепрессанты и/или ГИБП в сочетании (или без) с ГК
|
C
|
|
97
|
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный с обязательной биомикроскопией глаза
|
C
|
|
98
|
Выполнен прием (осмотр, консультация) врача-детского кардиолога первичный пациентам с нарушением сердечной деятельности и/или артериальной гипертензией
|
C
|
|
99
|
Выполнен прием (осмотр, консультация) врача-фтизиатра первичный всем пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или очаговыми, инфильтративными изменениями в легких
|
C
|
|
100
|
Выполнен прием (осмотр, консультация) врача-детского эндокринолога первичный пациентам с эндокринологической патологией, в том числе, получающим ГК
|
C
|
|
101
|
Выполнен прием (осмотр, консультация) врача-диетолога первичный пациентам с дефицитом массы тела, амиотрофией, остеопенией/остеопорозом, конституциональным ожирением и синдромом Кушинга, стероидным диабетом
|
C
|
|
102
|
Выполнен прием (осмотр, консультация) врача-травматолога-ортопеда первичный всем пациентам с функциональной недостаточностью суставов, нарушением роста костей в длину, подвывихах, болью в спине
|
C
|
|
103
|
Выполнен прием (осмотр, консультация) врача-невролога первичный пациентам с неврологической симптоматикой, отставанием в психомоторном развитии, психотическими реакциями
|
C
|
|
104
|
Выполнен прием (осмотр, консультация) врача-невролога повторный пациентам с неврологической симптоматикой, отставанием в психомоторном развитии, психотическими реакциями для оценки эффективности терапии
|
C
|
|
105
|
Выполнен прием (тестирование, консультация) медицинского психолога первичный всем пациентам с возраста 1 года и их родителям
|
A
|
|
106
|
Выполнен осмотр (консультация) врача-физиотерапевта первичный всем пациентам с функциональной недостаточностью
|
C
|
|
107
|
Выполнен осмотр (консультация) врача-физиотерапевта повторный пациентам после программы физиотерапевтических процедур
|
C
|
|
108
|
Выполнен прием (осмотр, консультация) врача по лечебной физкультуре всем пациентам с функциональной недостаточностью
|
C
|
|
109
|
Выполнена медицинская реабилитация всем пациентам с функциональной недостаточностью
|
B
|
|
110
|
Выполнен прием (осмотр, консультация) врача по лечебной физкультуре повторный всем пациентам с функциональной недостаточностью после окончания программы реабилитации
|
C
|
|
111
|
Выполнена коррекция противоревматической терапии в ревматологическом отделении стационара, инициировавшем лечение ГИБП и/или иммунодепрессантом, при недостижении стадии неактивной болезни через 6 мес., ремиссии - через 12 мес. и далее каждые 6 мес.
|
C
|
|
112
|
Выполнена коррекция противоревматической терапии в ревматологическом отделении стационара, инициировавшем лечение ГИБП и/или иммунодепрессантом на любом этапе лечения при развитии нежелательных явлений на фоне лечения ГИБП и/или иммунодепрессантом
|
C
|
|
113
|
Выполнено соблюдение онко-настороженности в связи с возможным развитием онкологических/онкогематологических/лимфопролиферативных заболеваний на фоне терапии ГИБП на любом этапе лечения
|
C
|
|
114
|
Выполнена немедленная отмена иммунодепрессанта и/или ГИБП и госпитализация пациента при подозрении на развитие онкологического/онкогематологического/лимфопролиферативного заболевания
|
C
|
|
115
|
Выполнено получение цитологического препарата костного мозга путем пункции с применением анестезиологического пособия (включая раннее послеоперационное ведение) и гистологического препарата костного мозга с цитологическим исследованием мазка костного мозга (миелограмма), патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов пациентам, получающим иммунодепрессант и/или ГИБП, с нетипичным течением болезни
|
C
|
|
116
|
Выполнена биопсия лимфатического узла (периферического, по показаниям - внутрибрюшного, внутригрудного) с применением анестезиологического пособия (включая раннее послеоперационное ведение) с цитологическим исследованием препарата тканей лимфоузла и патолого-анатомическим исследованием биопсийного (операционного) материала лимфоузла пациентам с выраженным увеличением размеров периферических и/или внутригрудных, и/или внутрибрюшных лимфатических узлов, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни
|
C
|
|
117
|
Выполнена компьютерная томография органов грудной полости с внутривенным болюсным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни
|
C
|
|
118
|
Выполнена магнитно-резонансная томография головного мозга с контрастированием, магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием, магнитно-резонансная томография забрюшинного пространства с внутривенным контрастированием и магнитно-резонансная томография органов малого таза с внутривенным контрастированием с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП, с нетипичным течением болезни
|
C
|
|
119
|
Выполнена магнитно-резонансная томография костной ткани (одна область) и магнитно-резонансная томография суставов (один сустав) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения с внутривенным контрастированием пациентам, получающим иммунодепрессант и/или ГИБП, с нетипичным течением болезни
|
C
|
|
120
|
Выполнена компьютерная томография кости и компьютерная томография сустава с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП, с очагами деструкции в костях, нетипичными для ЮА
|
C
|
|
121
|
Выполнена позитронная эмиссионная томография, совмещенная с компьтерной томографией с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами), с контрастированием, при необходимости, позитронная эмиссионная томография всего тела с туморотропными радиофармпрепаратами (диагностическими радиофармацевтическими средствами) с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП, с выраженной артралгией, миалгией, оссалгией, деструктивными изменениями в костях, инфильтратами в подкожно-жировой клетчатке, очагами в паренхиматозных органах, головном мозге, спинном мозге
|
C
|
|
122
|
Выполнена сцинтиграфия полипозиционная костей с применением анестезиологического пособия (включая раннее послеоперационное ведение) или без его применения пациентам, получающим иммунодепрессант и/или ГИБП, с очагами деструкции в костях, нетипичными для ЮА
|
C
|
|
123
|
Выполнена трепанобиопсия костей таза под контролем компьютерной томографии с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов; цитологическим исследованием отпечатков трепанобиоптата костного мозга; иммуноцитохимическим исследованием отпечатков трепанобиоптата костного мозга; иммунофенотипированием гемопоэтических клеток-предшественниц в костном мозге пациентам, получающим иммунодепрессант и/или ГИБП с нетипичным течением болезни
|
C
|
|
124
|
Выполнена биопсия кости с применением анестезиологического пособия (включая раннее послеоперационное ведение) с патолого-анатомическим исследованием биопсийного (операционного) материала костной ткани пациентам, получающим иммунодепрессант и/или ГИБП, с очагами деструкции в костях, не типичными для ЮА
|
C
|
|
125
|
Выполнен прием (осмотр, консультация) врача-детского онколога первичный пациентам, у которых по результатам обследования заподозрено/выявлено онкологическое/онкогематологическое/лимфопролиферативное заболевание, либо метастатическое поражение
|
C
|
Таблица 10. Критерии оценки качества контроля диспансерного наблюдения пациентов с юношеским артритом в амбулаторно-поликлинических условиях
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
|
1
|
Выполнен прием (осмотр, консультация) врача-ревматолога первичный
|
C
|
|
2
|
Выполнено прием (осмотр, консультация) врача-ревматолога повторный (с оценкой эффективности и безопасности терапии не реже 1 раза в мес. после инициации/коррекции терапии и не реже одного раза в 3 мес. после достижения ремиссии заболевания, с оценкой необходимости направления на внеплановую госпитализацию в ревматологическое отделение стационара, инициировавшего терапию генно-инженерным биологическим препаратом и/или иммунодепрессантом на любом этапе лечения при развитии обострения/осложнений, сопутствующих заболеваний, осложнений/побочных эффектов/стойкой непереносимости терапии и направлением на плановую госпитализацию в ревматологическое отделение стационара, инициировавшего терапию генно-инженерным биологическим препаратом и/или иммунодепрессантом через 3 и 6 мес. после назначения/коррекции терапии и далее каждые 6 мес. и с проведением дистанционной консультации с врачом-ревматологом стационара, инициировавшего назначение терапии, всем пациентам при развитии любых признаков неэффективности и/или непереносимости терапии
|
C
|
|
3
|
Выполнен прием (осмотр, консультация) врача-педиатра
|
C
|
|
4
|
Выполнен диспансерный прием (осмотр, консультация) врача-педиатра или диспансерный прием (осмотр, консультация) врача-педиатра участкового пациентам с юношеским артритом при отсутствии врача-ревматолога по месту жительства не реже 1 раза в мес. после инициации/коррекции терапии и не реже одного раза в 3 мес. после достижения ремиссии заболевания
|
C
|
|
5
|
Выполнено переключение первично назначенных иммунодепрессанта и/или селективного иммунодепрессанта на дженерик, и/или ГИБП на биоаналог исключительно при доказанной терапевтической эффективности и безопасности дженерика или биоаналога у педиатрической популяции пациентов с аналогичной нозологической формой
|
C
|
|
6
|
Выполнено немедленное прекращение инфузии/инъекции ГИБП и/или инъекции/приема иммунодепрессанта в случае развития аллергической реакции любой степени выраженности
|
C
|
|
7
|
Выполнено назначение антигистаминных средств системного действия и/или ГК при развитии аллергической реакции на введение ГИБП и/или иммунодепрессанта
|
C
|
|
8
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при развитии аллергической реакции на прием и/или введение ГИБП и/или иммунодепрессанта
|
C
|
|
9
|
Выполнена экстренная госпитализация в стационар при развитии аллергической реакции на прием и/или введение ГИБП и/или иммунодепрессанта
|
C
|
|
10
|
Выполнен общий (клинический) анализ крови, развернутый (исследование скорости оседания эритроцитов, исследование уровня эритроцитов в крови, исследование уровня лейкоцитов в крови, исследование уровня тромбоцитов в крови, проведение дифференцированного подсчета лейкоцитов (лейкоцитарная формула)), исследование уровня общего гемоглобина не реже 1 раза в 2 - 4 нед.
|
C
|
|
11
|
Выполнена отмена иммунодепрессанта и/или ГИБП, продолжение приема ранее назначенных ГК перорально при снижении числа тромбоцитов <= 150 > 100 x 109/л, числа нейтрофилов < 1,5 >= 1,0 x 109/л по данным общего (клинического) анализа крови развернутого
|
C
|
|
12
|
Выполнено назначение колониестимулирующего фактора #филграстима** в дозе 5 - 10 мкг/кг/сут. подкожно при снижении уровня лейкоцитов с абсолютным числом нейтрофилов < 1,0 x 109/л в течение 3 - 5 дней (при необходимости - дольше)
|
C
|
|
13
|
Выполнено назначение колониестимулирующего фактора #филграстима** в дозе 5 - 10 мкг/кг/сут. подкожно, срочная госпитализация в стационар по месту жительства, назначение антибактериальных препаратов системного действия внутривенно при развитии фебрильной нейтропении (нейтропения, сопровождающаяся лихорадкой) с абсолютным числом нейтрофилов < 1,0 x 109/л
|
C
|
|
14
|
Выполнено продолжение терапии иммунодепрессантом и/или ГИБП в прежней дозе после нормализации показателей общего (клинического) анализа крови и повышения числа нейтрофилов крови >= 1,5 x 109/л
|
C
|
|
15
|
Выполнено назначение флуконазола** 3 - 12 мг/кг/сут. перорально в зависимости от выраженности и длительности сохранения индуцированной нейтропении, пациентам с нейтропенией
|
C
|
|
16
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при повторном эпизоде снижения числа нейтрофилов, развитии фебрильной нейтропении и/или снижения числа тромбоцитов крови по данным общего (клинического) анализа крови
|
C
|
|
17
|
Выполнено исследование уровня общего белка в крови, исследование уровня альбумина в крови, исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови, исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, исследование уровня глюкозы в крови, исследование уровня ферритина в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, определение активности лактатдегидрогеназы в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глютамилтрансферазы в крови, определение активности щелочной фосфатазы в крови, исследование уровня железа сыворотки не реже 1 раза в 2 - 4 нед.
|
C
|
|
18
|
Выполнена временная отмена терапии иммунодепрессантом, и/или ГИБП, продолжение приема ранее назначенных ГК перорально при повышении активности АЛТ, АСТ в крови выше верхней границы нормы >= 1,5 раза и/или других биохимических показателей выше верхней границы нормы
|
C
|
|
19
|
Выполнено продолжение терапии иммунодепрессантом и/или ГИБП в той же дозе после нормализации биохимического(их) показателя(ей)
|
C
|
|
20
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при наличии данных о повторных эпизодах повышения биохимического(их) показателя(ей) крови
|
C
|
|
21
|
Выполнено определение содержания ревматоидного фактора (РФ) в крови, определение содержания антител к циклическому цитруллиновому пептиду (анти-ССР) в крови, не реже 1 раз в 3 мес. пациентам с серопозитивным ЮА
|
C
|
|
22
|
Выполнено определение содержания антител к антигенам ядра клетки и ДНК в крови пациентам, получающим ингибиторы ФНО-альфа не реже 1 раза в 3 мес.
|
C
|
|
23
|
Выполнена отмена терапии ингибитором ФНО-альфа, продолжение приема ранее назначенных иммунодепрессанта подкожно или перорально и/или ГК перорально при повышении содержания антител к антигенам ядра клетки и ДНК в сыворотке крови
|
C
|
|
24
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при повышении содержания антител к антигенам ядра клетки и ДНК в сыворотке крови
|
C
|
|
25
|
Выполнено исследование уровня C-реактивного белка в сыворотке крови не реже 1 раза в 3 мес.
|
C
|
|
26
|
Выполнено исследование уровня иммуноглобулинов в крови не реже 1 раза в 3 мес.
|
C
|
|
27
|
Выполнена временная отмена терапии ГИБП и/или иммунодепрессантом, продолжение приема ранее назначенных ГК перорально при снижении уровня иммуноглобулинов в крови
|
C
|
|
28
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при снижении уровня иммуноглобулинов крови
|
C
|
|
29
|
Выполнена госпитализация в стационар пациентам со снижением уровня иммуноглобулинов крови
|
C
|
|
30
|
Выполнено определение антистрептолизина-O в сыворотке крови не реже 1 раза в 3 мес.
|
C
|
|
31
|
Выполнена временная отмена терапии иммунодепрессантом и/или ГИБП, продолжение приема ранее назначенных ГК перорально при появлении признаков инфекционного осложнения
|
C
|
|
32
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при появлении признаков инфекционного осложнения
|
C
|
|
33
|
Выполнена экстренная госпитализация пациента в стационар при подозрении/развитии пневмонии
|
C
|
|
34
|
Выполнена временная отмена терапии ГИБП и/или иммунодепрессанта, продолжение приема ранее назначенных ГК перорально при подозрении/развитии пневмонии
|
C
|
|
35
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при подозрении/развитии пневмонии
|
C
|
|
36
|
Выполнено назначение #ацикловира** в дозе 200 мг перорально 5 раз в сутки детям в возрасте старше 2 лет (не более 1000 мг/сут.) при развитии локальной герпетической инфекции
|
C
|
|
37
|
Выполнена временная отмена терапии ГИБП и/или иммунодепрессанта продолжение приема ранее назначенных ГК перорально при развитии инфекции, вызванной герпес-вирусами на весь период проведения противовирусной терапии
|
C
|
|
38
|
Выполнена госпитализация в стационар при генерализации герпетической инфекции/подозрении на развитие цитомегаловирусной/Эпштейна-Барр вирусной инфекции
|
C
|
|
39
|
Выполнено возобновление терапии иммунодепрессантом, и/или ГИБП всем пациентам не ранее, чем через 1 нед. после полного купирования клинических и лабораторных признаков инфекции и окончания противовирусной терапии
|
C
|
|
40
|
Не выполнена вакцинация живыми и живыми ослабленными вакцинами у пациентов, получающих ГИБП
|
C
|
|
41
|
Выполнена вакцинация детей только в период ремиссии заболевания, при ее сохранении не менее 6 мес., по индивидуальному графику, исключая живые вакцины
|
C
|
|
42
|
Выполнен контроль эффективности ГИБП и/или иммунодепрессанта
|
C
|
|
43
|
Выполнен контроль переносимости ГИБП и/или иммунодепрессанта
|
C
|
|
44
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии всем пациентам при развитии любых признаков непереносимости иммунодепрессанта и/или ГИБП
|
C
|
|
45
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии при повышении клинических и/или лабораторных показателей активности заболевания и/или развитии любых признаков непереносимости иммунодепрессанта, и/или ГИБП
|
C
|
|
46
|
Выполнена очаговая проба с туберкулином (реакция Манту, с аллергеном туберкулезным рекомбинантным в стандартном разведении**) не реже 1 раза в 6 мес. (по показаниям - чаще)
|
C
|
|
47
|
Выполнен общий (клинический) анализ мочи, исследование мочи методом Нечипоренко не реже 1 раза в мес.
|
C
|
|
48
|
Выполнена отмена терапии метотрексатом**, продолжение терапии ГИБП, приема ранее назначенных ГК перорально при появлении гематурии
|
C
|
|
49
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, при появлении гематурии
|
C
|
|
50
|
Выполнена регистрация электрокардиограммы не реже 1 раз в 3 мес.
|
C
|
|
51
|
Выполнены ультразвуковое исследование органов брюшной полости (комплексное), эхокардиография, ультразвуковое исследование почек не реже 1 раз в 6 мес.
|
C
|
|
52
|
Выполнен прием (осмотр, консультация) врача-оториноларинголога первичный (пациентам с патологией ЛОР-органов, не позднее чем через 7 дней после выписки из стационара)
|
C
|
|
53
|
Выполнен диспансерный прием (осмотр, консультация) врача-оториноларинголога (не реже 1 раза в 6 мес.)
|
C
|
|
54
|
Выполнен прием (осмотр, консультация) врача-детского кардиолога первичный по медицинским показаниям
|
C
|
|
55
|
Выполнен диспансерный прием (осмотр, консультация) врача-детского кардиолога по медицинским показаниям
|
C
|
|
56
|
Выполнен прием (осмотр, консультация) врача-стоматолога детского первичный пациентам, которым необходима санация очагов хронической инфекции и лечение острой инфекции ротовой полости
|
C
|
|
57
|
Выполнен диспансерный прием (осмотр, консультация) врача-стоматолога детского по медицинским показаниям
|
C
|
|
58
|
Выполнен прием (осмотр, консультация) врача-офтальмолога первичный (с проведением биомикроскопии глаза не позднее чем через 7 дней после выписки из стационара пациентам при наличии офтальмологической патологии)
|
C
|
|
59
|
Выполнен прием (осмотр, консультация) врача-офтальмолога повторный с обязательной биомикроскопией глаза всем пациентам с офтальмологической патологией по индивидуальным показаниям
|
C
|
|
60
|
Выполнен диспансерный прием (осмотр, консультация) врача-офтальмолога (с проведением биомикроскопии глаза, не реже 1 раза в 3 мес.)
|
C
|
|
61
|
Выполнен прием (осмотр, консультация) врача-диетолога первичный по медицинским показаниям
|
C
|
|
62
|
Выполнен прием (осмотр, консультация) врача-диетолога повторный по индивидуальным показаниям
|
C
|
|
63
|
Выполнен прием (осмотр, консультация) врача-фтизиатра первичный (при наличии положительной очаговой пробы и/или внутрикожной пробы с туберкулезным аллергеном с туберкулином, и/или с инфильтративными очагами в легких)
|
C
|
|
64
|
Выполнен прием (осмотр, консультация, в том числе дистанционная) врача-ревматолога стационара, инициировавшего назначение терапии, пациентам с положительной внутрикожной пробой с туберкулином
|
C
|
|
65
|
Выполнен прием (осмотр, консультация) врача-фтизиатра повторный пациентам с положительной очаговой пробой с туберкулином и/или внутрикожной пробой с туберкулезным аллергеном, и/или повышенным уровнем интерферона-гамма на антигены Mycobacterium tuberculosis complex в крови, и/или очаговыми, инфильтративными изменениями в легких
|
C
|
|
66
|
Выполнен прием (осмотр, консультация) врача-детского эндокринолога первичный по медицинским показаниям
|
C
|
|
67
|
Выполнен диспансерный прием (осмотр, консультация) врача-детского эндокринолога по медицинским показаниям
|
C
|
|
68
|
Выполнен прием (осмотр, консультация) врача-травматолога-ортопеда первичный по медицинским показаниям
|
C
|
|
69
|
Выполнен прием (осмотр, консультация) врача-травматолога-ортопеда повторный по медицинским показаниям
|
C
|
|
70
|
Выполнен диспансерный прием (осмотр, консультация) врача-травматолога-ортопеда по медицинским показаниям
|
C
|
|
71
|
Выполнен прием (тестирование, консультация) медицинского психолога первичный по медицинским показаниям
|
C
|
|
72
|
Выполнен прием (тестирование, консультация) медицинского психолога повторный по медицинским показаниям после завершения программы психологической реабилитации
|
C
|
|
73
|
Выполнен диспансерный прием (тестирование, консультация) медицинского психолога по медицинским показаниям
|
C
|
|
74
|
Выполнен прием (осмотр, консультация) врача-физиотерапевта первичный по медицинским показаниям
|
C
|
|
75
|
Выполнен прием (осмотр, консультация) врача по лечебной физкультуре первичный по медицинским показаниям
|
C
|
|
76
|
Выполнена медицинская реабилитация всем пациентам с функциональной недостаточностью
|
B
|
|
77
|
Выполнен прием (осмотр, консультация) врача-физиотерапевта повторный всем пациентам, выполнившим программу медицинской реабилитации
|
C
|
|
78
|
Выполнен прием (осмотр, консультация) врача по лечебной физкультуре повторный всем пациентам, выполнившим программу медицинской реабилитации
|
C
|
|
79
|
Выполнен диспансерный прием (осмотр, консультация) врача по лечебной физкультуре по медицинским показаниям
|
C
|
|
80
|
Выполнена внеплановая госпитализация по показаниям в ревматологическое отделение стационара, инициировавшего назначение ГИБП/иммунодепрессанта на любом этапе лечения при развитии обострения/осложнений сЮА, сопутствующих заболеваний, осложнений/побочных эффектов/стойкой непереносимости ГИБП/иммунодепрессанта
|
C
|
|
81
|
Выполнена плановая госпитализация в ревматологическое отделение стационара, инициировавшего терапию ГИБП и/или иммунодепрессанта, всех пациентов через 3 и 6 мес. после назначения терапии и далее каждые 6 мес.
|
C
|
Список литературы
1. Petty RE, Laxer RM, Lindsley CB, et al. Textbook of pediatric rheumatology. 8th ed. Philadelphia: Elsevier, Inc 2020.
2. Zaripova LN, Midgley A, Christmas SE, et al. Juvenile idiopathic arthritis: from aetiopathogenesis to therapeutic approaches. Pediatr Rheumatol. 2021; 19: 135. doi: 10.1186/s12969-021-00629-8
3. Баранов АА, Алексеева ЕИ, editors. Ревматические болезни у детей. Москва: ПедиатрЪ 2016.
4. Alexeeva EI. Juvenile idiopathic arthritis: clinical picture, diagnosis, treatment. Curr Pediatr. 2015; 14: 78 - 94. doi: 10.15690/vsp.v14i1.1266
5. Mistry RR, Patro P, Agarwal V, et al. Enthesitis-related arthritis: current perspectives. Open Access Rheumatol Res Rev. 2019; Volume 11: 19 - 31. doi: 10.2147/OARRR.S163677
6. Chen B, Li J, He C, et al. Role of HLA-B27 in the pathogenesis of ankylosing spondylitis. Mol Med Rep. 2017; 15: 1943 - 51. doi: 10.3892/mmr.2017.6248
7. Paramarta JE, Van Der Leij C, Gofita I, et al. Peripheral joint inflammation in early onset spondyloarthritis is not specifically related to enthesitis. Ann Rheum Dis. 2014; 73: 735 - 40. doi: 10.1136/annrheumdis-2012-203155
8. Scola MP, Thompson SD, Brunner HI, et al. Interferon-gamma: interleukin 4 ratios and associated type 1 cytokine expression in juvenile rheumatoid arthritis synovial tissue. J Rheumatol. 2002; 29: 369 - 78.
9. Baerlecken NT, Nothdorft S, Stummvoll GH, et al. Autoantibodies against CD74 in spondyloarthritis. Ann Rheum Dis. 2014; 73: 1211 - 4. doi: 10.1136/annrheumdis-2012-202208
10. Shukla A, Gaur P, Aggarwal A. Effect of probiotics on clinical and immune parameters in enthesitis-related arthritis category of juvenile idiopathic arthritis. Clin Exp Immunol. 2016; 185: 301 - 8. doi: 10.1111/cei.12818
11. Palman J, Shoop-Worrall S, Hyrich K, et al. Update on the epidemiology, risk factors and disease outcomes of Juvenile idiopathic arthritis. Best Pract Res Clin Rheumatol. 2018; 32: 206 - 22. doi: 10.1016/j.berh.2018.10.004
12. Cattalini M, Soliani M, Caparello MC, et al. Sex Differences in Pediatric Rheumatology. Clin Rev Allergy Immunol. 2019; 56: 293 - 307. doi: 10.1007/s12016-017-8642-3
13. Thierry S, Fautrel B, Lemelle I, et al. Prevalence and incidence of juvenile idiopathic arthritis: a systematic review. Joint Bone Spine. 2014; 81: 112 - 7. doi: 10.1016/j.jbspin.2013.09.003
14. Burgos-Vargas R, Tse SML. Juvenile-Onset Spondyloarthritis. Handbook of Systemic Autoimmune Diseases. Elsevier 2016: 31 - 52.
15. Clarke SLN, Sen ES, Ramanan AV. Juvenile idiopathic arthritis-associated uveitis. Pediatr Rheumatol Online J. 2016; 14: 27. doi: 10.1186/s12969-016-0088-2
16. Vitale AT, Graham E, de Boer JH. Juvenile idiopathic arthritis-associated uveitis: clinical features and complications, risk factors for severe course, and visual outcome. Ocul Immunol Inflamm. 2013; 21: 478 - 85. doi: 10.3109/09273948.2013.815785
17. Katargina LA, Brzheskiy VV, Guseva MR, et al. The federal clinical guidelines on "The diagnostics and treatment of uveitis associated with juvenile idiopathic arthritis." Russ Pediatr Ophthalmol. 2016; 11: 102 - 11. doi: 10.18821/1993-1859-2016-11-2-102-111
18. Petty RE, Southwood TR, Manners P, et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001. J Rheumatol. 2004; 31: 390 - 2.
19.  B, Hoffmann-Vold A, Reiff A, et al. Long-term outcome and prognostic factors in enthesitis-related arthritis: A case-control study. Arthritis Rheum. 2006; 54: 3573 - 82. doi: 10.1002/art.22181
B, Hoffmann-Vold A, Reiff A, et al. Long-term outcome and prognostic factors in enthesitis-related arthritis: A case-control study. Arthritis Rheum. 2006; 54: 3573 - 82. doi: 10.1002/art.22181
20. Weiss PF, Beukelman T, Schanberg LE, et al. Enthesitis-related Arthritis Is Associated with Higher Pain Intensity and Poorer Health Status in Comparison with Other Categories of Juvenile Idiopathic Arthritis: The Childhood Arthritis and Rheumatology Research Alliance Registry. J Rheumatol. 2012; 39: 2341 - 51. doi: 10.3899/jrheum.120642
21. Oen K, Duffy CM, Tse SML, et al. Early outcomes and improvement of patients with juvenile idiopathic arthritis enrolled in a Canadian multicenter inception cohort. Arthritis Care Res. 2010; 62: 527 - 36. doi: 10.1002/acr.20044
22. Rostom S, Amine B, Bensabbah R, et al. Hip involvement in juvenile idiopathic arthritis. Clin Rheumatol. 2008; 27: 791 - 4. doi: 10.1007/s10067-008-0853-9
23. Sherry DD, Sapp LR. Enthesalgia in childhood: site-specific tenderness in healthy subjects and in patients with seronegative enthesopathic arthropathy. J Rheumatol. 2003; 30: 1335 - 40.
24. Weiss P. Diagnosis and treatment of enthesitis-related arthritis. Adolesc Health Med Ther. 2012; 67. doi: 10.2147/AHMT.S25872
25. Minden K, Niewerth M, Listing J, et al. Long-term outcome in patients with juvenile idiopathic arthritis. Arthritis Rheum. 2002; 46: 2392 - 401. doi: 10.1002/art.10444
26. Chen H-A, Chen C-H, Liao H-T, et al. Clinical, Functional, and Radiographic Differences Among Juvenile-onset, Adult-onset, and Late-onset Ankylosing Spondylitis. J Rheumatol. 2012; 39: 1013 - 8. doi: 10.3899/jrheum.111031
27. Weiss PF, Xiao R, Biko DM, et al. Assessment of Sacroiliitis at Diagnosis of Juvenile Spondyloarthritis by Radiography, Magnetic Resonance Imaging, and Clinical Examination. Arthritis Care Res. 2016; 68: 187 - 94. doi: 10.1002/acr.22665
28. Stoll ML, Bhore R, Dempsey-Robertson M, et al. Spondyloarthritis in a Pediatric Population: Risk Factors for Sacroiliitis. J Rheumatol. 2010; 37: 2402 - 8. doi: 10.3899/jrheum.100014
29. Maghraoui AE, Bensabbah R, Bahiri R, et al. Cervical spine involvement in ankylosing spondylitis. Clin Rheumatol. 2003; 22: 94 - 8. doi: 10.1007/s10067-002-0681-2
30. Haasnoot AJW, van Tent-Hoeve M, Wulffraat NM, et al. Erythrocyte sedimentation rate as baseline predictor for the development of uveitis in children with juvenile idiopathic arthritis. Am J Ophthalmol. 2015; 159: 372 - 377.e1. doi: 10.1016/j.ajo.2014.11.007
31. Heiligenhaus A, Minden K,  D, et al. Uveitis in juvenile idiopathic arthritis. Dtsch Arzteblatt Int. 2015; 112: 92 - 100, i. doi: 10.3238/arztebl.2015.0092
D, et al. Uveitis in juvenile idiopathic arthritis. Dtsch Arzteblatt Int. 2015; 112: 92 - 100, i. doi: 10.3238/arztebl.2015.0092
32. Баранов АА, Алексеева ЕИ, Бзарова ТМ, et al. Протокол ведения пациентов с ювенильным артритом. Вопросы Современной Педиатрии. 2013; 12: 37 - 56.
33. Textbook of Pediatric Rheumatology. Elsevier 2016.
34. Koca B, Sahin S, Adrovic A, et al. Cardiac involvement in juvenile idiopathic arthritis. Rheumatol Int. 2017; 37: 137 - 42. doi: 10.1007/s00296-016-3534-z
35. Huppertz H-I, Voigt I,  J, et al. Cardiac Manifestations in Patients with HLA B27-Associated Juvenile Arthritis. Pediatr Cardiol. 2000; 21: 141 - 7. doi: 10.1007/s002469910023
J, et al. Cardiac Manifestations in Patients with HLA B27-Associated Juvenile Arthritis. Pediatr Cardiol. 2000; 21: 141 - 7. doi: 10.1007/s002469910023
36. Alam MM, Ray B, Sarkar S, et al. Spirometric evaluation in juvenile idiopathic arthritis: data from eastern India. Indian J Pediatr. 2014; 81: 1010 - 4. doi: 10.1007/s12098-013-1335-x
37. Kim KH, Kim DS. Juvenile idiopathic arthritis: Diagnosis and differential diagnosis. Korean J Pediatr. 2010; 53: 931 - 5. doi: 10.3345/kjp.2010.53.11.931
38. Jeamsripong S, Charuvanij S. Features distinguishing juvenile idiopathic arthritis among children with musculoskeletal complaints. World J Pediatr WJP. 2020; 16: 74 - 81. doi: 10.1007/s12519-018-0212-0
39. Hu-Torres S, Foster CS. Disease of the year: juvenile idiopathic arthritis--differential diagnosis. Ocul Immunol Inflamm. 2014; 22: 42 - 55. doi: 10.3109/09273948.2013.835430
40. Al-Mayouf SM. Noninflammatory disorders mimic juvenile idiopathic arthritis. Int J Pediatr Adolesc Med. 2018; 5: 1 - 4. doi: 10.1016/j.ijpam.2018.01.004
41. Brix N,  S, Glerup M, et al. Identifying acute lymphoblastic leukemia mimicking juvenile idiopathic arthritis in children. PloS One. 2020; 15: e0237530. doi: 10.1371/journal.pone.0237530
S, Glerup M, et al. Identifying acute lymphoblastic leukemia mimicking juvenile idiopathic arthritis in children. PloS One. 2020; 15: e0237530. doi: 10.1371/journal.pone.0237530
42. Okamoto N, Yokota S, Takei S, et al. Clinical practice guidance for juvenile idiopathic arthritis (JIA) 2018. Mod Rheumatol. 2019; 29: 41 - 59. doi: 10.1080/14397595.2018.1514724
43. Nordal EB, Zak M, Aalto K, et al. Validity and predictive ability of the juvenile arthritis disease activity score based on CRP versus ESR in a Nordic population-based setting. Ann Rheum Dis. 2012; 71: 1122 - 7. doi: 10.1136/annrheumdis-2011-200237
44. Breda, L., Nozzi, M., De Sanctis, S., & Chiarelli, F. (2010). Laboratory Tests in the Diagnosis and Follow-Up of Pediatric Rheumatic Diseases: An Update. Seminars in Arthritis and Rheumatism, 40(1), 53 - 72. doi: 10.1016/j.semarthrit.2008.12.
45. Onel KB, Horton DB, Lovell DJ, et al. 2021 American College of Rheumatology Guideline for the Treatment of Juvenile Idiopathic Arthritis: Recommendations for Nonpharmacologic Therapies, Medication Monitoring, Immunizations, and Imaging. Arthritis Rheumatol. 2022; 74: 570 - 85. doi: 10.1002/art.42036
46. Тепаев РФ. Синдром диссеминированного внутрисосудистого свертывания у детей. Диагностика и лечение. Педиатрическая Фармакология. 2010; 7: 27 - 31.
47. Rajagopal R, Thachil J, Monagle P. Disseminated intravascular coagulation in paediatrics. Arch Dis Child. 2017; 102: 187 - 93. doi: 10.1136/archdischild-2016-311053
48. De Vere-Tyndall A, Macauley D, Ansell BM. Disseminated intravascular coagulation complicating systemic juvenile chronic arthritis ("Still's disease"). Clin Rheumatol. 1983; 2: 415 - 8. doi: 10.1007/BF02041564
49. Gallistl S, Mangge H, Neuwirth G, et al. Activation of the haemostatic system in children with juvenile rheumatoid arthritis correlates with disease activity. Thromb Res. 1998; 92: 267 - 72. doi: 10.1016/s0049-3848(98)00145-5
50. Ameri A, Anderson CM, Smith JH, et al. Thromboembolic Complications in a Pediatric Patient Population: Treatment with Direct Oral Anticoagulants. Monitoring of Treatment Efficiency with D-Dimer Levels and Safety Profile By Thromboelastogram. Blood. 2021; 138: 4270 - 4270. doi: 10.1182/blood-2021-146948
51. Oren H,  I, Duman M, et al. Disseminated intravascular coagulation in pediatric patients: clinical and laboratory features and prognostic factors influencing the survival. Pediatr Hematol Oncol. 2005; 22: 679 - 88. doi: 10.1080/08880010500278749
I, Duman M, et al. Disseminated intravascular coagulation in pediatric patients: clinical and laboratory features and prognostic factors influencing the survival. Pediatr Hematol Oncol. 2005; 22: 679 - 88. doi: 10.1080/08880010500278749
52. Scott C., Slamang W. Biologics in childhood rheumatic disorders//Current Allergy & Clinical Immunology. - 2018. - Т. 31. - N. 4. - С. 206 - 211.
53. Schapkaitz E, Sherman GG, Jacobson BF, et al. Paediatric anticoagulation guidelines. S Afr Med J. 2012; 102: 171. doi: 10.7196/SAMJ.5471
54. Manco-Johnson MJ. How I treat venous thrombosis in children. Blood. 2006; 107: 21 - 9. doi: 10.1182/blood-2004-11-4211
55. Tolbert J, Carpenter SL. Common Acquired Causes of Thrombosis in Children. Curr Probl Pediatr Adolesc Health Care. 2013; 43: 169 - 77. doi: 10.1016/j.cppeds.2013.05.005
56.  M P, Salgado U A, Barriga G J, et al. Usefulness of the thromboelastogram in children: correlation with habitual coagulation tests. Rev Chil Pediatr. 2019; 90: 617 - 23. doi: 10.32641/rchped.v90i6.930
M P, Salgado U A, Barriga G J, et al. Usefulness of the thromboelastogram in children: correlation with habitual coagulation tests. Rev Chil Pediatr. 2019; 90: 617 - 23. doi: 10.32641/rchped.v90i6.930
57. Геморрагические и тромботические заболевания и синдромы у детей и подростков: патогенез, клиника, диагностика, терапия и профилактика: монография/Б.И. Кузник, В.Г. Стуров, Н.Ю. Левшин [и др.]. - 2-е изд., перераб. и доп. - Новосибирск: Наука, 2018. - 524 с.
58. Verma A, Hemlata. Thromboelastography as a novel viscoelastic method for hemostasis monitoring: Its methodology, applications, and constraints. Glob J Transfus Med. 2017; 2: 8. doi: 10.4103/GJTM.GJTM_4_17
59. Yuan W-H, Liu H-C, Zeng L-K, et al. [Change of Thrombelastography in Children's DIC and Analysis of Its Sensitivity and Specificity for Diagnosis of DIC]. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2017; 25: 847 - 52. doi: 10.7534/j.issn.1009-2137.2017.03.039.
60. Михельсон, В.А., В.А. Сидоров, and С.М. Степаненко. "Анестезия и интенсивная терапия в педиатрии." М.: "Дель рус (2007).
61. Голуб И.Е., Сорокина Л.В. Избранные вопросы по общей анестезиологии (методические рекомендации для клинических ординаторов, с правом переиздания). - 2005.
62. Nik A, Mirfeizi Z, Rezaieyazdi Z, et al. ABO and Rh blood groups in patients with Lupus and Rheumatoid Arthritis. Casp J Intern Med. 2021; 12. doi: 10.22088/cjim.12.4.568
63. Salem GI, Gamal NM, Talaat EA, et al. Clinical Impact of the ABO Blood Type in Patients with Rheumatic Diseases: Is there a Link to the ABO and Rhesus? Mediterr J Rheumatol. 2021; 32: 237. doi: 10.31138/mjr.32.3.237
64. Sarkar S, Alam MM, Das G, et al. Inflammatory Markers and Disease Activity in Juvenile Idiopathic Arthritis. Indian J Pediatr. 2017; 84: 349 - 56. doi: 10.1007/s12098-017-2292-6
65. Horneff G, Klein A, Ganser G, et al. Protocols on classification, monitoring and therapy in children's rheumatology (PRO-KIND): results of the working group Polyarticular juvenile idiopathic arthritis. Pediatr Rheumatol Online J. 2017; 15: 78. doi: 10.1186/s12969-017-0206-9
66. John RM, Kenney-Riley K. Care of the Child with a Possible Rheumatological Disorder. In: John RM, ed. Pediatric Diagnostic Labs for Primary Care: An Evidence-based Approach. Cham: Springer International Publishing 2022: 461 - 86.
67. Cortis E, Insalaco A. Macrophage activation syndrome in juvenile idiopathic arthritis. Acta Paediatr. 2006; 95: 38 - 41. doi: 10.1111/j.1651-2227.2006.tb02414.x
68. Gilliam BE, Chauhan AK, Low JM, et al. Measurement of biomarkers in juvenile idiopathic arthritis patients and their significant association with disease severity: a comparative study. Clin Exp Rheumatol. 2008; 26: 492 - 7.
69. Marzan KAB, Shaham B. Early Juvenile Idiopathic Arthritis. Rheum Dis Clin N Am. 2012; 38: 355 - 72. doi: 10.1016/j.rdc.2012.04.006
70. Mahmud SA, Binstadt BA. Autoantibodies in the Pathogenesis, Diagnosis, and Prognosis of Juvenile Idiopathic Arthritis. Front Immunol. 2018; 9: 3168. doi: 10.3389/fimmu.2018.03168
71. Syed RH, Gilliam BE, Moore TL. Rheumatoid factors and anticyclic citrullinated peptide antibodies in pediatric rheumatology. Curr Rheumatol Rep. 2008; 10: 156 - 63. doi: 10.1007/s11926-008-0027-4
72. Barash J, Goldzweig O. Possible role of streptococcal infection in flares of juvenile idiopathic arthritis. Arthritis Rheum. 2007; 57: 877 - 80. doi: 10.1002/art.22787
73. Nishibukuro M, Tsutsumi N, Chiyotanda M, et al. Poststreptococcal reactive arthritis in Japan. J Infect Chemother Off J Jpn Soc Chemother. 2018; 24: 531 - 7. doi: 10.1016/j.jiac.2018.02.012
74. Srivastava R, Phatak S, Yadav A, et al. HLA B27 typing in 511 children with juvenile idiopathic arthritis from India. Rheumatol Int. 2016; 36: 1407 - 11. doi: 10.1007/s00296-016-3529-9
75.  Z, Turowska-Heydel D, Sobczyk M, et al. Prevalence of HLA-B27 antigen in patients with juvenile idiopathic arthritis. Reumatologia. 2015; 53: 125 - 30. doi: 10.5114/reum.2015.53133
Z, Turowska-Heydel D, Sobczyk M, et al. Prevalence of HLA-B27 antigen in patients with juvenile idiopathic arthritis. Reumatologia. 2015; 53: 125 - 30. doi: 10.5114/reum.2015.53133
76. Ahn JG. Role of Biomarkers in Juvenile Idiopathic Arthritis. J Rheum Dis. 2020; 27: 233 - 40. doi: 10.4078/jrd.2020.27.4.233
77. Ben-Chetrit E, Gattorno M, Gul A, et al. Consensus proposal for taxonomy and definition of the autoinflammatory diseases (AIDs): a Delphi study. Ann Rheum Dis. 2018; 77: 1558 - 65. doi: 10.1136/annrheumdis-2017-212515
78. Adrovic A, Sahin S, Barut K, et al. Familial Mediterranean fever and periodic fever, aphthous stomatitis, pharyngitis, and adenitis (PFAPA) syndrome: shared features and main differences. Rheumatol Int. 2019; 39: 29 - 36. doi: 10.1007/s00296-018-4105-2
79. Bourguiba R, Savey L, Aouba A, et al. Le syndrome de 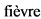
 aux mutations du
aux mutations du  du
du 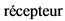 au TNF de type 1: un diagnostic
au TNF de type 1: un diagnostic  de la
de la 
 familiale
familiale 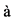 ne pas
ne pas  chez les patients d'origine
chez les patients d'origine  . Rev
. Rev  Interne. 2021; 42: 459 - 64. doi: 10.1016/j.revmed.2020.08.007
Interne. 2021; 42: 459 - 64. doi: 10.1016/j.revmed.2020.08.007
80. Sag E, Bilginer Y, Ozen S. Autoinflammatory Diseases with Periodic Fevers. Curr Rheumatol Rep. 2017; 19: 41. doi: 10.1007/s11926-017-0670-8
81. Soon GS, Laxer RM. Approach to recurrent fever in childhood. Can Fam Physician Med Fam Can. 2017; 63: 756 - 62.
82. Hashkes PJ, Laxer RM, Simon A, editors. Textbook of Autoinflammation. Cham: Springer International Publishing 2019.
83. Щербина АЮ. Первичные иммунодефициты - реалии XXI века. Вопросы Гематологиионкологии И Иммунопатологии В Педиатрии. 2016; 15: 8-9-9. https://www.hemoncim.com/jour/article/view/142 (accessed 14 April 2020)
84. Zahran AM, Abdallah AM, Saad K, et al. Peripheral Blood B and T Cell Profiles in Children with Active Juvenile Idiopathic Arthritis. Arch Immunol Ther Exp (Warsz). 2019; 67: 427 - 32. doi: 10.1007/s00005-019-00560-7
85. Quesada-Masachs E,  De La Sierra D, Garcia Prat M, et al. AB0165 In Depth Immunophenotypic Analysis In Juvenile Idiopathic Arthritis (JIA): A Crossectional Study. Ann Rheum Dis. 2016; 75: 952.3 - 953. doi: 10.1136/annrheumdis-2016-eular.4823
De La Sierra D, Garcia Prat M, et al. AB0165 In Depth Immunophenotypic Analysis In Juvenile Idiopathic Arthritis (JIA): A Crossectional Study. Ann Rheum Dis. 2016; 75: 952.3 - 953. doi: 10.1136/annrheumdis-2016-eular.4823
86. Ringold S, Weiss PF, Beukelman T, et al. 2013 update of the 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: recommendations for the medical therapy of children with systemic juvenile idiopathic arthritis and tuberculosis screening among children receiving biologic medications. Arthritis Care Res. 2013; 65: 1551 - 63. doi: 10.1002/acr.22087
87. Barut K,  S, Adrovic A, et al. Tuberculin skin test response in patients with juvenile idiopathic arthritis on anti-TNF therapy. Turk J Med Sci. 2018; 48: 1109 - 14. doi: 10.3906/sag-1710-190
S, Adrovic A, et al. Tuberculin skin test response in patients with juvenile idiopathic arthritis on anti-TNF therapy. Turk J Med Sci. 2018; 48: 1109 - 14. doi: 10.3906/sag-1710-190
88.  AL, DiNardo A, Saavedra B, et al. Point of care diagnostics for tuberculosis. Pulmonology. 2018; 24: 73 - 85. doi: 10.1016/j.rppnen.2017.12.002
AL, DiNardo A, Saavedra B, et al. Point of care diagnostics for tuberculosis. Pulmonology. 2018; 24: 73 - 85. doi: 10.1016/j.rppnen.2017.12.002
89. Brunelli JB, Bonfiglioli KR, Silva CA, et al. Latent tuberculosis infection screening in juvenile idiopathic arthritis patients preceding anti-TNF therapy in a tuberculosis high-risk country. Rev Bras Reumatol. 2017; 57: 392 - 6. doi: 10.1016/j.rbre.2016.11.004
90. Cantini F, Nannini C, Niccoli L, et al. Guidance for the management of patients with latent tuberculosis infection requiring biologic therapy in rheumatology and dermatology clinical practice. Autoimmun Rev. 2015; 14: 503 - 9. doi: 10.1016/j.autrev.2015.01.011
91. Аксенова ВА, Барышников ЛА, Клевно НИ, et al. Новые возможности скрининга и диагностики различных проявлений туберкулезной инфекции у детей и подростков в России. Вопросы Современной Педиатрии. 2011; 10: 16 - 22.
92. Aksenova VA, Klevno NI, Kazakov AV, et al. Preventive Tuberculosis Services Reduces the Risk of Local Forms of Tuberculosis Development in Children on Immunosuppressive Therapy: Retrospective Cohort Study. Curr Pediatr. 2020; 19: 346 - 51. doi: 10.15690/vsp.v19i5.2210
93.  J, Anton J,
J, Anton J,  De Carpi J, et al. Dual latent tuberculosis screening with tuberculin skin tests and QuantiFERON-TB assays before
De Carpi J, et al. Dual latent tuberculosis screening with tuberculin skin tests and QuantiFERON-TB assays before  inhibitor initiation in children in Spain. Eur J Pediatr. 2022; 182: 307 - 17. doi: 10.1007/s00431-022-04640-3
inhibitor initiation in children in Spain. Eur J Pediatr. 2022; 182: 307 - 17. doi: 10.1007/s00431-022-04640-3
94. Бармина НА, Барышникова ЛА, Шурыгин АА, et al. Скрининговое обследование детей и подростков III, IV и V групп здоровья с применением нового диагностического теста. Туберкулез И Болезни Легких. 2015; 0: 40 - 1.
95. Selmi C, Gershwin ME. Diagnosis and classification of reactive arthritis. Autoimmun Rev. 2014; 13: 546 - 9. doi: 10.1016/j.autrev.2014.01.005
96. Bentaleb I, Abdelghani KB, Rostom S, et al. Reactive Arthritis: Update. Curr Clin Microbiol Rep. 2020; 1 - 9. doi: 10.1007/s40588-020-00152-6
97. Zeidler H, Hudson AP. Reactive Arthritis Update: Spotlight on New and Rare Infectious Agents Implicated as Pathogens. Curr Rheumatol Rep. 2021; 23: 53. doi: 10.1007/s11926-021-01018-6
98. Dembek ZF, Mothershead JL, Owens AN, et al. Psittacosis: An Underappreciated and Often Undiagnosed Disease. Pathogens. 2023; 12: 1165. doi: 10.3390/pathogens12091165
99. Singh A, Karrar S. The Role of Intracellular Organisms in the Pathogenesis of Inflammatory Arthritis. Int J Inflamm. 2014; 2014: 1 - 8. doi: 10.1155/2014/158793
100. Taccetti G, Trapani S, Ermini M, et al. Reactive arthritis triggered by Yersinia enterocolitica: a review of 18 pediatric cases. Clin Exp Rheumatol. 1994; 12: 681 - 4.
101. Williams G. F. et al. Post-Yersinia Arthritis//Western Journal of Medicine. - 1980. - Т. 132. - N. 6. - С. 535.
102. Yang W-C, Huang Y-C, Tsai M-H, et al. Salmonella Septic Arthritis Involving Multiple Joints in a Girl with Acute Lymphoblastic Leukemia at Diagnosis. Pediatr Neonatol. 2009; 50: 33 - 5. doi: 10.1016/S1875-9572(09)60027-9
103. Kanakoudi-Tsakalidou, G Pardalos, P F. Persistent or Severe Course of Reactive Arthritis Following Salmonella enteritidis Infection: A prospective study of 9 cases. Scand J Rheumatol. 1998; 27: 431 - 4. doi: 10.1080/030097498442253
104. Kurniawan A, Sitorus IP, Loho T, et al. A rare case of septic arthritis of the knee caused by Salmonella typhi with preexisting typhoid fever in a healthy, immunocompetent child - A case report. Int J Surg Case Rep. 2021; 78: 76 - 80. doi: 10.1016/j.ijscr.2020.12.003
105. Leino R,  A-L, Tiilikainen A, et al. Yersinia Arthritis in Children. Scand J Rheumatol. 1980; 9: 245 - 9. doi: 10.3109/03009748009112357
A-L, Tiilikainen A, et al. Yersinia Arthritis in Children. Scand J Rheumatol. 1980; 9: 245 - 9. doi: 10.3109/03009748009112357
106. Hannu T. Reactive arthritis after an outbreak of Yersinia pseudotuberculosis serotype O: 3 infection. Ann Rheum Dis. 2003; 62: 866 - 9. doi: 10.1136/ard.62.9.866
107. Jezequel C, Prigent JY, Loiseau-Corvez MN, et al. [Reactive arthritis caused by Yersinia in children. Report of 4 cases]. Ann Pediatr (Paris). 1991; 38: 318 - 22.
108. Naija O. et al. A new case of reactive arthritis following Yersinia pseudotuberculosis serotype IV//Journal of Pediatric Infectious Diseases. - 2010. - Т. 5. - N. 02. - С. 193 - 194.
109. Orczyk K,  J, Smolewska E. When a patient suspected with juvenile idiopathic arthritis turns out to be diagnosed with an infectious disease - a review of Lyme arthritis in children. Pediatr Rheumatol Online J. 2017; 15: 35. doi: 10.1186/s12969-017-0166-0
J, Smolewska E. When a patient suspected with juvenile idiopathic arthritis turns out to be diagnosed with an infectious disease - a review of Lyme arthritis in children. Pediatr Rheumatol Online J. 2017; 15: 35. doi: 10.1186/s12969-017-0166-0
110. Sood SK. Lyme Disease in Children. Infect Dis Clin North Am. 2015; 29: 281 - 94. doi: 10.1016/j.idc.2015.02.011
111. Steffen, Hirsch. Diagnostik der Lyme-Borreliose. Ther Umsch. 2005; 62: 737 - 44. doi: 10.1024/0040-5930.62.11.737
112. Giancane G, Swart JF, Castagnola E, et al. Opportunistic infections in immunosuppressed patients with juvenile idiopathic arthritis: analysis by the Pharmachild Safety Adjudication Committee. Arthritis Res Ther. 2020; 22: 71. doi: 10.1186/s13075-020-02167-2
113. Houen G, Trier NH. Epstein-Barr Virus and Systemic Autoimmune Diseases. Front Immunol. 2020; 11: 587380. doi: 10.3389/fimmu.2020.587380
114. Shi T, Huang L, Tian J. Prevalence of Epstein-Barr Viral DNA among children at a single hospital in Suzhou, China. J Pediatr (Rio J). 2022; 98: 142 - 6. doi: 10.1016/j.jped.2021.05.006
115. Kharitonova LA, Soboleva NG. The role of the infectious factor in juvenile rheumatoid arthritis in children. Ross Vestn Perinatol Pediatr Russ Bull Perinatol Pediatr. 2018; 63: 59 - 63. doi: 10.21508/1027-4065-2018-63-3-59-63
116. Engelmann I, Petzold DR, Kosinska A, et al. Rapid quantitative PCR assays for the simultaneous detection of herpes simplex virus, varicella zoster virus, cytomegalovirus, Epstein-Barr virus, and human herpesvirus 6 DNA in blood and other clinical specimens. J Med Virol. 2008; 80: 467 - 77. doi: 10.1002/jmv.21095
117. Солдатова Е.Ю. и др. Распространенность герпесвирусной инфекции у больных с различными формами и вариантами ювенильного артрита//Лечащий врач. - 2017. - N. 6. - С. 31 - 31.
118. Banko A, Cirkovic A, Jeremic I, et al. Uncovering the Role of Epstein-Barr Virus Infection Markers for Remission in Rheumatoid Arthritis. Biomedicines. 2023; 11: 2375. doi: 10.3390/biomedicines11092375
119. for the Paediatric Rheumatology International Trials Organisation (PRINTO), Giancane G, Swart JF, et al. Opportunistic infections in immunosuppressed patients with juvenile idiopathic arthritis: analysis by the Pharmachild Safety Adjudication Committee. Arthritis Res Ther. 2020; 22: 71. doi: 10.1186/s13075-020-02167-2
120. Liu Z, Zhang P, Tang S, et al. Urine real-time polymerase chain reaction detection for children virus pneumonia with acute human cytomegalovirus infection. BMC Infect Dis. 2014; 14: 245. doi: 10.1186/1471-2334-14-245
121. A. Ross S, Novak Z, Pati S, et al. Overview of the Diagnosis of Cytomegalovirus Infection. Infect Disord - Drug Targets. 2011; 11: 466 - 74. doi: 10.2174/187152611797636703
122. Slots J, Slots H. Bacterial and viral pathogens in saliva: disease relationship and infectious risk. Periodontol 2000. 2011; 55: 48 - 69. doi: 10.1111/j.1600-0757.2010.00361.x
123. Strick LB, Wald A. Diagnostics for Herpes Simplex Virus: Is PCR the New Gold Standard? Mol Diagn Ther. 2006; 10: 17 - 28. doi: 10.1007/BF03256439
124. Vince A, Dusek D. Imunosupresija i virusne infekcije u reumatskim bolestima [Immunosupression and viral infections in rheumatic diseases]. Reumatizam. 2007; 54(2): 58 - 62. Croatian. PMID: 18351141.
125. Eisenstein EM, Wolf DG. Cytomegalovirus infection in pediatric rheumatic diseases: a review. Pediatr Rheumatol. 2010; 8: 17. doi: 10.1186/1546-0096-8-17
126. Hanson V, Kornreich HK, Drexler E, et al. Some Immunologic Considerations in Focal Scleroderma and Progressive Systemic Sclerosis in Children. Pediatr Res. 1974; 8: 806 - 9. doi: 10.1203/00006450-197409000-00006
127. Looker KJ, Magaret AS, May MT, et al. Global and Regional Estimates of Prevalent and Incident Herpes Simplex Virus Type 1 Infections in 2012. PloS One. 2015; 10: e0140765. doi: 10.1371/journal.pone.0140765
128. McQuillan G, Kruszon-Moran D, Flagg EW, et al. Prevalence of Herpes Simplex Virus Type 1 and Type 2 in Persons Aged 14 - 49: United States, 2015 - 2016. NCHS Data Brief. 2018; 1 - 8.
129. Xu F, Lee FK, Morrow RA, et al. Seroprevalence of herpes simplex virus type 1 in children in the United States. J Pediatr. 2007; 151: 374 - 7. doi: 10.1016/j.jpeds.2007.04.065
130. Levin MJ, Weinberg A, Schmid DS. Herpes Simplex Virus and Varicella-Zoster Virus. Microbiol Spectr. 2016; 4. doi: 10.1128/microbiolspec.DMIH2-0017-2015
131. McAuley JB. Congenital Toxoplasmosis. J Pediatr Infect Dis Soc. 2014; 3 Suppl 1: S30 - 35. doi: 10.1093/jpids/piu077
132. McAuley JB. Toxoplasmosis in Children. Pediatr Infect Dis J. 2008; 27: 161 - 2. doi: 10.1097/INF.0b013e3181658abb
133. Villard O, Cimon B, L'Ollivier C, et al. Serological diagnosis of Toxoplasma gondii infection. Diagn Microbiol Infect Dis. 2016; 84: 22 - 33. doi: 10.1016/j.diagmicrobio.2015.09.009
134. Dong W, Zhong Q, Gu Y-L, et al. Is Toxoplasma gondii infection a concern in individuals with rheumatic diseases? Evidence from a case-control study based on serological diagnosis. Microb Pathog. 2023; 182: 106257. doi: 10.1016/j.micpath.2023.106257
135. Salem DA, Al-Ghamdi AH, Alghamdi JM, et al. Toxoplasma and Toxocara seropositivity in juvenile idiopathic arthritis and its relation to disease activity and type of therapies. Food Waterborne Parasitol. 2023; 31: e00195. doi: 10.1016/j.fawpar.2023.e00195
136. Abdolsalehi M, Pourakbari B, Mahmoudi S, et al. Clinical and Epidemiologic Features of Visceral Leishmaniasis in Children: A 6-year Study from an Iranian Referral Hospital. Infect Disord Drug Targets. 2020; 20: 461 - 6. doi: 10.2174/1871526519666190613123217
137. Aronson NE, Joya CA. Cutaneous Leishmaniasis: Updates in Diagnosis and Management. Infect Dis Clin North Am. 2019; 33: 101 - 17. doi: 10.1016/j.idc.2018.10.004
138. Cascio A., Colomba C. Childhood Mediterranean visceral leishmaniasis//Le Infezioni in Medicina. - 2003. - Т. 11. - N. 1. - С. 5 - 10.
139.  A, Mateo L, Lloveras N, et al. Visceral leishmaniasis and macrophagic activation syndrome in a patient with rheumatoid arthritis under treatment with adalimumab. Joint Bone Spine. 2010; 77: 271 - 3. doi: 10.1016/j.jbspin.2010.01.011
A, Mateo L, Lloveras N, et al. Visceral leishmaniasis and macrophagic activation syndrome in a patient with rheumatoid arthritis under treatment with adalimumab. Joint Bone Spine. 2010; 77: 271 - 3. doi: 10.1016/j.jbspin.2010.01.011
140. Kurizky PS, Marianelli FF, Cesetti MV, et al. A comprehensive systematic review of leishmaniasis in patients undergoing drug-induced immunosuppression for the treatment of dermatological, rheumatological and gastroenterological diseases. Rev Inst Med Trop  Paulo. 2020; 62: e28. doi: 10.1590/s1678-9946202062028
Paulo. 2020; 62: e28. doi: 10.1590/s1678-9946202062028
141. Indolfi G, Easterbrook P, Dusheiko G, et al. Hepatitis B virus infection in children and adolescents. Lancet Gastroenterol Hepatol. 2019; 4: 466 - 76. doi: 10.1016/S2468-1253(19)30042-1
142. European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu, European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017; 67: 370 - 98. doi: 10.1016/j.jhep.2017.03.021
143. Indolfi G, Easterbrook P, Dusheiko G, et al. Hepatitis C virus infection in children and adolescents. Lancet Gastroenterol Hepatol. 2019; 4: 477 - 87. doi: 10.1016/S2468-1253(19)30046-9
144. Mack CL, Adams D, Assis DN, et al. Diagnosis and Management of Autoimmune Hepatitis in Adults and Children: 2019 Practice Guidance and Guidelines From the American Association for the Study of Liver Diseases. Hepatol Baltim Md. 2020; 72: 671 - 722. doi: 10.1002/hep.31065
145. Lampertico P, Agarwal K, Berg T, et al. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017; 67: 370 - 98. doi: 10.1016/j.jhep.2017.03.021
146. Harrison MJ, Brice N, Scott C. Clinical Features of HIV Arthropathy in Children: A Case Series and Literature Review. Front Immunol. 2021; 12: 677984. doi: 10.3389/fimmu.2021.677984
147. World Health Organization. WHO recommendations on the diagnosis of HIV infection in infants and children. World Health Organization, 2010.
148. Reust CE. Evaluation of primary immunodeficiency disease in children. Am Fam Physician. 2013; 87: 773 - 8.
149. Key recommendations. WHO Recommendations on the Diagnosis of HIV Infection in Infants and Children. World Health Organization 2010.
150. Weiss SL, Peters MJ, Alhazzani W, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Intensive Care Med. 2020; 46: 10 - 67. doi: 10.1007/s00134-019-05878-6
151. Howell MD, Davis AM. Management of Sepsis and Septic Shock. JAMA. 2017; 317: 847. doi: 10.1001/jama.2017.0131
152. Trachtman R, Murray E, Wang CM, et al. Procalcitonin Differs in Children With Infection and Children With Disease Flares in Juvenile Idiopathic Arthritis. J Clin Rheumatol Pract Rep Rheum Musculoskelet Dis. 2021; 27: 87 - 91. doi: 10.1097/RHU.0000000000001170
153. Limper M, de Kruif MD, Duits AJ, et al. The diagnostic role of Procalcitonin and other biomarkers in discriminating infectious from non-infectious fever. J Infect. 2010; 60: 409 - 16. doi: 10.1016/j.jinf.2010.03.016
154. Chien Y-L, Huang F-L, Huang C-M, et al. Clinical approach to fever of unknown origin in children. J Microbiol Immunol Infect. 2017; 50: 893 - 8. doi: 10.1016/j.jmii.2015.08.007
155. Ahmadinejad Z, Mansori S, Ziaee V, et al. Periodic Fever: a review on clinical, management and guideline for Iranian patients - part I. Iran J Pediatr 2014; 24: 1 - 13.
156.  H,
H,  I, Duman M, et al. Disseminated intravascular coagulation in pediatric patients: Clinical and Laboratory Features and Prognostic Factors Influencing the Survival. Pediatr Hematol Oncol. 2005; 22: 679 - 88. doi: 10.1080/08880010500278749
I, Duman M, et al. Disseminated intravascular coagulation in pediatric patients: Clinical and Laboratory Features and Prognostic Factors Influencing the Survival. Pediatr Hematol Oncol. 2005; 22: 679 - 88. doi: 10.1080/08880010500278749
157. Robinson JL, Lee BE, Kothapalli S, et al. Use of Throat Swab or Saliva Specimens for Detection of Respiratory Viruses in Children. Clin Infect Dis. 2008; 46: e61 - 4. doi: 10.1086/529386
158. Hurd A, Beukelman T. Infectious Complications in Juvenile Idiopathic Arthritis. Curr Rheumatol Rep. 2013; 15: 327. doi: 10.1007/s11926-013-0327-1
159. Del Giudice E, Marcellino A, Hoxha S, et al. Proteinuria and hematuria as early signs of renal involvement in juvenile idiopathic arthritis. Front Pediatr. 2024; 12: 1395961. doi: 10.3389/fped.2024.1395961
160. Ruemmele FM, Veres G, Kolho KL, et al. Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn's disease. J Crohns Colitis. Published Online First: 5 June 2014. doi: 10.1016/j.crohns.2014.04.005
161. Turner D, Ruemmele FM, Orlanski-Meyer E, et al. Management of Paediatric Ulcerative Colitis, Part 1: Ambulatory Care - An Evidence-based Guideline From European Crohn's and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018; 67: 257 - 91. doi: 10.1097/MPG.0000000000002035
162. Ferrara G, Pastore S, Sancin L, et al. Fecal Calprotectin to Detect Inflammatory Bowel Disease in Juvenile Idiopathic Arthritis. J Rheumatol. 2018; 45: 1418 - 21. doi: 10.3899/jrheum.171200
163. Boylan M. Should ultrasound be used routinely in the diagnosis of rheumatoid arthritis? Ir J Med Sci. 2020; 189: 735 - 48. doi: 10.1007/s11845-019-02096-3
164. Basra HAS, Humphries PD. Juvenile idiopathic arthritis: what is the utility of ultrasound? Br J Radiol. 2017; 90: 20160920. doi: 10.1259/bjr.20160920
165. Chauvin NA, Doria AS. Ultrasound imaging of synovial inflammation in juvenile idiopathic arthritis. Pediatr Radiol. 2017; 47: 1160 - 70. doi: 10.1007/s00247-017-3934-6
166. Malattia C, Rinaldi M, Martini A. The role of imaging in juvenile idiopathic arthritis. Expert Rev Clin Immunol. 2018; 14: 681 - 94. doi: 10.1080/1744666X.2018.1496019
167. Balassy C, Miller SF. CT in children's bones and joints: When, how and common findings. Eur J Radiol. 2013; 82: 1126 - 34. doi: 10.1016/j.ejrad.2011.12.007
168. Allen-Rhoades W, Whittle SB, Rainusso N. Pediatric Solid Tumors in Children and Adolescents: An Overview. Pediatr Rev. 2018; 39: 444 - 53. doi: 10.1542/pir.2017-0268
169. Zucker EJ, Lee EY, Restrepo R, et al. Hip disorders in children. AJR Am J Roentgenol. 2013; 201: W776 - 796. doi: 10.2214/AJR.13.10623
170. Munir S, Patil K, Miller E, et al. Juvenile idiopathic arthritis of the axial joints: a systematic review of the diagnostic accuracy and predictive value of conventional MRI. AJR Am J Roentgenol. 2014; 202: 199 - 210. doi: 10.2214/AJR.12.10475
171. Yilmaz MH, Ozbayrak M, Kasapcopur O, et al. Pelvic MRI findings of juvenile-onset ankylosing spondylitis. Clin Rheumatol. 2010; 29: 1007 - 13. doi: 10.1007/s10067-010-1514-3
172. Vendhan K, Sen D, Fisher C, et al. Inflammatory Changes of the Lumbar Spine in Children and Adolescents With Enthesitis-Related Arthritis: Magnetic Resonance Imaging Findings. Arthritis Care Res. 2014; 66: 40 - 6. doi: 10.1002/acr.22201
173. Schiettecatte E, Jans L, Jaremko JL, et al. MR Imaging of Rheumatic Diseases Affecting the Pediatric Population. Semin Musculoskelet Radiol. 2021; 25: 082 - 93. doi: 10.1055/s-0041-1726435
174. Sheybani EF, Khanna G, White AJ, et al. Imaging of Juvenile Idiopathic Arthritis: A Multimodality Approach. RadioGraphics. 2013; 33: 1253 - 73. doi: 10.1148/rg.335125178
175.  A,
A,  R,
R,  JM, et al. Clinical examination and imaging resources in children and adolescent back pain. J Child Orthop. 2023; 17: 512 - 26. doi: 10.1177/18632521231215860
JM, et al. Clinical examination and imaging resources in children and adolescent back pain. J Child Orthop. 2023; 17: 512 - 26. doi: 10.1177/18632521231215860
176. Goirand M, Breton S, Chevallier F, et al. Clinical features of children with enthesitis-related juvenile idiopathic arthritis/juvenile spondyloarthritis followed in a French tertiary care pediatric rheumatology centre. Pediatr Rheumatol. 2018; 16: 21. doi: 10.1186/s12969-018-0238-9
177. Azouz EM, Duffy CM. Juvenile spondyloarthropathies: clinical manifestations and medical imaging. Skeletal Radiol. 1995; 24: 399 - 408. doi: 10.1007/BF00941234
178. Weiss PF, Colbert RA. Radiography Versus Magnetic Resonance Imaging (MRI) in Juvenile Spondyloarthritis: Is the MR Image Everything? J Rheumatol. 2014; 41: 832 - 3. doi: 10.3899/jrheum.140212
179. Stefanski A-L, Tomiak C, Pleyer U, et al. The Diagnosis and Treatment of  Syndrome. Dtsch Arzteblatt Int. 2017; 114: 354 - 61. doi: 10.3238/arztebl.2017.0354
Syndrome. Dtsch Arzteblatt Int. 2017; 114: 354 - 61. doi: 10.3238/arztebl.2017.0354
180. D'Arco F, Ugga L. Computed tomography and magnetic resonance imaging in pediatric salivary gland diseases: a guide to the differential diagnosis. Pediatr Radiol. 2020; 50: 1293 - 307. doi: 10.1007/s00247-020-04684-3
181. Takagi Y, Sasaki M, Eida S, et al. Comparison of salivary gland MRI and ultrasonography findings among patients with  syndrome over a wide age range. Rheumatology. 2022; 61: 1986 - 96. doi: 10.1093/rheumatology/keab560
syndrome over a wide age range. Rheumatology. 2022; 61: 1986 - 96. doi: 10.1093/rheumatology/keab560
182. Krumrey-Langkammerer M, Haas J-P. Salivary gland ultrasound in the diagnostic workup of juvenile  syndrome and mixed connective tissue disease. Pediatr Rheumatol. 2020; 18: 44. doi: 10.1186/s12969-020-00437-6
syndrome and mixed connective tissue disease. Pediatr Rheumatol. 2020; 18: 44. doi: 10.1186/s12969-020-00437-6
183. Dumaine C, Bekkar S, Belot A, et al. Infectious adverse events in children with Juvenile Idiopathic Arthritis treated with Biological Agents in a real-life setting: Data from the JIRcohorte. Joint Bone Spine. 2020; 87: 49 - 55. doi: 10.1016/j.jbspin.2019.07.011
184. Sierra D, Wood M, Kolli S, et al. Pediatric Gastritis, Gastropathy, and Peptic Ulcer Disease. Pediatr Rev. 2018; 39: 542 - 9. doi: 10.1542/pir.2017-0234
185. Jones NL, Koletzko S, Goodman K, et al. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017; 64: 991 - 1003. doi: 10.1097/MPG.0000000000001594
186. Бзарова Т.М., Щербаков П.Л., Алексеева Е.И., Чистякова Е.Г., and Валиева С.И. "Лечение гастроэзофагеальной рефлюксной болезни у детей с юношеским артритом" Вопросы современной педиатрии, vol. 6, no. 4, 2007, pp. 17 - 22.
187. Kotilea K, Cadranel S, Salame A, et al. Efficacy and safety of bismuth-based quadruple therapy for Helicobacter pylori eradication in children. Helicobacter. 2021; 26: e12825. doi: 10.1111/hel.12825
188. Бельмер С.В., Корниенко Е.А., Волынец Г.В., Гурова М.М., Звягин А.А., Камалова А.А., Луппова Н.Е., Нижевич А.А., Новикова В.П., Печкуров Д.В., Приворотский В.Ф., Сатаев В.У., Тяжева А.А., Файзуллина Р.А., Хавкин А.И. Диагностика и лечение хеликобактерной инфекции у детей. Экспериментальная и клиническая гастроэнтерология. 2021; (9): 119 - 127. https://doi.org/10.31146/1682-8658-ecg-193-9-119-127.
189. Pichler J, Ong C, Shah N, et al. Histopathological features of gastrointestinal mucosal biopsies in children with juvenile idiopathic arthritis. Pediatr Res. 2016; 79: 895 - 901. doi: 10.1038/pr.2016.27
190. Ashorn M, Verronen P, Ruuska T, et al. Upper endoscopic findings in children with active juvenile chronic arthritis. Acta Paediatr. 2003; 92: 558 - 61. doi: 10.1111/j.1651-2227.2003.tb02506.x
191. Len C, Hilario MO, Kawakami E, et al. Gastroduodenal lesions in children with juvenile rheumatoid arthritis. Hepatogastroenterology. 1999; 46: 991 - 6.
192. Weber P, Brune T, Ganser G, et al. Gastrointestinal symptoms and permeability in patients with juvenile idiopathic arthritis. Clin Exp Rheumatol. 2003; 21: 657 - 62.
193. Листопадова А.П. и др. Этиологическая структура хронического гастрита у детей, больных ювенильным хроническим артритом//Актуальные проблемы медицины. - 2014. - Т. 28. - N. 24 (195). - С. 33 - 36.
194. Maller J, Fox E, Park KT, et al. Inflammatory Bowel Disease in Children With Systemic Juvenile Idiopathic Arthritis. J Rheumatol. 2021; 48: 567 - 74. doi: 10.3899/jrheum.200230
195. Broekaert IJ, Klein A, Windschall D, et al. Development of Inflammatory Bowel Disease in Children With Juvenile Idiopathic Arthritis Treated With Biologics. J Pediatr Gastroenterol Nutr. 2023; 76: 174 - 82. doi: 10.1097/MPG.0000000000003656
196. Passo MH, Fitzgerald JF, Brandt KD. Arthritis associated with inflammatory bowel disease in children: Relationship of joint disease to activity and severity of bowel lesion. Dig Dis Sci. 1986; 31: 492 - 7. doi: 10.1007/BF01320313
197. Biswas S. et al. IBD-Associated Arthritis Misdiagnosed as Juvenile Idiopathic Arthritis: A Case Report and Literature Review: 2091//Official journal of the American College of Gastroenterology| ACG. - 2018. - Т. 113. - С. S1188 - S1189.
198.  Pedraz L, Galindo Zavala R, Blasco Alonso J, et al. Crohn's disease in a patient with systemic onset juvenile idiopathic arthritis. Association or associated side effect of treatment? Reumatol
Pedraz L, Galindo Zavala R, Blasco Alonso J, et al. Crohn's disease in a patient with systemic onset juvenile idiopathic arthritis. Association or associated side effect of treatment? Reumatol  Engl Ed. 2022; 18: 557 - 9. doi: 10.1016/j.reumae.2021.06.004
Engl Ed. 2022; 18: 557 - 9. doi: 10.1016/j.reumae.2021.06.004
199. De Cock D, Hyrich K. Malignancy and rheumatoid arthritis: Epidemiology, risk factors and management. Best Pract Res Clin Rheumatol. 2018; 32: 869 - 86. doi: 10.1016/j.berh.2019.03.011
200. Lobo L, Antunes D. Chest CT in infants and children. Eur J Radiol. 2013; 82: 1108 - 17. doi: 10.1016/j.ejrad.2011.12.006
201. Quezada A, Ramos S, Garcia M, et al. Lung involvement in rheumatologic diseases in children. Allergol Immunopathol (Madr). 2012; 40: 88 - 91. doi: 10.1016/j.aller.2011.02.009
202. Nikishina I, Kolkhidova Z, Blank L, et al. AB1260 Significance of whole-body mri in children with rheumatic diseases. Ann Rheum Dis. 2022; 81: 1739.3 - 1740. doi: 10.1136/annrheumdis-2022-eular.4671
203. Eutsler EP, Khanna G. Whole-body magnetic resonance imaging in children: technique and clinical applications. Pediatr Radiol. 2016; 46: 858 - 72. doi: 10.1007/s00247-016-3586-y
204. Fonseca MB, Gomes FHR, Valera ET, et al. Signs and symptoms of rheumatic diseases as first manifestation of pediatric cancer: diagnosis and prognosis implications. Rev Bras Reumatol Engl Ed. 2017; 57: 330 - 7. doi: 10.1016/j.rbre.2017.01.007
205. Alias A, Rodriguez EJ, Bateman HE, et al. Rheumatology and oncology: an updated review of rheumatic manifestations of malignancy and anti-neoplastictherapy. Bull NYU Hosp Jt Dis. 2012; 70: 109 - 14.
206. Grebenyuk V. et al. Fever of unknown origin: case reports from routine clinical practice and a review//Klinicka Mikrobiologie a Infekcni Lekarstvi. - 2021. - Т. 27. - N. 4. - С. 148 - 157.
207. Захарова И.Н., Османов И.М., Творогова Т.М., Горяйнова А.Н., Дмитриева Ю.А., Воробьева А.С., Короид Н.В. Длительная лихорадка у ребенка: в чем причина, как обследовать, лечить или не лечить? Медицинский совет. 2020; (10): 151 - 162. doi: 10.21518/2079-701X-2020-10-151-162.
208. Trapani S, Grisolia F, Simonini G, et al. Incidence of occult cancer in children presenting with musculoskeletal symptoms: a 10-year survey in a pediatric rheumatology unit. Semin Arthritis Rheum. 2000; 29: 348 - 59. doi: 10.1053/sarh.2000.5752
209. Li Q. et al. Quantifying the contribution of 18F-FDG PET to the diagnostic assessment of pediatric patients with fever of unknown origin: a systematic review and meta-analysis//Pediatric Radiology. - 2022. - С. 1 - 12.
210.  JB. New imaging techniques in reumathology: MRI, scintigraphy and PET. Pol J Radiol. 2013; 78: 48 - 56. doi: 10.12659/PJR.889138
JB. New imaging techniques in reumathology: MRI, scintigraphy and PET. Pol J Radiol. 2013; 78: 48 - 56. doi: 10.12659/PJR.889138
211. Colamussi P, Prandini N, Cittanti C, et al. Scintigraphy in rheumatic diseases. Best Pract Res Clin Rheumatol. 2004; 18: 909 - 26. doi: 10.1016/j.berh.2004.07.003
212. Handa R, Upadhyaya S, Kapoor S, et al. Tuberculosis and biologics in rheumatology: A special situation. Int J Rheum Dis. 2017; 20: 1313 - 25. doi: 10.1111/1756-185X.13129
213. Clemente D, Cuadros EN, Lovillo MC, et al. Position statement on infection screening, prophylaxis, and vaccination of pediatric patients with rheumatic diseases and immunosuppressive therapies, part 3: precautions in situations of surgery, fever, and opportunistic infections. Eur J Pediatr. 2023; 183: 915 - 27. doi: 10.1007/s00431-023-05295-4
214. Bovid KM, Moore MD. Juvenile Idiopathic Arthritis for the Pediatric Orthopedic Surgeon. Orthop Clin North Am. 2019; 50: 471 - 88. doi: 10.1016/j.ocl.2019.06.003
215. Radwan-Oczko M,  I, Richards P, et al. Rheumatoid arthritis patients' oral health and disease activity. Int J Rheum Dis. 2019; 22: 1538 - 43. doi: 10.1111/1756-185X.13590
I, Richards P, et al. Rheumatoid arthritis patients' oral health and disease activity. Int J Rheum Dis. 2019; 22: 1538 - 43. doi: 10.1111/1756-185X.13590
216. Lvovich S, Goldsmith DP. Neurological Complications of Rheumatic Disease. Semin Pediatr Neurol. 2017; 24: 54 - 9. doi: 10.1016/j.spen.2016.12.007
217. Shiari R. Neurologic manifestations of childhood rheumatic diseases. Iran J Child Neurol. 2012; 6: 1 - 7.
218.  K, Trieschmann U, Leister N.
K, Trieschmann U, Leister N.  und Analgosedierung
und Analgosedierung  diagnostische Eingriffe bei Kindern. AINS -
diagnostische Eingriffe bei Kindern. AINS -  · Intensivmed · Notfallmedizin · Schmerzther. 2023; 58: 409 - 20. doi: 10.1055/a-1925-7009
· Intensivmed · Notfallmedizin · Schmerzther. 2023; 58: 409 - 20. doi: 10.1055/a-1925-7009
219. Dumas G, Arabi YM, Bartz R, et al. Diagnosis and management of autoimmune diseases in the ICU. Intensive Care Med. 2024; 50: 17 - 35. doi: 10.1007/s00134-023-07266-7
220. Janssen NM, Karnad DR, Guntupalli KK. Rheumatologic diseases in the intensive care unit: epidemiology, clinical approach, management, and outcome. Crit Care Clin. 2002; 18: 729 - 48. doi: 10.1016/S0749-0704(02)00025-8
221. Hynes L, Saetes S, McGuire B, et al. Child and Family Adaptation to Juvenile Idiopathic Arthritis - A Systematic Review of the Role of Resilience Resources and Mechanisms. Front Psychol. 2019; 10: 2445. doi: 10.3389/fpsyg.2019.02445
222. Frye WS, Milojevic D. The Role of Psychology in Pediatric Rheumatic Diseases. Pediatr Clin North Am. 2022; 69: 965 - 74. doi: 10.1016/j.pcl.2022.05.009
223. Chyzheuskaya I. et al. THU0508 Psychological features of children with rheumatic diseases. - 2017.
224. LeBovidge JS. Psychological Adjustment of Children and Adolescents WithChronic Arthritis: A Meta-analytic Review. J Pediatr Psychol. 2003; 28: 29 - 39. doi: 10.1093/jpepsy/28.1.29
225. Ferro MA, Boyle MH. Self-concept among youth with a chronic illness: A meta-analytic review. Health Psychol. 2013; 32: 839 - 48. doi: 10.1037/a0031861
226. Cousino MK, Hazen RA. Parenting Stress Among Caregivers of Children With Chronic Illness: A Systematic Review. J Pediatr Psychol. 2013; 38: 809 - 28. doi: 10.1093/jpepsy/jst049
227. Knafl K, Leeman J, Havill NL, et al. The Contribution of Parent and Family Variables to the Well-Being of Youth With Arthritis. J Fam Nurs. 2015; 21: 579 - 616. doi: 10.1177/1074840715601475
228. Kellgren, Jonas H. "The epidemiology of chronic rheumatism." Atlas of standard radiographs of arthritis 2 (1963): 22 - 23.
229. Bennett, Peter H. "Population studies of the rheumatic disease." Proceedings of the Third International Symposium. Excerpta Medica, 1968.
230. Dougados M, Linden SVD, Juhlin R, et al. The European Spondylarthropathy Study Group Preliminary Criteria for the Classification of Spondylarthropathy. Arthritis Rheum. 1991; 34: 1218 - 27. doi: 10.1002/art.1780341003
231. Amor, B et al. " de classification des spondylarthropathies" [Criteria of the classification of spondylarthropathies]. Revue du rhumatisme et des maladies osteo-articulaires vol. 57,2 (1990): 85 - 9.
de classification des spondylarthropathies" [Criteria of the classification of spondylarthropathies]. Revue du rhumatisme et des maladies osteo-articulaires vol. 57,2 (1990): 85 - 9.
232.  , R. "Die juvenile Spondarthritis. Retrospektive Untersuchung an 71 Patienten" [Juvenile spondarthritis. Retrospective study of 71 patients]. Monatsschrift Kinderheilkunde: Organ der Deutschen Gesellschaft fur Kinderheilkunde vol. 135,1 (1987): 41 - 6.
, R. "Die juvenile Spondarthritis. Retrospektive Untersuchung an 71 Patienten" [Juvenile spondarthritis. Retrospective study of 71 patients]. Monatsschrift Kinderheilkunde: Organ der Deutschen Gesellschaft fur Kinderheilkunde vol. 135,1 (1987): 41 - 6.
233. Hussein A, Abdul-Khaliq H, Von Der Hardt H. Atypical spondyloarthritis in children: proposed diagnostic criteria. Eur J Pediatr. 1989; 148: 513 - 7. doi: 10.1007/BF00441545
234. Martini A, Ravelli A, Avcin T, et al. Toward New Classification Criteria for Juvenile Idiopathic Arthritis: First Steps, Pediatric Rheumatology International Trials Organization International Consensus. J Rheumatol. 2019; 46: 190 - 7. doi: 10.3899/jrheum.180168
235. Henderson LA, Cron RQ. Macrophage Activation Syndrome and Secondary Hemophagocytic Lymphohistiocytosis in Childhood Inflammatory Disorders: Diagnosis and Management. Paediatr Drugs. 2020; 22: 29 - 44. doi: 10.1007/s40272-019-00367-1
236. Ravelli A,  S, Minoia F, et al. Macrophage Activation Syndrome. Hematol Oncol Clin North Am. 2015; 29: 927 - 41. doi: 10.1016/j.hoc.2015.06.010
S, Minoia F, et al. Macrophage Activation Syndrome. Hematol Oncol Clin North Am. 2015; 29: 927 - 41. doi: 10.1016/j.hoc.2015.06.010
237. Shakoory B, Geerlinks A, Wilejto M, et al. The 2022 EULAR/ACR points to consider at the early stages of diagnosis and management of suspected haemophagocytic lymphohistiocytosis/macrophage activation syndrome (HLH/MAS). Ann Rheum Dis. 2023; 82: 1271 - 85. doi: 10.1136/ard-2023-224123
238. Hines MR, von Bahr Greenwood T, Beutel G, et al. Consensus-Based Guidelines for the Recognition, Diagnosis, and Management of Hemophagocytic Lymphohistiocytosis in Critically Ill Children and Adults. Crit Care Med. 2022; 50: 860 - 72. doi: 10.1097/CCM.0000000000005361
239. Lehmberg K, Pink I, Eulenburg C, et al. Differentiating Macrophage Activation Syndrome in Systemic Juvenile Idiopathic Arthritis from Other Forms of Hemophagocytic Lymphohistiocytosis. J Pediatr. 2013; 162: 1245 - 51. doi: 10.1016/j.jpeds.2012.11.081
240. Chen T-Y, Hsu M-H, Kuo H-C, et al. Outcome analysis of pediatric hemophagocytic lymphohistiocytosis. J Formos Med Assoc. 2021; 120: 172 - 9. doi: 10.1016/j.jfma.2020.03.025
241. Rigante D, Emmi G, Fastiggi M, et al. Macrophage activation syndrome in the course of monogenic autoinflammatory disorders. Clin Rheumatol. 2015; 34: 1333 - 9. doi: 10.1007/s10067-015-2923-0
242. Valade S, Mariotte E, Azoulay E. Coagulation Disorders in Hemophagocytic Lymphohistiocytosis/Macrophage Activation Syndrome. Crit Care Clin. 2020; 36: 415 - 26. doi: 10.1016/j.ccc.2019.12.004
243. Valade S, Azoulay E, Galicier L, et al. Coagulation Disorders and Bleedings in Critically Ill Patients With Hemophagocytic Lymphohistiocytosis. Medicine (Baltimore). 2015; 94: e1692. doi: 10.1097/MD.0000000000001692
244. Iakunina LN, Plakhuta TG, Tsymbal IN. [State of hemostasis in hemorrhagic vasculitis in children]. Pediatriia. 1992; 16 - 20.
245. Law C, Raffini L. A Guide to the Use of Anticoagulant Drugs in Children. Pediatr Drugs. 2015; 17: 105 - 14. doi: 10.1007/s40272-015-0120-x
246. McGrowder, D., Brown, P., Gordon, L., Budall, S., Irving, R., Alexander-Lindo, R., & Mhlanga, M. The Application of Thromboelastography in Clinical Practice.
247. Xiang, L., Qian, J., Zhang, J., Ren, H., HU, X., LI, B., ... & NING, B. (2017). Clinical study of thromboelastography for assessment of coagulation disorders in children with sepsis. Chinese Journal of Emergency Medicine, 1284 - 1289.
248. Li Z, Xiao J, Song H, et al. Evaluation of coagulation disorders by thromboelastography in children with systemic lupus erythematosus. Lupus. 2019; 28: 181 - 8. doi: 10.1177/0961203318819137
249.  T, Tse SML, Schneider R, et al. Macrophage activation syndrome as the presenting manifestation of rheumatic diseases in childhood. J Pediatr. 2006; 148: 683 - 6. doi: 10.1016/j.jpeds.2005.12.070
T, Tse SML, Schneider R, et al. Macrophage activation syndrome as the presenting manifestation of rheumatic diseases in childhood. J Pediatr. 2006; 148: 683 - 6. doi: 10.1016/j.jpeds.2005.12.070
250. Bagri NK, Gupta L, Sen ES, et al. Macrophage Activation Syndrome in Children: Diagnosis and Management. Indian Pediatr. 2021; 58: 1155 - 61. doi: 10.1007/s13312-021-2399-8
251. Abolghasemi H, Shahverdi E, Niknam R, et al. Macrophage Activation Syndrome as the First Presentation of Juvenile Idiopathic Arthritis. IJBC. 2017; 9: 93 - 6.
252. Ansuini V, Rigante D, Esposito S. Debate around infection-dependent hemophagocytic syndrome in paediatrics. BMC Infect Dis. 2013; 13: 15. doi: 10.1186/1471-2334-13-15
253. D'Errico MM, Cuoco F, Biancardi C, et al. YIM-P58. Macrophage activation syndrome: the role of infectious triggers. Pediatr Rheumatol. 2014; 12: Y5. 1546-0096-12-S1-Y5. doi: 10.1186/1546-0096-12-S1-Y5
254. Eloseily EM, Cron RQ. Macrophage Activation Syndrome. In: Ragab G, Atkinson TP, Stoll ML, eds. The Microbiome in Rheumatic Diseases and Infection. Cham: Springer International Publishing 2018: 151 - 82.
255. Long S. S., Pickering L. K., Prober C. G. Principles and practice of pediatric infectious diseases. - 2023.
256. Xu D, Li S, Chen Z, et al. Detection of Mycoplasma pneumoniae in different respiratory specimens. Eur J Pediatr. 2011; 170: 851 - 8. doi: 10.1007/s00431-010-1360-y
257. Copete AR, Vera C, Herrera M, et al. Mycoplasma pneumoniae in Children With and Without Community-acquired Pneumonia. What do PCR and Serology Say? Pediatr Infect Dis J. 2020; 39: e104 - 8. doi: 10.1097/INF.0000000000002636
258. Waris ME, Toikka P, Saarinen T, et al. Diagnosis of Mycoplasma pneumoniae Pneumonia in Children. J Clin Microbiol. 1998; 36: 3155 - 9. doi: 10.1128/JCM.36.11.3155-3159.1998
259. Department of Microbiology, Maulana Azad Medical College, India, Kumar S, Kumar S, et al. Mycoplasma Pneumoniae as a Causative Agent of Community-Acquired Lower Respiratory Tract Infections in Children. Ann Pediatr Child Health. 2023; 11: 1 - 4. doi: 10.47739/2373-9312.pediatrics.1325
260. Blanche S, Caniglia M, Fischer A, et al. Epstein-Barr Virus-Associated Hemophagocytic Syndrome: Clinical Presentation and Treatment. Pediatr Hematol Oncol. 1989; 6: 233 - 5. doi: 10.3109/08880018909034292
261. Nowalk A, Green M. Epstein-Barr Virus. Microbiol Spectr. 2016; 4: 4.3.47. doi: 10.1128/microbiolspec.DMIH2-0011-2015
262. Zeng H-S, Xiong X-Y, Wei Y-D, et al. Macrophage activation syndrome in 13 children with systemic-onset juvenile idiopathic arthritis. World J Pediatr. 2008; 4: 97 - 101. doi: 10.1007/s12519-008-0018-6
263. Brisse E, Matthys P, Wouters CH. Understanding the spectrum of haemophagocytic lymphohistiocytosis: update on diagnostic challenges and therapeutic options. Br J Haematol. 2016; 174: 175 - 87. doi: 10.1111/bjh.14144
264. Lin C-I, Yu H-H, Lee J-H, et al. Clinical analysis of macrophage activation syndrome in pediatric patients with autoimmune diseases. Clin Rheumatol. 2012; 31: 1223 - 30. doi: 10.1007/s10067-012-1998-0
265.  K,
K,  I,
I,  Z, et al. Systemic Juvenile Idiopathic Arthritis and Secondary Macrophage Activation Syndrome in Latvia from 2009 to 2020: A Nationwide Retrospective Study. Medicina (Mex). 2023; 59: 798. doi: 10.3390/medicina59040798
Z, et al. Systemic Juvenile Idiopathic Arthritis and Secondary Macrophage Activation Syndrome in Latvia from 2009 to 2020: A Nationwide Retrospective Study. Medicina (Mex). 2023; 59: 798. doi: 10.3390/medicina59040798
266. Nadimpalli S, Foca M, Satwani P, et al. Diagnostic yield of bronchoalveolar lavage in immunocompromised children with malignant and non-malignant disorders: BAL in Immunocompromised Children. Pediatr Pulmonol. 2017; 52: 820 - 6. doi: 10.1002/ppul.23644
267. Ers. Bronchoalveolar lavage in children. Eur Respir J. 2000; 15: 217 - 31. doi: 10.1183/09031936.00.15121700
268. Amanati A, Karimi A, Fahimzad A, et al. Prevalence of Human Herpes Viruses in Bronchoalveolar Lavage of Critically Ill Children Undergoing Mechanical Ventilation at a Pediatric Intensive Care Unit. Arch Pediatr Infect Dis. 2018; 6. doi: 10.5812/pedinfect.12685
269. Wong JCP, Hon KLE, Leung KKY, et al. Diagnostic Yield of Bronchoalveolar Lavage in Immunocompromised Children. J Trop Pediatr. 2021; 67: fmaa131. doi: 10.1093/tropej/fmaa131
270. Eroglu-Ertugrul NG, Yalcin E, Oguz B, et al. The value of flexible bronchoscopy in pulmonary infections of immunosuppressed children. Clin Respir J. 2020; 14: 78 - 84. doi: 10.1111/crj.13103
271. Gonski K, Cohn R, Widger J, et al. Utility of bronchoscopy in immunocompromised paediatric patients: Systematic review. Paediatr Respir Rev. 2020; 34: 24 - 34. doi: 10.1016/j.prrv.2020.02.003
272.  S, Bayram
S, Bayram  S. [Investigation of Pneumocystis jirovecii pneumonia and colonization in iatrogenically immunosuppressed and immunocompetent patients]. Mikrobiyol Bul. 2015; 49: 221 - 30. doi: 10.5578/mb.9344
S. [Investigation of Pneumocystis jirovecii pneumonia and colonization in iatrogenically immunosuppressed and immunocompetent patients]. Mikrobiyol Bul. 2015; 49: 221 - 30. doi: 10.5578/mb.9344
273. Lachant DJ, Croft DP, McGrane Minton H, et al. The clinical impact of pneumocystis and viral PCR testing on bronchoalveolar lavage in immunosuppressed patients. Respir Med. 2018; 145: 35 - 40. doi: 10.1016/j.rmed.2018.10.021
274. Stephan JL. Reactive haemophagocytic syndrome in children with inflammatory disorders. A retrospective study of 24 patients. Rheumatology. 2001; 40: 1285 - 92. doi: 10.1093/rheumatology/40.11.1285
275. Varadaraju S, Khandelwal P, Sankar J, et al. Multiple opportunistic infection-associated hemophagocytic lymphohistiocytosis in nephrotic syndrome: A case report. J Pediatr Crit Care. 2021; 8: 295. doi: 10.4103/jpcc.jpcc_64_21
276. Weyant RB, Kabbani D, Doucette K, et al. Pneumocystis jirovecii: a review with a focus on prevention and treatment. Expert Opin Pharmacother. 2021; 22: 1579 - 92. doi: 10.1080/14656566.2021.1915989
277. Morris A, Norris KA. Colonization by Pneumocystis jirovecii and Its Role in Disease. Clin Microbiol Rev. 2012; 25: 297 - 317. doi: 10.1128/CMR.00013-12
278. White PL, Price JS, Backx M. Pneumocystis jirovecii Pneumonia: Epidemiology, Clinical Manifestation and Diagnosis. Curr Fungal Infect Rep. 2019; 13: 260 - 73. doi: 10.1007/s12281-019-00349-3
279.  M,
M,  M,
M,  J. Pneumocystis pneumonia in a child with sojia. Pediatr Rheumatol. 2014; 12: P225, 1546-0096-12-S1-P225. doi: 10.1186/1546-0096-12-S1-P225
J. Pneumocystis pneumonia in a child with sojia. Pediatr Rheumatol. 2014; 12: P225, 1546-0096-12-S1-P225. doi: 10.1186/1546-0096-12-S1-P225
280. Saper V. E. et al. Emergent high fatality lung disease in systemic juvenile arthritis//Annals of the rheumatic diseases. - 2019. - Т. 78. - N. 12. - С. 1722 - 1731.
281. Rayment JH, Narang I. Pulmonary Aspergillosis in a Previously Healthy 13-Year-Old Boy. Can Respir J. 2016; 2016: 4575942. doi: 10.1155/2016/4575942
282. de Mol M, de Jongste JC, van Westreenen M, et al. Diagnosis of invasive pulmonary aspergillosis in children with bronchoalveolar lavage galactomannan: BAL Galactomannan Aspergillosis Children. Pediatr Pulmonol. 2013; 48: 789 - 96. doi: 10.1002/ppul.22670
283. Zhao M, Guan Y, Lin J, et al. Acute kidney injury in critical care: complications of hemophagocytic lymphohistiocytosis. Front Immunol. 2024; 15: 1396124. doi: 10.3389/fimmu.2024.1396124
284. Fitzgerald NE, MacClain KL. Imaging characteristics of hemophagocytic lymphohistiocytosis. Pediatr Radiol. 2003; 33: 392 - 401. doi: 10.1007/s00247-003-0894-9
285. Schmidt MH, Sung L, Shuckett BM. Hemophagocytic Lymphohistiocytosis in Children: Abdominal US Findings within 1 Week of Presentation. Radiology. 2004; 230: 685 - 9. doi: 10.1148/radiol.2303030223
286. Chinnici A, Beneforti L, Pegoraro F, et al. Approaching hemophagocytic lymphohistiocytosis. Front Immunol. 2023; 14: 1210041. doi: 10.3389/fimmu.2023.1210041
287. Malik P, Antonini L, Mannam P, et al. MRI Patterns in Pediatric CNS Hemophagocytic Lymphohistiocytosis. Am J Neuroradiol. 2021; 42: 2077 - 85. doi: 10.3174/ajnr.A7292
288. Shieh AC, Guler E, Smith DA, et al. Hemophagocytic Lymphohistiocytosis: A Primer for Radiologists. Am J Roentgenol. 2020; 214: W11 - 9. doi: 10.2214/AJR.19.21788
289. Hur M, Kim YC, Lee KM, et al. Macrophage Activation Syndrome in a Child with Systemic Juvenile Rheumatoid Arthritis. J Korean Med Sci. 2005; 20: 695. doi: 10.3346/jkms.2005.20.4.695
290. Behrens EM, Beukelman T, Paessler M, et al. Occult macrophage activation syndrome in patients with systemic juvenile idiopathic arthritis. J Rheumatol. 2007; 34: 1133 - 8.
291. Shekarchian F, Abadi MKA, Shariati MM. Clinical approach to a child with hemophagocytic lymphohistiocytosis and bilateral optic nerve head infiltration: A case report and brief literature review. Clin Case Rep. 2023; 11: e7999. doi: 10.1002/ccr3.7999
292. Wang L, Suo L, Kou F, et al. Ocular Phenotypes in Patients With Hemophagocytic Lymphohistiocytosis: A Retrospective Analysis in a Single Center Over 7 Years. Am J Ophthalmol. 2023; 253: 119 - 31. doi: 10.1016/j.ajo.2023.05.011
293.  M. et al. Atypical eye manifestation in macrophage activation syndrome complicating systemic juvenile idiopathic arthritis//Alergia, Asma e
M. et al. Atypical eye manifestation in macrophage activation syndrome complicating systemic juvenile idiopathic arthritis//Alergia, Asma e 
 . - 2020. - Т. 29. - N. 2. - С. 66 - 70.
. - 2020. - Т. 29. - N. 2. - С. 66 - 70.
294. Криулин И.А., Алексеева Е.И., Шилькрот И.Ю., Дворяковская Т.М. Вторичный гемофагоцитарный синдром: прогностическая модель и ранние маркеры развития у пациентов с системным ювенильным идиопатическим артритом. Результаты когортного ретроспективного исследования. Вопросы практической педиатрии. 2022; 17(6): 17 - 24. DOI: 10.20953/1817-7646-2022-6-17-24
295. Pan S, Yu H, Surti A, et al. Pharmacodynamics of rituximab on B lymphocytes in paediatric patients with autoimmune diseases. Br J Clin Pharmacol. 2019; 85: 1790 - 7. doi: 10.1111/bcp.13970
296. McAtee CL, Lubega J, Underbrink K, et al. Association of Rituximab Use With Adverse Events in Children, Adolescents, and Young Adults. JAMA Netw Open. 2021; 4: e2036321. doi: 10.1001/jamanetworkopen.2020.36321
297. Smolewska E, Cebula B,  H, et al. Relationship between impaired apoptosis of lymphocytes and distribution of dendritic cells in peripheral blood and synovial fluid of children with juvenile idiopathic arthritis. Arch Immunol Ther Exp (Warsz). 2008; 56: 283 - 9. doi: 10.1007/s00005-008-0030-5
H, et al. Relationship between impaired apoptosis of lymphocytes and distribution of dendritic cells in peripheral blood and synovial fluid of children with juvenile idiopathic arthritis. Arch Immunol Ther Exp (Warsz). 2008; 56: 283 - 9. doi: 10.1007/s00005-008-0030-5
298. Hsin Y-C, Zhuang L-Z, Yeh K-W, et al. Risk of Tuberculosis in Children with Juvenile Idiopathic Arthritis: A Nationwide Population-Based Study in Taiwan. PloS One. 2015; 10: e0128768. doi: 10.1371/journal.pone.0128768
299. Бзарова Т., Алексеева Е., Акулова С. Случай эпштейна-барр вирусной инфекции, протекавшей под маской системного варианта ювенильного ревматоидного артрита. Вопросы современной педиатрии. 2007; 6(3): 101 - 106.
300.  S, Bayram
S, Bayram  S. Investigation of Pneumocystis jirovecii Pneumonia and Colonization in Iatrogenically Immunosuppressed and Immunocompetent Patients. Mikrobiyol Bul. 2015; 49: 221 - 30. doi: 10.5578/mb.9344
S. Investigation of Pneumocystis jirovecii Pneumonia and Colonization in Iatrogenically Immunosuppressed and Immunocompetent Patients. Mikrobiyol Bul. 2015; 49: 221 - 30. doi: 10.5578/mb.9344
301. Bateman M, Oladele R, Kolls JK. Diagnosing Pneumocystis jirovecii pneumonia: A review of current methods and novel approaches. Med Mycol. 2020; 58: 1015 - 28. doi: 10.1093/mmy/myaa024
302. Park JW, Curtis JR, Kim MJ, et al. Pneumocystis pneumonia in patients with rheumatic diseases receiving prolonged, non-high-dose steroids - clinical implication of primary prophylaxis using trimethoprim-sulfamethoxazole. Arthritis Res Ther. 2019; 21: 207. doi: 10.1186/s13075-019-1996-6
303. Sulieman SE, Metjian TA, Zaoutis TE, et al. Pneumocystis Pneumonia: Epidemiology and Options for Prophylaxis in Non-HIV Immunocompromised Pediatric Patients. Curr Fungal Infect Rep. 2014; 8: 45 - 55. doi: 10.1007/s12281-014-0177-y
304.  J,
J,  S,
S,  MT, et al. Pneumocystis jirovecii pneumonia in children. A retrospective study in a single center over three decades. Enfermedades Infecc Microbiol
MT, et al. Pneumocystis jirovecii pneumonia in children. A retrospective study in a single center over three decades. Enfermedades Infecc Microbiol  . 2020; 38: 111 - 8. doi: 10.1016/j.eimc.2019.05.005
. 2020; 38: 111 - 8. doi: 10.1016/j.eimc.2019.05.005
305. Kim YW, Kwon BS, Lim SY, et al. Diagnostic value of bronchoalveolar lavage and bronchial washing in sputum-scarce or smear-negative cases with suspected pulmonary tuberculosis: a randomized study. Clin Microbiol Infect. 2020; 26: 911 - 6. doi: 10.1016/j.cmi.2019.11.013
306. Daelemans, Siel & Peeters, Linde & Wachter, Elke & Malfroot, Anne. (2019). Challenges in Diagnosing Mycobacterial Infections in Children. 21. 194 - 199.
307. Solovic I, Sester M, Gomez-Reino JJ, et al. The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur Respir J. 2010; 36: 1185 - 206. doi: 10.1183/09031936.00028510
308. Qu Y, Liu M, Sun X, et al. Development and evaluation of a triplex droplet digital PCR method for differentiation of M. tuberculosis, M. bovis and BCG. Front Microbiol. 2024; 15: 1397792. doi: 10.3389/fmicb.2024.1397792
309. Bal ZS, Yazici P, Sen S, et al. A fatal case of tuberculous meningitis in a child with juvenile idiopathic arthritis: a diagnostic challenge. Rev Soc Bras Med Trop. 2017; 50: 709 - 11. doi: 10.1590/0037-8682-0410-2016
310. Noguera-Julian A,  J, Brinkmann F, et al. Tuberculosis Disease in Children and Adolescents on Therapy With Antitumor Necrosis
J, Brinkmann F, et al. Tuberculosis Disease in Children and Adolescents on Therapy With Antitumor Necrosis 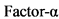 Agents: A Collaborative, Multicenter Paediatric Tuberculosis Network European Trials Group (ptbnet) Study. Clin Infect Dis. 2020; 71: 2561 - 9. doi: 10.1093/cid/ciz1138
Agents: A Collaborative, Multicenter Paediatric Tuberculosis Network European Trials Group (ptbnet) Study. Clin Infect Dis. 2020; 71: 2561 - 9. doi: 10.1093/cid/ciz1138
311. Restrepo-Gualteros SM, Gutierrez MJ, Villamil-Osorio M, et al. Challenges and Clinical Implications of the Diagnosis of Cytomegalovirus Lung Infection in Children. Curr Infect Dis Rep. 2019; 21: 24. doi: 10.1007/s11908-019-0681-x
312. Lyu J, Deng Q, Li R, et al. Pneumonia Caused by Coinfection with Cytomegalovirus and Pneumocystis jirovecii in an HIV-Negative Infant Diagnosed by Metagenomic Next-Generation Sequencing. Infect Drug Resist. 2022; Volume 15: 3417 - 25. doi: 10.2147/IDR.S364241
313. Ramos JT, Romero CA, Belda S, et al. Clinical practice update of antifungal prophylaxis in immunocompromised children. Rev Espanola Quimioter Publicacion Of Soc Espanola Quimioter 2019; 32: 410 - 25.
314. Tragiannidis A, Kyriakidis I,  I, et al. Invasive fungal infections in pediatric patients treated with tumor necrosis alpha
I, et al. Invasive fungal infections in pediatric patients treated with tumor necrosis alpha 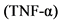 inhibitors. Mycoses. 2017; 60: 222 - 9. doi: 10.1111/myc.12576
inhibitors. Mycoses. 2017; 60: 222 - 9. doi: 10.1111/myc.12576
315. Sandau KE, Funk M, Auerbach A, et al. Update to Practice Standards for Electrocardiographic Monitoring in Hospital Settings: A Scientific Statement From the American Heart Association. Circulation. 2017; 136. doi: 10.1161/CIR.0000000000000527
316. Lazzerini PE, Capecchi PL, Guideri F, et al. Comparison of Frequency of Complex Ventricular Arrhythmias in Patients With Positive Versus Negative Anti-Ro/SSA and Connective Tissue Disease. Am J Cardiol. 2007; 100: 1029 - 34. doi: 10.1016/j.amjcard.2007.04.048
317. Caforio ALP, Adler Y, Agostini C, et al. Diagnosis and management of myocardial involvement in systemic immune-mediated diseases: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Disease. Eur Heart J. 2017; 38: 2649 - 62. doi: 10.1093/eurheartj/ehx321
318. Malattia C, Tzaribachev N, van den Berg JM, et al. Juvenile idiopathic arthritis - the role of imaging from a rheumatologist's perspective. Pediatr Radiol. 2018; 48: 785 - 91. doi: 10.1007/s00247-017-4014-7
319. Malattia C, Tolend M, Mazzoni M, et al. Current status of MR imaging of juvenile idiopathic arthritis. Best Pract Res Clin Rheumatol. 2020; 34: 101629. doi: 10.1016/j.berh.2020.101629
320. Zhang P, Li X, Li Y, et al. Reversible posterior leukoencephalopathy syndrome secondary to systemic-onset juvenile idiopathic arthritis: A case report and review of the literature. Biomed Rep. 2015; 3: 55 - 8. doi: 10.3892/br.2014.380
321. Koenig MK, Perez M, Rothenberg S, et al. Juvenile Onset Central Nervous System Folate Deficiency and Rheumatoid Arthritis. J Child Neurol. 2008; 23: 106 - 7. doi: 10.1177/0883073807307986
322.  AN,
AN,  C,
C,  R, et al. Concurrence of juvenile idiopathic arthritis and primary demyelinating disease in a young child. Mult Scler Relat Disord. 2019; 27: 20 - 2. doi: 10.1016/j.msard.2018.10.002
R, et al. Concurrence of juvenile idiopathic arthritis and primary demyelinating disease in a young child. Mult Scler Relat Disord. 2019; 27: 20 - 2. doi: 10.1016/j.msard.2018.10.002
323.  DMR, Buscatti IM,
DMR, Buscatti IM,  B, et al. Neurite
B, et al. Neurite  em paciente com artrite
em paciente com artrite  juvenil. Rev Bras Reumatol. 2014; 54: 486 - 9. doi: 10.1016/j.rbr.2014.01.011
juvenil. Rev Bras Reumatol. 2014; 54: 486 - 9. doi: 10.1016/j.rbr.2014.01.011
324. Weng Y, Yi C, Liang H, et al. The Brain Structural-Functional Vulnerability in Drug-Naive Children With Juvenile Idiopathic Arthritis: Insights From the Hippocampus. Front Hum Neurosci. 2022; 16: 833602. doi: 10.3389/fnhum.2022.833602
325. Mavrogeni S, Koutsogeorgopoulou L, Dimitroulas T, et al. Combined Brain/Heart Magnetic Resonance Imaging in Systemic Lupus Erythematosus. Curr Cardiol Rev. 2020; 16: 178 - 86. doi: 10.2174/1573403X15666190801122105
326. Zajaczkowska M, Papierkowski A, Szczepanowska A, et al. [Influence of glucocorticoid steroid therapy on gastric and duodenal mucosa and Helicobacter pylori infection in children with nephrotic syndrome]. Pol Merkur Lek Organ Pol Tow Lek. 2001; 10: 165 - 7.
327. Galindo-Zavala R, Bou-Torrent R,  B, et al. Expert panel consensus recommendations for diagnosis and treatment of secondary osteoporosis in children. Pediatr Rheumatol Online J. 2020; 18: 20. doi: 10.1186/s12969-020-0411-9
B, et al. Expert panel consensus recommendations for diagnosis and treatment of secondary osteoporosis in children. Pediatr Rheumatol Online J. 2020; 18: 20. doi: 10.1186/s12969-020-0411-9
328. Buckley L, Guyatt G, Fink HA, et al. 2017 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis: ACR guideline for glucocorticoid-induced osteoporosis prevention and treatment. Arthritis Rheumatol. 2017; 69: 1521 - 37. doi: 10.1002/art.40137
329. Harari S, Paciocco G, Aramu S. Ear and nose involvement in systemic diseases. Monaldi Arch Chest Dis Arch Monaldi Mal Torace. 2000; 55: 466 - 70.
330. Stoustrup P, Resnick CM, Abramowicz S, et al. Management of Orofacial Manifestations of Juvenile Idiopathic Arthritis: Interdisciplinary Consensus-Based Recommendations. Arthritis Rheumatol. 2023; 75: 4 - 14. doi: 10.1002/art.42338
331. Walton AG, Welbury RR, Thomason JM, et al. Oral health and juvenile idiopathic arthritis: a review. Rheumatology. 2000; 39: 550 - 5. doi: 10.1093/rheumatology/39.5.550
332. Angeles-Han ST, Ringold S, Beukelman T, et al. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Screening, Monitoring, and Treatment of Juvenile Idiopathic Arthritis-Associated Uveitis. Arthritis Care Res. 2019; 71: 703 - 16. doi: 10.1002/acr.23871
333. Constantin T, Foeldvari I, Anton J, et al. Consensus-based recommendations for the management of uveitis associated with juvenile idiopathic arthritis: the SHARE initiative. Ann Rheum Dis. 2018; 77: 1107 - 17. doi: 10.1136/annrheumdis-2018-213131
334. Arsenaki E, Georgakopoulos P, Mitropoulou P, et al. Cardiovascular Disease in Juvenile Idiopathic Arthritis. Curr Vasc Pharmacol. 2020; 18: 580 - 91. doi: 10.2174/1570161118666200408121307
335. Hou J, Song FY, Xu YJ, et al. [Analysis of 13 cases with pediatric rheumatic disease combined with endocrine disorder]. Zhonghua Er Ke Za Zhi Chin J Pediatr. 2021; 59: 865 - 70. doi: 10.3760/cma.j.cn112140-20210303-00178
336. Whittle, Vanessa & Gane, J & Cheetham, T. (2017). G169(P) Management of steroid induced diabetes in children: A national perspective. Archives of Disease in Childhood. 102. A69.1-A69.10.1136/archdischild-2017-313087.168.
337. Hsieh L-F, Mao H-F, Lu C-C, et al. 31 - Rheumatologic Rehabilitation. In: Cifu DX, ed. Braddom's Physical Medicine and Rehabilitation (Sixth Edition). Philadelphia: Elsevier 2021: 606 - 626.e1.
338. Prothero L, Barley E, Galloway J, et al. The evidence base for psychological interventions for rheumatoid arthritis: A systematic review of reviews. Int J Nurs Stud. 2018; 82: 20 - 9. doi: 10.1016/j.ijnurstu.2018.03.008
339. Sestan M, Grguric D, Sedmak M, et al. Quality of life in children suffering from juvenile idiopathic arthritis-associated uveitis. Rheumatol Int. 2020; 40: 1117 - 21. doi: 10.1007/s00296-020-04536-1
340. Berntson L. A pilot study of possible anti-inflammatory effects of the specific carbohydrate diet in children with juvenile idiopathic arthritis. Pediatr Rheumatol Online J. 2021; 19: 88. doi: 10.1186/s12969-021-00577-3
341. Caetano MC, Ortiz TT, Terreri MTSRLA, et al. Inadequate dietary intake of children and adolescents with juvenile idiopathic arthritis and systemic lupus erythematosus. J Pediatr (Rio J). 2009; 85: 509 - 15. doi: 10.2223/JPED.1941
342. Fc A. The Portuguese Society of Rheumatology position paper on the use of biosimilars - 2017 update. 2017.
343. Atzeni F, Sebastiani M, Ricci C, et al. Position paper of Italian rheumatologists on the use of biosimilar drugs.
344. Abad 
 , Andreu JL, Caracuel Ruiz
, Andreu JL, Caracuel Ruiz  , et al. Position Paper From the Spanish Society of Rheumatology on Biosimilar Drugs. Reumatol
, et al. Position Paper From the Spanish Society of Rheumatology on Biosimilar Drugs. Reumatol  Engl Ed. 2015; 11: 269 - 78. doi: 10.1016/j.reumae.2015.03.012
Engl Ed. 2015; 11: 269 - 78. doi: 10.1016/j.reumae.2015.03.012
345. Huizinga TWJ, Torii Y, Muniz R. Adalimumab Biosimilars in the Treatment of Rheumatoid Arthritis: A Systematic Review of the Evidence for Biosimilarity. Rheumatol Ther. 2021; 8: 41 - 61. doi: 10.1007/s40744-020-00259-8
346. Lim LSH, Lokku A, Pullenayegum E, et al. Probability of Response in the First Sixteen Weeks After Starting Biologics: An Analysis of Juvenile Idiopathic Arthritis Biologics Trials. Arthritis Care Res. 2023; acr.25003. doi: 10.1002/acr.25003
347. Ravelli A, Consolaro A, Horneff G, et al. Treating juvenile idiopathic arthritis to target: recommendations of an international task force. Ann Rheum Dis. 2018; 77: 819 - 28. doi: 10.1136/annrheumdis-2018-213030
348. Ringold S, Angeles-Han ST, Beukelman T, et al. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Treatment of Juvenile Idiopathic Arthritis: Therapeutic Approaches for Non-Systemic Polyarthritis, Sacroiliitis, and Enthesitis. Arthritis Care Res. 2019; 71: 717 - 34. doi: 10.1002/acr.23870
349. Shi C-L, Zhang Y, Zhang Z-Y, et al. Comparative Efficacy and Safety of Non-Steroidal Anti-Inflammatory Drugs in Patients With Juvenile Idiopathic Arthritis: A Systematic Review and Network Meta-analysis. Indian Pediatr. 2021; 58: 162 - 8.
350. Levy DM, Imundo LF. Nonsteroidal Anti-Inflammatory Drugs: A survey of practices and concerns of pediatric medical and surgical specialists and a summary of available safety data. Pediatr Rheumatol. 2010; 8: 7. doi: 10.1186/1546-0096-8-7
351. Litalien C., Jacqz-Aigrain E. Risks and benefits of nonsteroidal anti-inflammatory drugs in children//Paediatric drugs. - 2001. - Т. 3. - N. 11. - С. 817 - 858.
352. Hollingworth P. The use of non-steroidal anti-inflammatory drugs in paediatric rheumatic diseases//Rheumatology. - 1993. - Т. 32. - N. 1. - С. 73 - 77.
353. Guillaume-Czitrom S. Les anti-inflammatoires non  dans les rhumatismes inflammatoires chroniques de l'enfant [Non-steroidal anti-inflammatory drugs in chronic inflammatory arthritis in children]. La Lettre du Rhumatologue N 379 - 380 -
dans les rhumatismes inflammatoires chroniques de l'enfant [Non-steroidal anti-inflammatory drugs in chronic inflammatory arthritis in children]. La Lettre du Rhumatologue N 379 - 380 -  2012.
2012.
354. Gupta P, Sachdev HP. Safety of oral use of nimesulide in children: systematic review of randomized controlled trials. Indian Pediatr. 2003 Jun; 40(6): 518 - 31. PMID: 12824661.
355. Todd PA, Sorkin EM. Diclofenac Sodium: A Reappraisal of its Pharmacodynamic and Pharmacokinetic Properties, and Therapeutic Efficacy. Drugs. 1988; 35: 244 - 85. doi: 10.2165/00003495-198835030-00004
356. Алексеева Е., Бзарова Т. Алгоритм диагностики и лечения ювенильного артрита. Вопросы современной педиатрии. 2010; 9(6): 78 - 104.
357. Standing J.F. Diclofenac for acute pain in children: Pharmacokinetics and safety. - University of London, University College London (United Kingdom), 2007.
358. Petty RE, Laxer RM, Lindsley CB, et al. Textbook of pediatric rheumatology. 8th ed. Philadelphia: Elsevier, Inc 2020.
359. Levy DM, Imundo LF. Nonsteroidal Anti-Inflammatory Drugs: A survey of practices and concerns of pediatric medical and surgical specialists and a summary of available safety data. Pediatr Rheumatol. 2010; 8: 7. doi: 10.1186/1546-0096-8-7
360. Litalien C., Jacqz-Aigrain E. Risks and benefits of nonsteroidal anti-inflammatory drugs in children//Paediatric drugs. - 2001. - Т. 3. - N. 11. - С. 817 - 858.
361. Hollingworth P. The use of non-steroidal anti-inflammatory drugs in paediatric rheumatic diseases//Rheumatology. - 1993. - Т. 32. - N. 1. - С. 73 - 77.
362. Guillaume-Czitrom S. Les anti-inflammatoires non  dans les rhumatismes inflammatoires chroniques de l'enfant [Non-steroidal anti-inflammatory drugs in chronic inflammatory arthritis in children]. La Lettre du Rhumatologue N 379 - 380 -
dans les rhumatismes inflammatoires chroniques de l'enfant [Non-steroidal anti-inflammatory drugs in chronic inflammatory arthritis in children]. La Lettre du Rhumatologue N 379 - 380 -  2012.
2012.
363. Gupta P, Sachdev HP. Safety of oral use of nimesulide in children: systematic review of randomized controlled trials. Indian Pediatr. 2003 Jun; 40(6): 518 - 31. PMID: 12824661.
364. Алексеева Е., Валиева С. Оценка эффективности, переносимости и безопасности нимесулида у детей с ювенильным артритом. Вопросы современной педиатрии. 2007; 6(6): 76 - 80.
365. Zulian F, Martini G, Gobber D, et al. Comparison of intra-articular triamcinolone hexacetonide and triamcinolone acetonide in oligoarticular juvenile idiopathic arthritis. Rheumatol Oxf Engl. 2003; 42: 1254 - 9. doi: 10.1093/rheumatology/keg358
366. https://neo.barnlakarforeningen.se/wp-content/uploads/sites/11/2015/05/Medical-treatment-of-juvenile-idiopathic-arthritis.pdf.
367. Rubin S, Ohana O, Goldberg O, et al. The efficacy and safety of intra-articular injection of triamcinolone acetonide versus triamcinolone hexacetonide for treatment of juvenile idiopathic arthritis. Pediatr Rheumatol. 2022; 20: 5. doi: 10.1186/s12969-022-00666-x
368. Zulian F. Triamcinolone acetonide and hexacetonide intra-articular treatment of symmetrical joints in juvenile idiopathic arthritis: a double-blind trial. Rheumatology. 2004; 43: 1288 - 91. doi: 10.1093/rheumatology/keh313
369. Hetland ML, Stengaard-Pedersen K, Junker P, et al. Combination treatment with methotrexate, cyclosporine, and intraarticular betamethasone compared with methotrexate and intraarticular betamethasone in early active rheumatoid arthritis: An investigator-initiated, multicenter, randomized, double-blind, parallel-group, placebo-controlled study. Arthritis Rheum. 2006; 54: 1401 - 9. doi: 10.1002/art.21796
370. Scherer J, Rainsford KD, Kean CA, et al. Pharmacology of intra-articular triamcinolone. Inflammopharmacology. 2014; 22: 201 - 17. doi: 10.1007/s10787-014-0205-0
371. Beukelman T, Patkar NM, Saag KG, et al. 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features. Arthritis Care Res. 2011; 63: 465 - 82. doi: 10.1002/acr.20460
372. Onel K, Rumsey DG, Shenoi S. Juvenile Idiopathic Arthritis Treatment Updates. Rheum Dis Clin N Am. 2021; 47: 545 - 63. doi: 10.1016/j.rdc.2021.07.009
373. Schiappapietra B, Varnier G, Rosina S, et al. Glucocorticoids in Juvenile Idiopathic Arthritis. Neuroimmunomodulation. 2015; 22: 112 - 8. doi: 10.1159/000362732
374. Nasef S. Juvenile Idiopathic Arthritis: An Overview for the Clinicians. Suez Canal Univ Med J. 2021; 24: 93 - 103. doi: 10.21608/scumj.2021.192012
375. Batu ED. Glucocorticoid treatment in juvenile idiopathic arthritis. Rheumatol Int. 2019; 39: 13 - 27. doi: 10.1007/s00296-018-4168-0
376. Ravelli A,  S, Bracciolini G, et al. Intra-articular corticosteroids versus intra-articular corticosteroids plus methotrexate in oligoarticular juvenile idiopathic arthritis: a multicentre, prospective, randomised, open-label trial. Lancet Lond Engl. 2017; 389: 909 - 16. doi: 10.1016/S0140-6736(17)30065-X
S, Bracciolini G, et al. Intra-articular corticosteroids versus intra-articular corticosteroids plus methotrexate in oligoarticular juvenile idiopathic arthritis: a multicentre, prospective, randomised, open-label trial. Lancet Lond Engl. 2017; 389: 909 - 16. doi: 10.1016/S0140-6736(17)30065-X
377. Ferrara G, Mastrangelo G, Barone P, et al. Methotrexate in juvenile idiopathic arthritis: advice and recommendations from the MARAJIA expert consensus meeting. Pediatr Rheumatol Online J. 2018; 16: 46. doi: 10.1186/s12969-018-0255-8
378. Woo P, Southwood TR, Prieur AM, et al. Randomized, placebo-controlled, crossover trial of low-dose oral methotrexate in children with extended oligoarticular or systemic arthritis. Arthritis Rheum. 2000; 43: 1849 - 57. doi: 10.1002/1529-0131(200008)43:8<1849::AID-ANR22>3.0.CO; 2-F
379. Ruperto N, Murray KJ, Gerloni V, et al. A randomized trial of parenteral methotrexate comparing an intermediate dose with a higher dose in children with juvenile idiopathic arthritis who failed to respond to standard doses of methotrexate. Arthritis Rheum. 2004; 50: 2191 - 201. doi: 10.1002/art.20288
380. Giannini EH, Brewer EJ, Kuzmina N, et al. Methotrexate in Resistant Juvenile Rheumatoid Arthritis: Results of the U.S.A. - U.S.S.R. Double-Blind, Placebo-Controlled Trial. N Engl J Med. 1992; 326: 1043 - 9. doi: 10.1056/NEJM199204163261602
381. Ravelli, A., Migliavacca, D., Viola, S., Ruperto, N., Pistorio, A., & Martini, A. (1999). Efficacy of folinic arid in reducing methotrexate toxicity in juvenile idiopathic arthritis. Clinical and experimental rheumatology, 17, 625 - 627.
382. LRI Children's Hospital Paediatric Rheumatology Methotrexate therapy/url https://secure.library.leicestershospitals.nhs.uk/PAGL/Shared%20Documents/Methotrexate%20Therapy%20in%20Paediatric%20Rheumatology%20UHL%20Childrens%20Hospital%20Guideline.pdf.
383. Niehues T, Lankisch P. Recommendations for the Use of Methotrexate in Juvenile Idiopathic Arthritis: Pediatr Drugs. 2006; 8: 347 - 56. doi: 10.2165/00148581-200608060-00003
384. Calvo I,  J,
J,  Robledillo JC, et al. Recomendaciones para el uso de metotrexato en pacientes con artritis
Robledillo JC, et al. Recomendaciones para el uso de metotrexato en pacientes con artritis 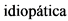 juvenil. An
juvenil. An  . 2016; 84: 177.e1 - 177.e8. doi: 10.1016/j.anpedi.2015.05.005
. 2016; 84: 177.e1 - 177.e8. doi: 10.1016/j.anpedi.2015.05.005
385. Silverman E, Spiegel L, Hawkins D, et al. Long-term open-label preliminary study of the safety and efficacy of leflunomide in patients with polyarticular-course juvenile rheumatoid arthritis. Arthritis Rheum. 2005; 52: 554 - 62. doi: 10.1002/art.20861
386. Foeldvari I, Wierk A. Effectiveness of leflunomide in patients with juvenile idiopathic arthritis in clinical practice. J Rheumatol. 2010; 37: 1763 - 7. doi: 10.3899/jrheum.090874
387. Shepherd J, Cooper K, Harris P, et al. The clinical effectiveness and cost-effectiveness of abatacept, adalimumab, etanercept and tocilizumab for treating juvenile idiopathic arthritis: a systematic review and economic evaluation. Health Technol Assess Winch Engl. 2016; 20: 1 - 222. doi: 10.3310/hta20340
388. Brunner HI, Ruperto N, Tzaribachev N, et al. Subcutaneous golimumab for children with active polyarticular-course juvenile idiopathic arthritis: results of a multicentre, double-blind, randomised-withdrawal trial. Ann Rheum Dis. 2018; 77: 21 - 9. doi: 10.1136/annrheumdis-2016-210456
389. Burmester GR, Panaccione R, Gordon KB, et al. Adalimumab: long-term safety in 23 458 patients from global clinical trials in rheumatoid arthritis, juvenile idiopathic arthritis, ankylosing spondylitis, psoriatic arthritis, psoriasis and Crohn's disease. Ann Rheum Dis. 2013; 72: 517 - 24. doi: 10.1136/annrheumdis-2011-201244
390. Foeldvari I, Constantin T,  J, et al. Etanercept treatment for extended oligoarticular juvenile idiopathic arthritis, enthesitis-related arthritis, or psoriatic arthritis: 6-year efficacy and safety data from an open-label trial. Arthritis Res Ther. 2019; 21: 125. doi: 10.1186/s13075-019-1916-9
J, et al. Etanercept treatment for extended oligoarticular juvenile idiopathic arthritis, enthesitis-related arthritis, or psoriatic arthritis: 6-year efficacy and safety data from an open-label trial. Arthritis Res Ther. 2019; 21: 125. doi: 10.1186/s13075-019-1916-9
391. Ruperto N, Brunner HI, Ramanan AV, et al. Subcutaneous dosing regimens of tocilizumab in children with systemic or polyarticular juvenile idiopathic arthritis. Rheumatol Oxf Engl. 2021; 60: 4568 - 80. doi: 10.1093/rheumatology/keab047
392. Ruperto N, Brunner HI, Synoverska O, et al. Tofacitinib in juvenile idiopathic arthritis: a double-blind, placebo-controlled, withdrawal phase 3 randomised trial. Lancet Lond Engl. 2021; 398: 1984 - 96. doi: 10.1016/S0140-6736(21) 01255-1
393. Burrone M, Mazzoni M, Naddei R, et al. Looking for the best strategy to treat children with new onset juvenile idiopathic arthritis: presentation of the "comparison of STep-up and step-down therapeutic strategies in childhood ARthritiS" (STARS) trial. Pediatr Rheumatol. 2022; 20: 80. doi: 10.1186/s12969-022-00739-x
394. Lovell DJ, Giannini EH, Reiff A, et al. Etanercept in children with polyarticular juvenile rheumatoid arthritis. Pediatric Rheumatology Collaborative Study Group. N Engl J Med. 2000; 342: 763 - 9. doi: 10.1056/NEJM200003163421103
395. A Study to Evaluate the Pharmacokinetics, Safety, and Tolerability of Upadacitinib in Pediatric Subjects With Polyarticular Course Juvenile Idiopathic Arthritis. https://ClinicalTrials.gov/show/NCT03725007.
396. Juhl CB, Cagnotto G,  F, et al. TNF-alpha inhibitors for juvenile idiopathic arthritis. Cochrane Database Syst Rev. Published Online First: 28 August 2020. doi: 10.1002/14651858.CD013715
F, et al. TNF-alpha inhibitors for juvenile idiopathic arthritis. Cochrane Database Syst Rev. Published Online First: 28 August 2020. doi: 10.1002/14651858.CD013715
397. Yamaoka K, Oku K. JAK inhibitors in rheumatology. Immunol Med. 2023; 1 - 10. doi: 10.1080/25785826.2023.2172808
398. Conaghan PG, Mysler E, Tanaka Y, et al. Upadacitinib in Rheumatoid Arthritis: A Benefit-Risk Assessment Across a Phase III Program. Drug Saf. 2021; 44: 515 - 30. doi: 10.1007/s40264-020-01036-w
399.  A, Horneff G. Januskinase-Inhibitoren in der Kinderrheumatologie: Janus kinase inhibitors in pediatric rheumatology. Arthritis Rheuma. 2021; 41: 137 - 47. doi: 10.1055/a-1400-4468
A, Horneff G. Januskinase-Inhibitoren in der Kinderrheumatologie: Janus kinase inhibitors in pediatric rheumatology. Arthritis Rheuma. 2021; 41: 137 - 47. doi: 10.1055/a-1400-4468
400. van Vollenhoven R, Hall S, Wells AF, et al. AB0333 Sustainability of response to upadacitinib among patients with active rheumatoid arthritis refractory to biological disease-modifying anti-rheumatic drugs. Ann Rheum Dis. 2022; 81: 1290 - 1. doi: 10.1136/annrheumdis-2022-eular.1191
401. Fantus SA, Ruderman EM. Updates in the Treatment of Rheumatoid Arthritis. Curr Treat Options Rheumatol. 2021; 7: 99 - 111. doi: 10.1007/s40674-021-00173-2
402. Алексеева Е.И., Крехова Е.А., Криулин И.А., Криулина Т.Ю., Дворяковская Т.М., Исаева К.Б., Чистякова Е.Г., Чомахидзе А.М., Ломакина О.Л., Фетисова А.Н., Чибисова К.В., Цулукия И.Т., Шингарова М.Ш., Ботова М.С., Кондратьева Н.М., Кокина М.Ю., Румянцев М.А. Опыт применения ингибитора янус-киназ упадацитиниба у детей с ревматическими болезнями. Вопросы практической педиатрии. 2024; 19(2): 59 - 79. DOI: 10.20953/1817-7646-2024-2-59-79.
403. Anink J, Otten MH, Prince FHM, et al. Tumour necrosis factor-blocking agents in persistent oligoarticular juvenile idiopathic arthritis: results from the Dutch Arthritis and Biologicals in Children Register. Rheumatol Oxf Engl. 2013; 52: 712 - 7. doi: 10.1093/rheumatology/kes373
404. Bergman M, Patel P, Chen N, et al. Evaluation of Adherence and Persistence Differences Between Adalimumab Citrate-Free and Citrate Formulations for Patients with Immune-Mediated Diseases in the United States. Rheumatol Ther. 2021; 8: 109 - 18. doi: 10.1007/s40744-020-00256-x
405. Yue X, Huang B, Hincapie AL, et al. Comparative effectiveness and persistence of TNFi and non-TNFi in juvenile idiopathic arthritis: a large paediatric rheumatology centre in the USA. Rheumatology. 2021; 60: 4063 - 73. doi: 10.1093/rheumatology/keaa877
406. Галстян Л.А., Жолобова Е.С., Сучкова Д.В., Чебышева С.Н., Мелешкина А.В. Опыт эффективного долговременного применения адалимумаба в лечении пациента с ранним дебютом ювенильного идиопатического артрита и увеита//Педиатрия. Consilium Medicum. - 2020. - N 2. - С. 67 - 71. doi: 10.26442/26586630.2020.2.200233
407. Fernandez JM, Madsen S, Krase JM, et al. Classification and mitigation of negative injection experiences with biologic medications. Dermatol Ther. 2020; 33: e13240. doi: 10.1111/dth.13240
408. Инструкция по применению лекарственного препарата Энбрел ЛП-0021220931121.
409. Инструкция по применению лекарственного препарата Этанерцепт ПСК ЛП-007057-310521.
410. Инструкция по применению лекарственного препарата Эрелзи ЛП-006650-141220.
411. Инструкция по применению лекарственного препарата Энбрел ЛСР-006652/09-050315 с Изменениями N 3.
412. Письмо ФАС от 22.12.2021 N ТН/109573/21 "О формировании документации на закупку лекарственных препаратов с МНН "Этанерцепт."
413. Houlton S. Benefits and drawbacks of moving to biosimilar medicines. Prescriber. 2019; 30: 13 - 5. doi: 10.1002/psb.1773
414. Horneff G, Klein A, Klotsche J, et al. Comparison of treatment response, remission rate and drug adherence in polyarticular juvenile idiopathic arthritis patients treated with etanercept, adalimumab or tocilizumab. Arthritis Res Ther. 2016; 18: 272. doi: 10.1186/s13075-016-1170-3
415. Prabu N, Petciappan V, Anand G, et al. AB1250 Tofacitinib is a safe and effective treatment option for juvenile idiopathic arthritis. Ann Rheum Dis. 2022; 81: 1735.4 - 1736. doi: 10.1136/annrheumdis-2022-eular.3173
416. Ruperto N, Lovell DJ, Quartier P, et al. Abatacept in children with juvenile idiopathic arthritis: a randomised, double-blind, placebo-controlled withdrawal trial. The Lancet. 2008; 372: 383 - 91. doi: 10.1016/S0140-6736(08)60998-8
417. Kaegi C, Wuest B, Schreiner J, et al. Systematic Review of Safety and Efficacy of Rituximab in Treating Immune-Mediated Disorders. Front Immunol. 2019; 10: 1990. doi: 10.3389/fimmu.2019.01990
418. Alexeeva EI, Valieva SI, Bzarova TM, et al. Efficacy and safety of repeat courses of rituximab treatment in patients with severe refractory juvenile idiopathic arthritis. Clin Rheumatol. 2011; 30: 1163 - 72. doi: 10.1007/s10067-011-1720-7
419. Kearsley-Fleet L, Sampath S, McCann LJ, et al. Use and effectiveness of rituximab in children and young people with juvenile idiopathic arthritis in a cohort study in the United Kingdom. Rheumatol Oxf Engl. 2019; 58: 331 - 5. doi: 10.1093/rheumatology/key306
420. Sakamoto AP, Pinheiro MM, Barbosa CMPL, et al. Uso de rituximabe em adultos jovens com  de artrite
de artrite 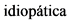 juvenil
juvenil  ao tratamento convencional: relato de 6 casos. Rev Bras Reumatol. 2015; 55: 536 - 41. doi: 10.1016/j.rbr.2014.12.015
ao tratamento convencional: relato de 6 casos. Rev Bras Reumatol. 2015; 55: 536 - 41. doi: 10.1016/j.rbr.2014.12.015
421. Genovese MC, Fleischmann R, Combe B, et al. Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease-modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. The Lancet. 2018; 391: 2513 - 24. doi: 10.1016/S0140-6736(18) 31116-4
422. Foster HE, Minden K, Clemente D, et al. EULAR/PReS standards and recommendations for the transitional care of young people with juvenile-onset rheumatic diseases. Ann Rheum Dis. 2017; 76: 639 - 46. doi: 10.1136/annrheumdis-2016-210112
423. Magnani A, Pistorio A, Magni-Manzoni S, et al. Achievement of a state of inactive disease at least once in the first 5 years predicts better outcome of patients with polyarticular juvenile idiopathic arthritis. J Rheumatol. 2009; 36: 628 - 34. doi: 10.3899/jrheum.080560
424. Kaplan MM, Kurt T, Polat MC, et al. Predictors of relapse in patients with oligoarticular juvenile idiopathic arthritis in remission off medication. Eur J Pediatr. 2023; 182: 4557 - 64. doi: 10.1007/s00431-023-05123-9
425. Barbar-Smiley, F., Cooper, A., Edelheit, B., Flanagan, E., Gillespie-Taylor, M., Hays, K., ... & Veiga, K. SUPPLEMENTARY APPENDIX 3: Evidence Report 2021 American College of Rheumatology Guideline for the Treatment of Juvenile Idiopathic Arthritis (JIA): Therapeutic Approaches for Oligoarthritis, Temporomandibular Joint (TMJ) Arthritis and Systemic JIA.
426. Onel KB, Horton DB, Lovell DJ, et al. 2021 American College of Rheumatology Guideline for the Treatment of Juvenile Idiopathic Arthritis: Therapeutic Approaches for Oligoarthritis, Temporomandibular Joint Arthritis, and Systemic Juvenile Idiopathic Arthritis. Arthritis Rheumatol. 2022; 74: 553 - 69. doi: 10.1002/art.42037
427. Crayne CB, Beukelman T. Juvenile Idiopathic Arthritis: Oligoarthritis and Polyarthritis. Pediatr Clin North Am. 2018; 65: 657 - 74. doi: 10.1016/j.pcl.2018.03.005
428.  V,
V,  M,
M,  MY, et al. What is the impact of methotrexate on liver in patients with juvenile idiopathic arthritis? Results of liver SWE performed in a single centre. Mod Rheumatol. 2022; 32: 776 - 82. doi: 10.1093/mr/roab064
MY, et al. What is the impact of methotrexate on liver in patients with juvenile idiopathic arthritis? Results of liver SWE performed in a single centre. Mod Rheumatol. 2022; 32: 776 - 82. doi: 10.1093/mr/roab064
429. van Ede AE, Laan RF, Rood MJ, et al. Effect of folic or folinic acid supplementation on the toxicity and efficacy of methotrexate in rheumatoid arthritis: a forty-eight week, multicenter, randomized, double-blind, placebo-controlled study. Arthritis Rheum. 2001; 44: 1515 - 24. doi: 10.1002/1529-0131(200107)44:7<1515::AID-ART273>3.0.CO; 2 - 7
430. Onel KB, Horton DB, Lovell DJ, et al. 2021 American College of Rheumatology Guideline for the Treatment of Juvenile Idiopathic Arthritis: Therapeutic Approaches for Oligoarthritis, Temporomandibular Joint Arthritis, and Systemic Juvenile Idiopathic Arthritis. Arthritis Rheumatol. 2022; 74: 553 - 69. doi: 10.1002/art.42037
431. Herlin T. Tocilizumab: The evidence for its place in the treatment of juvenile idiopathic arthritis. Core Evid. 2009; 181. doi: 10.2147/CE.S5992
432. Imagawa T, Yokota S, Mori M, et al. Safety and efficacy of tocilizumab, an anti-IL-6-receptor monoclonal antibody, in patients with polyarticular-course juvenile idiopathic arthritis. Mod Rheumatol. 2012; 22: 109 - 15. doi: 10.3109/s10165-011-0481-0
433. Dubko M, Kalashnikova O, Kostik M, et al. AB0554 Abatacept (ORENCIA): Experience of practical application. Ann Rheum Dis. 2013; 71: 670.3 - 670. doi: 10.1136/annrheumdis-2012-eular.554
434. Choi JY, Chung JE, Park JH, et al. Surveillance of adverse drug events associated with etanercept prescribed for juvenile idiopathic arthritis in a single center up to 9-years: A retrospective observational study. PLOS ONE. 2018; 13: e0204573. doi: 10.1371/journal.pone.0204573
435. Ayaz NA,  ,
,  R, et al. Patient satisfaction and clinical effectiveness of switching from intravenous tocilizumab to subcutaneous tocilizumab in patients with juvenile idiopathic arthritis: an observational study. Rheumatol Int. 2020; 40: 1111 - 6. doi: 10.1007/s00296-020-04596-3
R, et al. Patient satisfaction and clinical effectiveness of switching from intravenous tocilizumab to subcutaneous tocilizumab in patients with juvenile idiopathic arthritis: an observational study. Rheumatol Int. 2020; 40: 1111 - 6. doi: 10.1007/s00296-020-04596-3
436. Walscheid K, Glandorf K, Rothaus K, et al. Enthesitis-related Arthritis: Prevalence and Complications of Associated Uveitis in Children and Adolescents From a Population-based Nationwide Study in Germany. J Rheumatol. 2021; 48: 262 - 9. doi: 10.3899/jrheum.191085
437. Ward MM, Deodhar A, Akl EA, et al. American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis Rheumatol. 2016; 68: 282 - 98. doi: 10.1002/art.39298
438. Burgos-Vargas R. A 26 week randomised, double blind, placebo controlled exploratory study of sulfasalazine in juvenile onset spondyloarthropathies. Ann Rheum Dis. 2002; 61: 941 - 2. doi: 10.1136/ard.61.10.941
439. Van Rossum MAJ, Van Soesbergen RM, Boers M, et al. Long-term outcome of juvenile idiopathic arthritis following a placebo-controlled trial: sustained benefits of early sulfasalazine treatment. Ann Rheum Dis. 2007; 66: 1518 - 24. doi: 10.1136/ard.2006.064717
440. Brooks CD. Sulfasalazine for the management of juvenile rheumatoid arthritis. J Rheumatol. 2001; 28: 845 - 53.
441. Gmuca S, Weiss PF. Evaluation and Treatment of Childhood Enthesitis-Related Arthritis. Curr Treat Options Rheumatol. 2015; 1: 350 - 64. doi: 10.1007/s40674-015-0027-2
442. Weiss PF, Xiao R, Brandon TG, et al. Comparative Effectiveness of Tumor Necrosis Factor Agents and Disease-modifying Antirheumatic Therapy in Children with Enthesitis-related Arthritis: The First Year after Diagnosis. J Rheumatol. 2018; 45: 107 - 14. doi: 10.3899/jrheum.170251
443. Windschall D, Muller T, Becker I, et al. Safety and efficacy of etanercept in children with the JIA categories extended oligoarthritis, enthesitis-related arthritis and psoriasis arthritis. Clin Rheumatol. 2015; 34: 61 - 9. doi: 10.1007/s10067-014-2744-6
444. Horneff G, Burgos-Vargas R, Constantin T, et al. Efficacy and safety of open-label etanercept on extended oligoarticular juvenile idiopathic arthritis, enthesitis-related arthritis and psoriatic arthritis: part 1 (week 12) of the CLIPPER study. Ann Rheum Dis. 2014; 73: 1114 - 22. doi: 10.1136/annrheumdis-2012-203046
445. Minden K, Niewerth M, Zink A, et al. Long-term outcome of patients with JIA treated with etanercept, results of the biologic register JuMBO. Rheumatology. 2012; 51: 1407 - 15. doi: 10.1093/rheumatology/kes019
446. Batthish M, Rachlis A, Wong B, et al. Intra-rater reliability of the bath ankylosing spondylitis disease activity index (BASDAI) and the bath ankylosing spondylitis functional index (BASFI) in children with spondyloarthritis. Pediatr Rheumatol. 2012; 10: A45, 1546-0096-10-S1-A45. doi: 10.1186/1546-0096-10-S1-A45
447. Berard RA, Laxer RM. Learning the hard way: clinical trials in juvenile idiopathic arthritis. Ann Rheum Dis. 2018; 77: 1 - 2. doi: 10.1136/annrheumdis-2017-211108
448. Burgos-Vargas R, Tse SML, Horneff G, et al. A Randomized, Double-Blind, Placebo-Controlled Multicenter Study of Adalimumab in Pediatric Patients With Enthesitis-Related Arthritis. Arthritis Care Res. 2015; 67: 1503 - 12. doi: 10.1002/acr.22657
449. Horneff G, Fitter S, Foeldvari I, et al. Double-blind, placebo-controlled randomized trial with adalimumab for treatment of juvenile onset ankylosing spondylitis (JoAS): significant short term improvement. Arthritis Res Ther. 2012; 14: R230. doi: 10.1186/ar4072
450. Horneff G, Foeldvari I, Minden K, et al. Efficacy and Safety of Etanercept in Patients With the Enthesitis-Related Arthritis Category of Juvenile Idiopathic Arthritis: Results From a Phase III Randomized, Double-Blind Study. Arthritis Rheumatol. 2015; 67: 2240 - 9. doi: 10.1002/art.39145
451. Inman RD, Davis JC, Heijde DVD, et al. Efficacy and safety of golimumab in patients with ankylosing spondylitis: Results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum. 2008; 58: 3402 - 12. doi: 10.1002/art.23969
452. Baer J, Klotsche J, Foeldvari I. Secukinumab in the treatment for patients with juvenile enthesitis related arthritis non-responsive to anti-TNF treatment according the Juvenile Spondyloarthritis Disease Activity Index. Pathog Rheum Arthritis One Year Rev 2022. 2022; 40: 620 - 4. doi: 10.55563/clinexprheumatol/1u8y08
453. Brunner HI, Foeldvari I, Alexeeva E, et al. Secukinumab in enthesitis-related arthritis and juvenile psoriatic arthritis: a randomised, double-blind, placebo-controlled, treatment withdrawal, phase 3 trial. Ann Rheum Dis. 2023; 82: 154 - 60. doi: 10.1136/ard-2022-222849
454. Wu P, Huang C, Liao P, et al. Secukinumab in enthesitis-related arthritis and juvenile psoriatic arthritis. Int J Rheum Dis. 2023; 26: 2119 - 21. doi: 10.1111/1756-185X.14845
455. Deodhar A, Sliwinska-Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double-blind, placebo-controlled study. Ann Rheum Dis. 2021; 80: 1004 - 13. doi: 10.1136/annrheumdis-2020-219601
456. Van Der Heijde D, Song I-H, Pangan AL, et al. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. The Lancet. 2019; 394: 2108 - 17. doi: 10.1016/S0140-6736(19) 32534-6
457. Bou R,  A,
A,  F, et al. Clinical management algorithm of uveitis associated with juvenile idiopathic arthritis: interdisciplinary panel consensus. Rheumatol Int. 2015; 35: 777 - 85. doi: 10.1007/s00296-015-3231-3
F, et al. Clinical management algorithm of uveitis associated with juvenile idiopathic arthritis: interdisciplinary panel consensus. Rheumatol Int. 2015; 35: 777 - 85. doi: 10.1007/s00296-015-3231-3
458. Foeldvari I., Wierk A. Methotrexate is an effective treatment for chronic uveitis associated with juvenile idiopathic arthritis//The Journal of rheumatology. - 2005. - Т. 32. - N. 2. - С. 362 - 365.
459. Heiligenhaus A, Mingels A, Heinz C, et al. Methotrexate for Uveitis Associated with Juvenile Idiopathic Arthritis: Value and Requirement for Additional Anti-Inflammatory Medication. Eur J Ophthalmol. 2007; 17: 743 - 8. doi: 10.1177/112067210701700509
460. Oray M.,  . Treatment of juvenile idiopathic arthritis-associated uveitis//Turkish Journal of Ophthalmology. - 2016. - Т. 46. - N. 2. - С. 77.
. Treatment of juvenile idiopathic arthritis-associated uveitis//Turkish Journal of Ophthalmology. - 2016. - Т. 46. - N. 2. - С. 77.
461. Tappeiner C, Roesel M, Heinz C, et al. Limited value of cyclosporine A for the treatment of patients with uveitis associated with juvenile idiopathic arthritis. Eye Lond Engl. 2009; 23: 1192 - 8. doi: 10.1038/eye.2008.174
462. Daniel E, Thorne JE, Newcomb CW, et al. Mycophenolate mofetil for ocular inflammation. Am J Ophthalmol. 2010; 149: 423 - 432.e1 - 2. doi: 10.1016/j.ajo.2009.09.026
463. Sen E.S., Ramanan A.V. Juvenile idiopathic arthritis-associated uveitis//Clinical Immunology. - 2020. - Т. 211. - С. 108322.
464. Horton S, Jones AP, Guly CM, et al. Adalimumab in Juvenile Idiopathic Arthritis-Associated Uveitis: 5-Year Follow-up of the Bristol Participants of the SYCAMORE Trial. Am J Ophthalmol. 2019; 207: 170 - 4. doi: 10.1016/j.ajo.2019.06.007
465. Lanz S, Seidel G, Skrabl-Baumgartner A. Golimumab in juvenile idiopathic arthritis-associated uveitis unresponsive to Adalimumab. Pediatr Rheumatol. 2021; 19: 132. doi: 10.1186/s12969-021-00630-1
466. Ramanan A. V. et al. Tocilizumab in patients with anti-TNF refractory juvenile idiopathic arthritis-associated uveitis (APTITUDE): a multicentre, single-arm, phase 2 trial//The Lancet Rheumatology. - 2020. - Т. 2. - N. 3. - С. e135 - e141.
467. Babu K, Mooss V, Rao A. Tofacitinib in juvenile idiopathic arthritis-associated uveitis. Indian J Ophthalmol - Case Rep. 2022; 2: 911. doi: 10.4103/ijo.IJO_789_22
468. Chen JL, Abiri P, Tsui E. Recent advances in the treatment of juvenile idiopathic arthritis-associated uveitis. Ther Adv Ophthalmol. 2021; 13: 251584142098457. doi: 10.1177/2515841420984572
469. Thomas J, Kuthyar S, Shantha JG, et al. Update on biologic therapies for juvenile idiopathic arthritis-associated uveitis. Ann Eye Sci. 2021; 6: 19 - 19. doi: 10.21037/aes-2019-dmu-10
470. Kenawy N, Cleary G, Mewar D, et al. Abatacept: a potential therapy in refractory cases of juvenile idiopathic arthritis-associated uveitis. Graefes Arch Clin Exp Ophthalmol Albrecht Von Graefes Arch Klin Exp Ophthalmol. 2011; 249: 297 - 300. doi: 10.1007/s00417-010-1523-6
471.  AC de C, Leite CAC, Leite ACRM, et al. A longterm prospective real-life experience with leflunomide in juvenile idiopathic arthritis. J Rheumatol. 2014; 41: 338 - 44. doi: 10.3899/jrheum.130294
AC de C, Leite CAC, Leite ACRM, et al. A longterm prospective real-life experience with leflunomide in juvenile idiopathic arthritis. J Rheumatol. 2014; 41: 338 - 44. doi: 10.3899/jrheum.130294
472. Jahan A, Dewan V, Yadav TP. Leflunomide in systemic onset Juvenile idiopathic arthritis. Indian Pediatr. 2012; 49: 750 - 2. doi: 10.1007/s13312-012-0139-9
473. Oray M,  . Treatment of Juvenile Idiopathic Arthritis-Associated Uveitis. Turk J Ophthalmol. 2016; 46: 77 - 82. doi: 10.4274/tjo.09581
. Treatment of Juvenile Idiopathic Arthritis-Associated Uveitis. Turk J Ophthalmol. 2016; 46: 77 - 82. doi: 10.4274/tjo.09581
474. Doycheva D. et al. Mycophenolate mofetil in the treatment of uveitis in children//British journal of ophthalmology. - 2007. - Т. 91. - N. 2. - С. 180 - 184.
475. Baquet-Walscheid K, Heinz C, Rath T, et al. Beneficial Effect of Upadacitinib in an Adult Patient with Juvenile Idiopathic Arthritis-associated Uveitis after Unsatisfactory Response to Tofacitinib: A Case Report. Ocul Immunol Inflamm. 2022; 1 - 2. doi: 10.1080/09273948.2022.2069128
476. Tappeiner C, Miserocchi E, Bodaghi B, et al. Abatacept in the Treatment of Severe, Longstanding, and Refractory Uveitis Associated with Juvenile Idiopathic Arthritis. J Rheumatol. 2015; 42: 706 - 11. doi: 10.3899/jrheum.140410
477. Ravelli A, Davi S, Minoia F, et al. Macrophage Activation Syndrome. Hematol Oncol Clin North Am. 2015; 29: 927 - 41. doi: 10.1016/j.hoc.2015.06.010
478. Henter J-I. Treatment of hemophagocytic lymphohistiocytosis with HLH-94 immunochemotherapy and bone marrow transplantation. Blood. 2002; 100: 2367 - 73. doi: 10.1182/blood-2002-01-0172
479. La  P, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood. 2019; 133: 2465 - 77. doi: 10.1182/blood.2018894618
P, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood. 2019; 133: 2465 - 77. doi: 10.1182/blood.2018894618
480. Stephan J.L. et al. Reactive haemophagocytic syndrome in children with inflammatory disorders. A retrospective study of 24 patients//Rheumatology. - 2001. - Т. 40. - N. 11. - С. 1285 - 1292.
481. I.A. Kriulin IAK, Kriulin IA, National Medical Research Center for Children's Health, Moscow, Russian Federation, et al. Hemophagocytic lymphohistiocytosis: mechanisms of development, clinical manifestations, and treatments. Vopr Prakt Pediatr. 2021; 16: 94 - 102. doi: 10.20953/1817-7646-2021-6-94-102
482. Ramanan A.V., Schneider R. Macrophage activation syndrome following initiation of etanercept in a child with systemic onset juvenile rheumatoid arthritis//The Journal of rheumatology. - 2003. - Т. 30. - N. 2. - С. 401 - 403.
483. Bruck N. et al. Rapid and sustained remission of systemic juvenile idiopathic arthritis-associated macrophage activation syndrome through treatment with anakinra and corticosteroids//JCR: Journal of Clinical Rheumatology. - 2011. - Т. 17. - N. 1. - С. 23 - 27.
484. Zhang H, Yang S-W, Fu Y-C, et al. Cytokine storm and targeted therapy in hemophagocytic lymphohistiocytosis. Immunol Res. 2022; 70: 566 - 77. doi: 10.1007/s12026-022-09285-w
485. Криулин И.А., Алексеева Е.И., Шилькрот И.Ю., Дворяковская Т.М. Лечение вторичного гемофагоцитарного синдрома у пациентов с системным ювенильным идиопатическим артритом. Результаты когортного ретроспективного исследования. Вопросы практической педиатрии. 2022; 17(5): 7 - 19. DOI: 10.20953/1817-7646-2022-5-7-19.
486. Pelewicz K,  P. Glucocorticoid Withdrawal-An Overview on When and How to Diagnose Adrenal Insufficiency in Clinical Practice. Diagnostics. 2021; 11: 728. doi: 10.3390/diagnostics11040728
P. Glucocorticoid Withdrawal-An Overview on When and How to Diagnose Adrenal Insufficiency in Clinical Practice. Diagnostics. 2021; 11: 728. doi: 10.3390/diagnostics11040728
487. Alves C, Robazzi TCV, Mendonç a M. Withdrawal from glucocorticosteroid therapy: clinical practice recommendations. J Pediatr (Rio J). 2008; 84: 192 - 202. doi: 10.2223/JPED.1773
488. Кузьмина Н.И., Шох Б.П., Никишина И.П. Современный взгляд на системную глюкокортикостероидную терапию при ювенильном ревматоидном артрите//Научно-практическая ревматология. - 2000. - N. 2. - С. 56 - 62.
489. Mouy R. et al. Efficacy of cyclosporine A in the treatment of macrophage activation syndrome in juvenile arthritis: report of five cases//The Journal of pediatrics. - 1996. - Т. 129. - N. 5. - С. 750 - 754.
490. Georgiadou S, Gatselis NK, Stefos A, et al. Efficient management of secondary haemophagocytic lymphohistiocytosis with intravenous steroids and 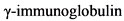 infusions. World J Clin Cases. 2019; 7: 3394 - 406. doi: 10.12998/wjcc.v7.i21.3394
infusions. World J Clin Cases. 2019; 7: 3394 - 406. doi: 10.12998/wjcc.v7.i21.3394
491. Sen E. S., Clarke S. L. N., Ramanan A. V. Macrophage activation syndrome//The Indian Journal of Pediatrics. - 2016. - Т. 83. - N. 3. - С. 248 - 253.
492.  F. et al. Comparison of baseline laboratory findings of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis and multisystem inflammatory syndrome in children//International Journal of Rheumatic Diseases. - 2021. - Т. 24. - N. 4. - С. 542 - 547.
F. et al. Comparison of baseline laboratory findings of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis and multisystem inflammatory syndrome in children//International Journal of Rheumatic Diseases. - 2021. - Т. 24. - N. 4. - С. 542 - 547.
493. Grom AA, Horne A, De Benedetti F. Macrophage activation syndrome in the era of biologic therapy. Nat Rev Rheumatol. 2016; 12: 259 - 68. doi: 10.1038/nrrheum.2015.179
494. Papa R, Natoli V, Caorsi R, et al. Successful treatment of refractory hyperferritinemic syndromes with canakinumab: a report of two cases. Pediatr Rheumatol. 2020; 18: 56. doi: 10.1186/s12969-020-00450-9
495. Bhat CS, Shetty R, Ramesh D, et al. Anakinra in Refractory Multisystem Inflammatory Syndrome in Children (MIS-C). Indian Pediatr. 2021; 58: 994 - 6. doi: 10.1007/s13312-021-2340-1
496. Kostik MM, Isupova EA, Belozerov K, et al. Standard and increased canakinumab dosing to quiet macrophage activation syndrome in children with systemic juvenile idiopathic arthritis. Front Pediatr. 2022; 10: 894846. doi: 10.3389/fped.2022.894846
497. Phadke O, Rouster-Stevens K, Giannopoulos H, et al. Intravenous administration of anakinra in children with macrophage activation syndrome. Pediatr Rheumatol. 2021; 19: 98. doi: 10.1186/s12969-021-00585-3
498. Pal P, Bathia J, Giri PP, et al. Macrophage activation syndrome in pediatrics: 10 years data from an Indian center. Int J Rheum Dis. 2020; 23: 1412 - 6. doi: 10.1111/1756-185X.13915
499. Wei A, Ma H, Li Z, et al. Short-term effectiveness of ruxolitinib in the treatment of recurrent or refractory hemophagocytic lymphohistiocytosis in children. Int J Hematol. 2020; 112: 568 - 76. doi: 10.1007/s12185-020-02936-4
500. Kostik MM, Raupov RK, Suspitsin EN, et al. The Safety and Efficacy of Tofacitinib in 24 Cases of Pediatric Rheumatic Diseases: Single Centre Experience. Front Pediatr. 2022; 10: 820586. doi: 10.3389/fped.2022.820586
501.  Conde Santa Yarelis,
Conde Santa Yarelis,  Mendoza Reynaldo, del Toro Ravelo Laydenis
Mendoza Reynaldo, del Toro Ravelo Laydenis  , Chia Proenza Daniel.
, Chia Proenza Daniel.  de
de 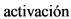 de
de 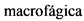 como
como 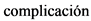 de la artritis
de la artritis 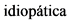 juvenil
juvenil  . Rev Cuba Reumatol [Internet]. 2021 Ago [citado 2022 Ago 02]; 23(2): e209. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1817-59962021000200011&lng=es. Epub 01-Ago-2021.
. Rev Cuba Reumatol [Internet]. 2021 Ago [citado 2022 Ago 02]; 23(2): e209. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1817-59962021000200011&lng=es. Epub 01-Ago-2021.
502. Rovin BH, Adler SG, Barratt J, et al. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021; 100: S1 - 276. doi: 10.1016/j.kint.2021.05.021
503. Rao S, Abzug MJ, Carosone-Link P, et al. Intravenous Acyclovir and Renal Dysfunction in Children: A Matched Case Control Study. J Pediatr. 2015; 166: 1462 - 1468.e4. doi: 10.1016/j.jpeds.2015.01.023
504. Kimberlin DW. Acyclovir Dosing in the Neonatal Period and Beyond. J Pediatr Infect Dis Soc. 2013; 2: 179 - 82. doi: 10.1093/jpids/pis138
505. Widasmara D, Firdausiya F. Disseminated Herpes Zoster on a Child with Systemic Lupus Erythematosus and Lupus Nephritis. Infect Drug Resist. 2021; Volume 14: 2777 - 85. doi: 10.2147/IDR.S314220
506. Balfour HH, McMonigal KA, Bean B. Acyclovir therapy of varicella-zoster virus infections in immunocompromised patients. J Antimicrob Chemother. 1983; 12: 169 - 79. doi: 10.1093/jac/12.suppl_B.169
507. Whitley RJ. Herpes simplex virus in children. Curr Treat Options Neurol. 2002; 4: 231 - 7. doi: 10.1007/s11940-002-0040-2
508. Antiviral Drugs in Children and Adolescents. Pediatr Infect Dis. 2020; 1: 123 - 8. doi: 10.5005/jp-journals-10081-1221
509. Adler SP, Marshall B. Cytomegalovirus Infections.; 11.
510. Shim GH. Treatment of congenital cytomegalovirus infection. Clin Exp Pediatr. 2023; 66: 384 - 94. doi: 10.3345/cep.2022.01032
511. Lin X, Wan Y, Liu Y. Efficacy of ganciclovir in the treatment of cytomegalovirus (CMV) infection in infants and its effect on inflammatory reaction and immune function. Am J Transl Res. 2023; 15: 6514 - 23.
512. Zhang S, Zhu Y, Jin Y, et al. Difference between Acyclovir and Ganciclovir in the Treatment of Children with Epstein-Barr Virus-Associated Infectious Mononucleosis. Evid Based Complement Alternat Med. 2021; 2021: 1 - 6. doi: 10.1155/2021/8996934
513. Chellapandian D, Das R, Zelley K, et al. Treatment of Epstein Barr virus-induced haemophagocytic lymphohistiocytosis with rituximab-containing chemo-immunotherapeutic regimens. Br J Haematol. 2013; 162: 376 - 82. doi: 10.1111/bjh.12386
514. Andrews A, Hickling P. Thrombosis associated with antiphospholipid antibody in juvenile chronic arthritis. Lupus. 1997; 6: 556 - 7. doi: 10.1177/096120339700600616
515. Thomas KN, Aggarwal A. Childhood rheumatic diseases: bites not only the joint, but also the heart. Clin Rheumatol. 2023; 42: 2703 - 15. doi: 10.1007/s10067-023-06621-9
516. Carcillo JA, Shakoory B, Castillo L. Secondary Hemophagocytic Lymphohistiocytosis, Macrophage Activation Syndrome, and Hyperferritinemic Sepsis-Induced Multiple-Organ Dysfunction Syndrome in the Pediatric ICU. In: Mastropietro CW, Valentine KM, eds. Pediatric Critical Care. Cham: Springer International Publishing 2019: 245 - 55.
517. Алексеева Е., Валиева С., Бзарова Т., Семикина Е., Исаева К., Лисицин А., Денисова Р., Чистякова Е., Слепцова Т., Митенко Е. Эффективность и безопасность отечественного рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора при нейтропениях, развивающихся на фоне анти-в клеточной и иммуносупрессивной терапии у больных ювенильным ревматоидным артритом. Вопросы современной педиатрии. 2010; 9(4): 94 - 100.
518. Yilmaz D., Ritchey A.K. Severe neutropenia in children: a single institutional experience//Journal of Pediatric Hematology/Oncology. - 2007. - Т. 29. - N. 8. - С. 513 - 518.
519. Segel, G.B., & Halterman, J.S. (2008). Neutropenia in pediatric practice. Pediatrics in review, 29(1), 12.
520. Jog NR, Young KA, Munroe ME, et al. Association of Epstein-Barr virus serological reactivation with transitioning to systemic lupus erythematosus in at-risk individuals. Ann Rheum Dis. 2019; 78: 1235 - 41. doi: 10.1136/annrheumdis-2019-215361
521. Demirkol D, Yildizdas D, Bayrakci B, et al. Hyperferritinemia in the critically ill child with secondary hemophagocytic lymphohistiocytosis/sepsis/multiple organ dysfunction syndrome/macrophage activation syndrome: what is the treatment? Crit Care. 2012; 16: R52. doi: 10.1186/cc11256
522. El-Nawawy A, El-Kinany H, Hamdy El-Sayed M, et al. Intravenous Polyclonal Immunoglobulin Administration to Sepsis Syndrome Patients: A Prospective Study in a Pediatric Intensive Care Unit. J Trop Pediatr. 2005; 51: 271 - 8. doi: 10.1093/tropej/fmi011
523. Vassilopoulos A, McCormick W, Lakhani A. Update in Hyperferritinemic Syndromes: Recognition and Management - A Scoping Review. J Brown Hosp Med. 2022; 1. doi: 10.56305/001c.37667
524. Henter J-I, Horne A, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer. 2007; 48: 124 - 31. doi: 10.1002/pbc.21039
525. Малахов О.А. и др. Эндопротезирование тазобедренного сустава у подростков, больных ювенильным ревматоидным артритом//Вестник травматологии и ортопедии им. НН Приорова. - 2012. - N. 1. - С. 48 - 52.
526. Sawhney S, Aggarwal A, Springer Malaysia Representative Office. Pediatric Rheumatology A Clinical Viewpoint. 2018.
527. Finch SL, Rosenberg AM, Vatanparast H. Vitamin D and juvenile idiopathic arthritis. Pediatr Rheumatol Online J. 2018; 16: 34. doi: 10.1186/s12969-018-0250-0
528. Yamamoto EA,  TN. Relationships Between Vitamin D, Gut Microbiome, and Systemic Autoimmunity. Front Immunol. 2020; 10: 3141. doi: 10.3389/fimmu.2019.03141
TN. Relationships Between Vitamin D, Gut Microbiome, and Systemic Autoimmunity. Front Immunol. 2020; 10: 3141. doi: 10.3389/fimmu.2019.03141
529. Takken T, Van Brussel M, Engelbert RHH, et al. Exercise therapy in juvenile idiopathic arthritis. Cochrane Database Syst Rev. Published Online First: 23 April 2008. doi: 10.1002/14651858.CD005954.pub2
530. Luttosch F, Baerwald C. Rehabilitation in der Rheumatologie. Internist. 2010; 51: 1239 - 45. doi: 10.1007/s00108-010-2626-1
531. Stucki G, Kroeling P. Physical therapy and rehabilitation in the management of rheumatic disorders. Best Pract Res Clin Rheumatol. 2000; 14: 751 - 71. doi: 10.1053/berh.2000.0111
532. Kuntze G, Nesbitt C, Whittaker JL, et al. Exercise Therapy in Juvenile Idiopathic Arthritis: A Systematic Review and Meta-Analysis. Arch Phys Med Rehabil. 2018; 99: 178 - 193.e1. doi: 10.1016/j.apmr.2017.05.030
533. Sarac DC, Bayraktar D, Ozer Kaya D, et al. The effects of inspiratory muscle training on cardiorespiratory functions in juvenile idiopathic arthritis: A randomized controlled trial. Pediatr Pulmonol. 2024; 59: 562 - 73. doi: 10.1002/ppul.26783
534. Elnaggar RK, Mahmoud WS, Abdelbasset WK, et al. Low-energy laser therapy application on knee joints as an auxiliary treatment in patients with polyarticular juvenile idiopathic arthritis: a dual-arm randomized clinical trial. Lasers Med Sci. 2021; 37: 1737 - 46. doi: 10.1007/s10103-021-03427-6
535. Azab AR, Kamel FH, Basha MA, et al. Impact of Clinical Pilates Exercise on Pain, Cardiorespiratory Fitness, Functional Ability, and Quality of Life in Children with Polyarticular Juvenile Idiopathic Arthritis. Int J Environ Res Public Health. 2022; 19: 7793. doi: 10.3390/ijerph19137793
536. Elnaggar RK, Mahmoud WS, Moawd SA, et al. Impact of core stability exercises on bone mineralization and functional capacity in children with polyarticular juvenile idiopathic arthritis: a randomized clinical trial. Clin Rheumatol. 2021; 40: 245 - 53. doi: 10.1007/s10067-020-05219-9
537. Elnaggar RK, Elfakharany MS. Aqua-Plyometric Exercises-Induced Changes in Muscle Strength, Bone Mineral Properties, and Physical Fitness in Patients With Juvenile Idiopathic Arthritis: A 12-Week, Randomized Controlled Trial. Pediatr Exerc Sci. 2023; 35: 198 - 205. doi: 10.1123/pes.2022-0044
538. Tarakci E, Arman N, Tarakci D, et al. Leap Motion Controller-based training for upper extremity rehabilitation in children and adolescents with physical disabilities: A randomized controlled trial. J Hand Ther. 2020; 33: 220 - 228.e1. doi: 10.1016/j.jht.2019.03.012
539. Eid MAM, Aly SM, El-Shamy SM. Effect of Electromyographic Biofeedback Training on Pain, Quadriceps Muscle Strength, and Functional Ability in Juvenile Rheumatoid Arthritis. Am J Phys Med Rehabil. 2016; 95: 921 - 30. doi: 10.1097/PHM.0000000000000524
540. Elnaggar RK, Elshafey MA. Effects of Combined Resistive Underwater Exercises and Interferential Current Therapy in Patients with Juvenile Idiopathic Arthritis: A Randomized Controlled Trial. Am J Phys Med Rehabil. 2016; 95: 96 - 102. doi: 10.1097/PHM.0000000000000347
541. Field T, Hernandez-Reif M, Seligmen S, et al. Juvenile Rheumatoid Arthritis: Benefits from Massage Theraphy. J Pediatr Psychol. 1997; 22: 607 - 17. doi: 10.1093/jpepsy/22.5.607
542. on behalf of PRINTO Egypt, El Miedany Y, El Gaafary M, et al. Shared decision-making aid for juvenile idiopathic arthritis: moving from informative patient education to interactive critical thinking. Clin Rheumatol. 2019; 38: 3217 - 25. doi: 10.1007/s10067-019-04687-y
543. Mulligan K, Hirani SP, Harris S, et al. The Effects of a Web-Based Tool for Parents of Children With Juvenile Idiopathic Arthritis: Randomized Controlled Trial. J Med Internet Res. 2022; 24: e29787. doi: 10.2196/29787
544. 
 N, Nahuelhual Cares P, San
N, Nahuelhual Cares P, San 
 P. Efectividad de la terapia Watsu en pacientes con artritis
P. Efectividad de la terapia Watsu en pacientes con artritis 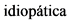 juvenil. Un ensayo
juvenil. Un ensayo  controlado paralelo, aleatorio y simple ciego. Rev Chil
controlado paralelo, aleatorio y simple ciego. Rev Chil  . 2019; 90: 282. doi: 10.32641/rchped.v90i3.886
. 2019; 90: 282. doi: 10.32641/rchped.v90i3.886
545. Beukelman T, Patkar NM, Saag KG, et al. 2011 American College of Rheumatology recommendations for the treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features. Arthritis Care Res. 2011; 63: 465 - 82. doi: 10.1002/acr.20460
546. Houghton K. Physical activity, physical fitness, and exercise therapy in children with juvenile idiopathic arthritis. Phys Sportsmed. 2012; 40: 77 - 82. doi: 10.3810/psm.2012.09.1979
547. Zuk B, Kaczor Z,  B, et al. Physiotherapy in pauciarticular juvenile idiopathic arthritis. Case study. Ortop Traumatol Rehabil. 2014; 16: 185 - 95. doi: 10.5604/15093492.1105236
B, et al. Physiotherapy in pauciarticular juvenile idiopathic arthritis. Case study. Ortop Traumatol Rehabil. 2014; 16: 185 - 95. doi: 10.5604/15093492.1105236
548. Epps H, Ginnelly L, Utley M, et al. Is hydrotherapy cost-effective? A randomised controlled trial of combined hydrotherapy programmes compared with physiotherapy land techniques in children with juvenile idiopathic arthritis. Health Technol Assess Winch Engl. 2005; 9: iii - iv, ix - x, 1 - 59. doi: 10.3310/hta9390
549. Chausset A, Pereira B, Echaubard S, et al. Access to paediatric rheumatology care in juvenile idiopathic arthritis: what do we know? A systematic review. Rheumatology. 2020; 59: 3633 - 44. doi: 10.1093/rheumatology/keaa438
550. Scott C, Chan M, Slamang W, et al. Juvenile arthritis management in less resourced countries (JAMLess): consensus recommendations from the Cradle of Humankind. Clin Rheumatol. 2019; 38: 563 - 75. doi: 10.1007/s10067-018-4304-y
551. Furer V, Rondaan C, Heijstek MW, et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis. 2020; 79: 39 - 52. doi: 10.1136/annrheumdis-2019-215882
552. Jansen MHA, Rondaan C, Legger GE, et al. EULAR/PRES recommendations for vaccination of paediatric patients with autoimmune inflammatory rheumatic diseases: update 2021. Ann Rheum Dis. 2023; 82: 35 - 47. doi: 10.1136/annrheumdis-2022-222574
553. Heijstek MW, Ott de Bruin LM, Bijl M, et al. EULAR recommendations for vaccination in paediatric patients with rheumatic diseases. Ann Rheum Dis. 2011; 70: 1704 - 12. doi: 10.1136/ard.2011.150193
554. Кокина М.Ю., Фомина Д.С., Лебедкина М.С., Мутовина З.Ю., Жолобова Е.С., Курбанова С.Х., Наргизян А.К., Фетисова А.Н., Анджель А.Е., Дворяковская Т.М., Шилькрот И.Ю., Алексеева Е.И. Эффективность и безопасность применения двухкомпонентного препарата моноклональных антител к SARS-CoV-2 (тиксагевимаб + цилгавимаб) для доконтактной профилактики новой коронавирусной инфекции у иммунокомпрометированных пациентов детского возраста с ревматическими заболеваниями. Предварительные результаты первого в Российской Федерации проспективного наблюдательного когортного исследования. Вопросы практической педиатрии. 2023; 18(1): 16 - 26
555. Alexeeva EI, Dvoryakovskaya TM, Denisova RV, et al. Immunization With a Pneumococcal Polysaccharide Vaccine in Children With Juvenile Idiopathic Arthritis Without Systemic Manifestations: a Prospective Study. Curr Pediatr. 2017; 16: 493 - 501. doi: 10.15690/vsp.v16i6.1822
556. Lomakina O, Alexeeva E, Dvoryakovskaya T, et al. OP0166 Disease activity in children with juvenile idiopathic arthritis after simultaneous pcv13 and hib vaccination: a cohort study. Ann Rheum Dis. 2021; 80: 100.2 - 100. doi: 10.1136/annrheumdis-2021-eular.3457
557. Mori S, Ueki Y, Akeda Y, et al. Pneumococcal polysaccharide vaccination in rheumatoid arthritis patients receiving tocilizumab therapy. Ann Rheum Dis. 2013; 72: 1362 - 6. doi: 10.1136/annrheumdis-2012-202658
558. Alekseeva EI, Van'kova DD, Soloshenko MA, et al. Pneumococcal Vaccine in Patients with Systemic Juvenile Idiopathic Arthritis Receiving Biologic Therapy: International Practice Review. Curr Pediatr. 2019; 18: 101 - 8. doi: 10.15690/vsp.v18i2.2012
559. Alexeeva EI, Soloshenko MA, Dvoryakovskaya TM, et al. Efficacy and Safety of Immunization With Pneumococcal Polysaccharide Vaccine in Children With Juvenile Idiopathic Arthritis: Preliminary Results of a Prospective Open-Label Study. Curr Pediatr. 2017; 16: 142 - 7. doi: 10.15690/vsp.v16i2.1715
560. Mori S, Ueki Y, Akeda Y, et al. Pneumococcal polysaccharide vaccination in rheumatoid arthritis patients receiving tocilizumab therapy. Ann Rheum Dis. 2013; 72: 1362 - 6. doi: 10.1136/annrheumdis-2012-202658
561. Garner AJ, Saatchi R, Ward O, et al. Juvenile Idiopathic Arthritis: A Review of Novel Diagnostic and Monitoring Technologies. Healthc Basel Switz. 2021; 9: 1683. doi: 10.3390/healthcare9121683
562. Novelli, V., & Holzel, H. (1999). Safety and tolerability of fluconazole in children. Antimicrobial agents and chemotherapy, 43(8), 1955 - 1960.
563. Тепаев Р.Ф. Синдром диссеминированного внутрисосудистого свертывания у детей. Диагностика и лечение. Педиатрическая Фармакология 2010; 7: 27 - 31.
564. Gurbanov A,  E, Botan E, et al. Intravenous Immunoglobulin Use in Pediatric Intensive Care: A Single-Center Experience. 2023.
E, Botan E, et al. Intravenous Immunoglobulin Use in Pediatric Intensive Care: A Single-Center Experience. 2023.
565. Baddley JW, Cantini F, Goletti D, et al. ESCMID Study Group for Infections in Compromised Hosts (ESGICH) Consensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [I]: anti-tumor necrosis 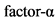 agents). Clin Microbiol Infect. 2018; 24: S10 - 20. doi: 10.1016/j.cmi.2017.12.025
agents). Clin Microbiol Infect. 2018; 24: S10 - 20. doi: 10.1016/j.cmi.2017.12.025
566. Valentine SL, Bembea MM, Muszynski JA, et al. Consensus Recommendations for RBC Transfusion Practice in Critically Ill Children From the Pediatric Critical Care Transfusion and Anemia Expertise Initiative. Pediatr Crit Care Med J Soc Crit Care Med World Fed Pediatr Intensive Crit Care Soc. 2018; 19: 884 - 98. doi: 10.1097/PCC.0000000000001613
567. Garcia-Lloret M, McGhee S, Chatila TA. Immunoglobulin Replacement Therapy in Children. Immunol Allergy Clin North Am. 2008; 28: 833 - 49. doi: 10.1016/j.iac.2008.07.001
568. Rodriguez MM, Wagner-Weiner L. Intravenous Immunoglobulin in Pediatric Rheumatology: When to Use It and What Is the Evidence. Pediatr Ann. 2017; 46. doi: 10.3928/19382359-20161214-01
569. Scientific Centre of Children's Health, Moscow, Russian Federation, Alexeeva EI, Denisova RV, et al. Intravenous Immunoglobulin in Pediatric Rheumatology Practice. Curr Pediatr Vopr Sovrem Pediatr. 2015; 14: 219 - 23. doi: 10.15690/vsp.v14i2.1290
570. Mulhearn B, Bruce IN. Indications for IVIG in rheumatic diseases. Rheumatology. 2015; 54: 383 - 91. doi: 10.1093/rheumatology/keu429
571. Prasad AN, Chaudhary S. Intravenous immunoglobulin in pediatrics: A review. Med J Armed Forces India. 2014; 70: 277 - 80. doi: 10.1016/j.mjafi.2013.05.011
572. Khojah AM, Miller ML, Klein-Gitelman MS, et al. Rituximab-associated Hypogammaglobulinemia in pediatric patients with autoimmune diseases. Pediatr Rheumatol. 2019; 17: 61. doi: 10.1186/s12969-019-0365-y
573.  Cuadros E,
Cuadros E,  J, Clemente D, et al. Correction to: Position statement of the Spanish society of pediatric rheumatology on infection screening, prophylaxis, and vaccination of pediatric patients with rheumatic diseases and immunosuppressive therapies: part 1 (screening). Eur J Pediatr. 2022; 181: 2355 - 2355. doi: 10.1007/s00431-022-04448-1
J, Clemente D, et al. Correction to: Position statement of the Spanish society of pediatric rheumatology on infection screening, prophylaxis, and vaccination of pediatric patients with rheumatic diseases and immunosuppressive therapies: part 1 (screening). Eur J Pediatr. 2022; 181: 2355 - 2355. doi: 10.1007/s00431-022-04448-1
574. Papadopoulou C, Eleftheriou D. How do I ensure safe use of biological agents in children and adolescents with rheumatic diseases? Paediatr Child Health. 2014; 24: 264 - 8. doi: 10.1016/j.paed.2013.10.004
575. Opoka-Winiarska V, Grywalska E, Sobiesiak A, et al. The Impact of Epstein-Barr Virus Infection on Juvenile Idiopathic Arthritis Activity and Patient's Response to Treatment. J Clin Med. 2020; 9: 3453. doi: 10.3390/jcm9113453
576. Consolaro A, Giancane G, Alongi A, et al. Phenotypic variability and disparities in treatment and outcomes of childhood arthritis throughout the world: an observational cohort study. Lancet Child Adolesc Health. 2019; 3: 255 - 63. doi: 10.1016/S2352-4642(19) 30027-6
577. Xu F, Lee FK, Morrow RA, et al. Seroprevalence of Herpes Simplex Virus Type 1 in Children in the United States. J Pediatr. 2007; 151: 374 - 7. doi: 10.1016/j.jpeds.2007.04.065
578. Aeschlimann FA, Chong S-L, Lyons TW, et al. Risk of Serious Infections Associated with Biologic Agents in Juvenile Idiopathic Arthritis: A Systematic Review and Meta-Analyses. J Pediatr. 2019; 204: 162 - 171.e3. doi: 10.1016/j.jpeds.2018.08.065
579. Santos MJ,  H, Conde M, et al. Portuguese recommendations for the use of biological therapies in children and adolescents with juvenile idiopathic arthritis--December 2011 update. Acta Reumatol Port. 2012; 37: 48 - 68.
H, Conde M, et al. Portuguese recommendations for the use of biological therapies in children and adolescents with juvenile idiopathic arthritis--December 2011 update. Acta Reumatol Port. 2012; 37: 48 - 68.
580.  R,
R,  HE,
HE,  M, et al. Drug reactions in children with rheumatic diseases receiving parenteral therapies: 9 years' experience of a tertiary pediatric rheumatology center. Rheumatol Int. 2020; 40: 771 - 6. doi: 10.1007/s00296-019-04498-z
M, et al. Drug reactions in children with rheumatic diseases receiving parenteral therapies: 9 years' experience of a tertiary pediatric rheumatology center. Rheumatol Int. 2020; 40: 771 - 6. doi: 10.1007/s00296-019-04498-z
581. Овсянкина Е.С, Губкина М.Ф., Панова Л.В., Юхименко Н.В. Методы скрининга туберкулезной инфекции у детей и их роль в формировании групп риска и диагностике заболевания. Российский педиатрический журнал. 2017; 20 (2): 108 - 115. DOI: http://dx.doi.org/10.18821/1560-9561-2017-20 (2): 108 - 115.
582. Allen V, Longley N. Infections in immunosuppressed travellers with autoimmune inflammatory diseases-a narrative review and advice for clinical practice. Rheumatology. 2021; 60: 3969 - 76. doi: 10.1093/rheumatology/keab445
583. Whyte LA, Al-Araji RA, McLoughlin LM. Guidelines for the management of acute gastroenteritis in children in Europe. Arch Dis Child Educ Pract Ed. 2015; 100: 308 - 12. doi: 10.1136/archdischild-2014-307253
584.  J, Roggentin P. Enterale Yersiniosen. Klinische Bedeutung, Epidemiologie, Diagnostik und
J, Roggentin P. Enterale Yersiniosen. Klinische Bedeutung, Epidemiologie, Diagnostik und  [Intestinal yersiniosis. Clinical importance, epidemiology, diagnosis, and prevention]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2004 Jul; 47(7): 685 - 91
[Intestinal yersiniosis. Clinical importance, epidemiology, diagnosis, and prevention]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2004 Jul; 47(7): 685 - 91
585. Wiger K.,  E.A., Wathne K.O. Infections in immunosuppressed children//Tidsskrift for den Norske Laegeforening: Tidsskrift for Praktisk Medicin, ny Raekke. - 2005. - Т. 125. - N. 9. - С. 1168 - 1172.
E.A., Wathne K.O. Infections in immunosuppressed children//Tidsskrift for den Norske Laegeforening: Tidsskrift for Praktisk Medicin, ny Raekke. - 2005. - Т. 125. - N. 9. - С. 1168 - 1172.
586. Acebo J.J. et al. Infections in Immunosuppressed Pediatric Patients//Pediatric Surgical Oncology. - Cham: Springer International Publishing, 2023. - С. 1 - 34.
587. Society P.I.D. et al. Guidelines for the Prevention and Treatment of Opportunistic Infections in Children with and Exposed to HIV//ClinicalInfo. HIV. gov [Internet]. - US Department of Health and Human Services, 2023.
588. Allen UD. Management of infections in the immunocompromised child: General principles. LymphoSign J. 2016; 3: 87 - 98. doi: 10.14785/lymphosign-2016-0007
589. Patrick C.C. Clinical management of infections in immunocompromised infants and children//(No Title). - 2001.
590. Kwiatkowska B, Filipowicz-Sosnowska A. Reactive arthritis. Pol Arch Intern Med. 2009; 119: 60 - 6. doi: 10.20452/pamw.606
591. Sharma AP, Norozi K, Filler G, et al. Diagnosis of Pediatric Hypertension: European Society of Hypertension-recommended 24-hr vs. 24-hr-day-night Ambulatory Blood Pressure thresholds.; 23.
592. Djawe K, Daly KR, Levin L, et al. Humoral Immune Responses to Pneumocystis jirovecii Antigens in HIV-Infected and Uninfected Young Children with Pneumocystis Pneumonia. PLoS ONE. 2013; 8: e82783. doi: 10.1371/journal.pone.0082783
593.  F-M, Trusen A, Weig M. Clinical manifestations and diagnosis of invasive aspergillosis in immunocompromised children. Eur J Pediatr. 2002; 161: 563 - 74. doi: 10.1007/s00431-002-1041-6
F-M, Trusen A, Weig M. Clinical manifestations and diagnosis of invasive aspergillosis in immunocompromised children. Eur J Pediatr. 2002; 161: 563 - 74. doi: 10.1007/s00431-002-1041-6
594. Douglas AP, Smibert Olivia C, Bajel A, et al. Consensus guidelines for the diagnosis and management of invasive aspergillosis, 2021. Intern Med J. 2021; 51: 143 - 76. doi: 10.1111/imj.15591
595. Armbrust W, Kamphuis SSM, Wolfs TWF, et al. Tuberculosis in a nine-year-old girl treated with infliximab for systemic juvenile idiopathic arthritis. Rheumatology. 2004; 43: 527 - 9. doi: 10.1093/rheumatology/keh074
596. Stern A, Green H, Paul M, et al. Prophylaxis for Pneumocystis pneumonia (PCP) in non-HIV immunocompromised patients. Cochrane Database Syst Rev. 2014; CD005590. doi: 10.1002/14651858.CD005590.pub3
597. Pneumonia in Immunocompromised Patients: Overview, Causes of Pneumonia, HIV/AIDS. Published Online First: 23 March 2020.
598. What's New Adult and Adolescent Opportunistic Infection. AIDSinfo. https://aidsinfo.nih.gov/guidelines/html/4/adult-and-adolescent-opportunistic-infection/392/whats-new (accessed 14 April 2020)
599. Aizawa-Yashiro T, Oki E, Tsuruga K, et al. Intravenous immunoglobulin therapy leading to dramatic improvement in a patient with systemic juvenile idiopathic arthritis and severe pericarditis resistant to steroid pulse therapy. Rheumatol Int. 2012; 32: 1359 - 61. doi: 10.1007/s00296-010-1413-6
600. Mofenson LM, Brady MT, Danner SP, et al. Guidelines for the Prevention and Treatment of Opportunistic Infections among HIV-exposed and HIV-infected children: recommendations from CDC, the National Institutes of Health, the HIV Medicine Association of the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the American Academy of Pediatrics. MMWR Recomm Rep Morb Mortal Wkly Rep Recomm Rep. 2009; 58: 1 - 166.
601. Islam MdA, Khandker SS, Alam SS, et al. Vitamin D status in patients with systemic lupus erythematosus (SLE): A systematic review and meta-analysis. Autoimmun Rev. 2019; 18: 102392. doi: 10.1016/j.autrev.2019.102392
602. Galindo-Zavala R, Bou-Torrent R,  B, et al. Expert panel consensus recommendations for diagnosis and treatment of secondary osteoporosis in children. Pediatr Rheumatol. 2020; 18: 20. doi: 10.1186/s12969-020-0411-9
B, et al. Expert panel consensus recommendations for diagnosis and treatment of secondary osteoporosis in children. Pediatr Rheumatol. 2020; 18: 20. doi: 10.1186/s12969-020-0411-9
603. Денисова Р., Алексеева Е., Пинелис В., Баканов М., Валиева С., Бзарова Т., Исаева К., Морев С., Кузнецова Г. Эффективность и безопасность ибандроновой кислоты для внутривенного введения при тяжелом системном остеопорозе у больных ювенильным артритом. Вопросы современной педиатрии. 2011; 10(6): 83 - 88.
604. Kutilek S, Plasilova I, Langer J. Ibandronate in the treatment of pediatric osteoporosis. Bone Abstr. Published Online First: 9 June 2015. doi: 10.1530/boneabs.4.P80
605. Bachrach LK, Ward LM. Clinical Review: Bisphosphonate Use in Childhood Osteoporosis. J Clin Endocrinol Metab. 2009; 94: 400 - 9. doi: 10.1210/jc.2008-1531
606. Ansell BM, Chamberlain MA. 11 Children with chronic arthritis: the management of transition to adulthood. Baillieres Clin Rheumatol. 1998; 12: 363 - 74. doi: 10.1016/S0950-3579(98)80023-X
607. Nascimento Leite M, Kamper SJ, O'Connell NE, et al. Physical activity and education about physical activity for chronic musculoskeletal pain in children and adolescents. Cochrane Database Syst Rev. 2023; 2023. doi: 10.1002/14651858.CD013527.pub2
608. Loctin A, Bailly F, Laroche D, et al. Clinical interest of bone marrow aspiration in rheumatology: a practice-based observational study of 257 bone marrow aspirations. Clin Rheumatol. 2013; 32: 115 - 21. doi: 10.1007/s10067-012-2097-y
609.  R,
R,  HE,
HE,  M, et al. Drug reactions in children with rheumatic diseases receiving parenteral therapies: 9 years' experience of a tertiary pediatric rheumatology center. Rheumatol Int. Published Online First: 21 December 2019. doi: 10.1007/s00296-019-04498-z
M, et al. Drug reactions in children with rheumatic diseases receiving parenteral therapies: 9 years' experience of a tertiary pediatric rheumatology center. Rheumatol Int. Published Online First: 21 December 2019. doi: 10.1007/s00296-019-04498-z
610. Aghdashi MA, Khadir M, Dinparasti-Saleh R. Antinuclear Antibodies and Lupus-like Manifestations in Rheumatoid Arthritis and Ankylosing Spondylitis Patients at 4 Months' Follow-up After Treatment with Infliximab and Etanercept. Curr Rheumatol Rev. 2020; 16: 61 - 6. doi: 10.2174/1573397115666190506152729
611. de Camargo MC, Barros BCA, Fulone I, et al. Adverse Events in Patients With Rheumatoid Arthritis and Psoriatic Arthritis Receiving Long-Term Biological Agents in a Real-Life Setting. Front Pharmacol. 2019; 10: 965. doi: 10.3389/fphar.2019.00965
612. Puxeddu I, Giori L, Rocchi V, et al. Hypersensitivity reactions during treatment with infliximab, etanercept, and adalimumab. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol. 2012; 108: 123 - 4. doi: 10.1016/j.anai.2011.11.004
613. Sen ES, Ramanan AV. Juvenile idiopathic arthritis-associated uveitis. Clin Immunol Orlando Fla. 2020; 211: 108322. doi: 10.1016/j.clim.2019.108322
614. Baricitinib in juvenile idiopathic arthritis: an international, phase 3, randomised, double-blind, placebo-controlled, withdrawal, efficacy, and safety trial Ramanan, Athimalaipet VViola, Diego et al. The Lancet, Volume 402, Issue 10401, 555 - 570
615. Decker RL, StevenErnest C II, Radtke DB, et al. A populationpharmacokinetic model using allometric scaling forbaricitinib in patients with juvenile idiopathicarthritis. CPT Pharmacometrics Syst Pharmacol.2024; 13: 970 - 981. doi: 10.1002/psp4.13131
616. Ramanan, A.V., Guly, C., Simonini, G., Keller, S., Sen, P., Holzkaemper, T., & Quartier, P. (2024). OP0101 Effectiveness and safety of baricitinib for the treatment of juvenile idiopathic arthritis associated uveitis or chronic anterior antinuclear antibody positive uveitis in children.
617. Thomas J, Kuthyar S, Shantha JG, Angeles-Han ST, Yeh S. Update on biologic therapies for juvenile idiopathic arthritis-associated uveitis. Ann Eye Sci. 2021 Jun; 6: 19. doi: 10.21037/aes-2019-dmu-10. Epub 2021 Jun 15. PMID: 34131629; PMCID: PMC8202723.
618. Алексеева, Е.И., and Т.М. Бзарова. "Ювенильный артрит: возможности медикаментозного и немедикаментозного лечения на современном этапе." Лечащий врач 9 (2011): 60 - 60.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Данные клинические рекомендации подготовлены профессиональной ассоциацией детских ревматологов, утверждены рабочей группой Ассоциации детских ревматологов.
1. Алексеева Е.И., чл.-корр. РАН, профессор, д.м.н.
2. Дворяковская Т.М., д.м.н.
3. Шилькрот И.Ю., к.м.н.
4. Костик М.М., д.м.н.
5. Никишина И.П., к.м.н.
6. Ушакова С.А., д.м.н., профессор
7. Ульянова Е.А., к.м.н.
8. Глазырина Г.А., к.м.н.
9. Жолобова Е.С., д.м.н., профессор
10. Сударева О.О., к.м.н.
11. Игишева Л.Н., д.м.н., доцент
12. Лигостаева Е.А., к.м.н.
13. Малиевский В.А., д.м.н., профессор
14. Криулин И.А., к.м.н., старший научный сотрудник
15. Криулина Т.Ю., младший научный сотрудник
16. Кокина М.Ю., младший научный сотрудник
Конфликт интересов: члены рабочей группы заявляют об отсутствии конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория
1. Врачи-педиатры
2. Врачи-ревматологи детских ревматологических отделений
3. Врачи-ревматологи детских ревматологических кабинетов детских поликлиник
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций, являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска - 5 лет.
Методы, использованные для оценки качества и силы доказательств:
- консенсус экспертов;
- оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета-анализов;
- систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
- Внешняя экспертная оценка.
- Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От детских ревматологов первичного звена получены комментарии в отношении доходчивости изложения важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались авторами рекомендаций. Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которые, оценивали доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Авторский коллектив
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Сроки проведения контроля эффективности терапии ЮА
|
N
|
МНН лекарственного средства
|
Сроки проведения контроля эффективности терапии <1>
|
|
1
|
Метотрексат**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
2
|
Лефлуномид**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
3
|
Сульфасалазин**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
4
|
Тоцилизумаб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
5
|
Канакинумаб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
6
|
Ритуксимаб**
|
Через 16 - 24 недели с момента начала лечения. Далее - каждые 6 месяцев
|
|
7
|
Адалимумаб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
8
|
Этанерцепт**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
9
|
Голимумаб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
10
|
Абатацепт**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
11
|
Секукинумаб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
12
|
Тофацитиниб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
13
|
Упадацитиниб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
|
14
|
Барицитиниб**
|
Через 3 и 6 месяцев с момента начала лечения. Далее - каждые 6 месяцев
|
--------------------------------
<1> - Коррекция терапии проводится на любом этапе лечения при ее неэффективности и/или небезопасности.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Общая схема
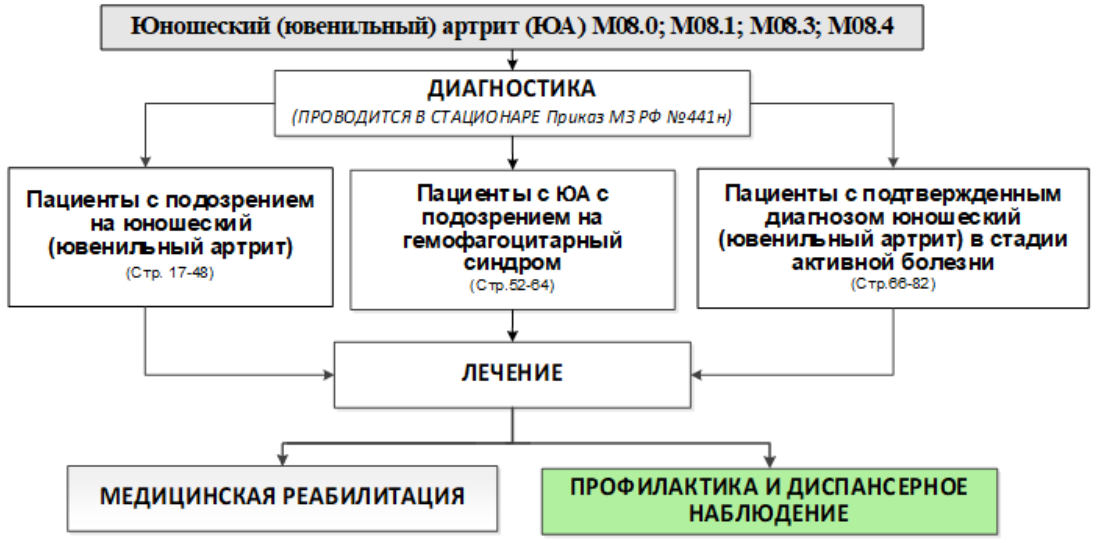
Схема 1
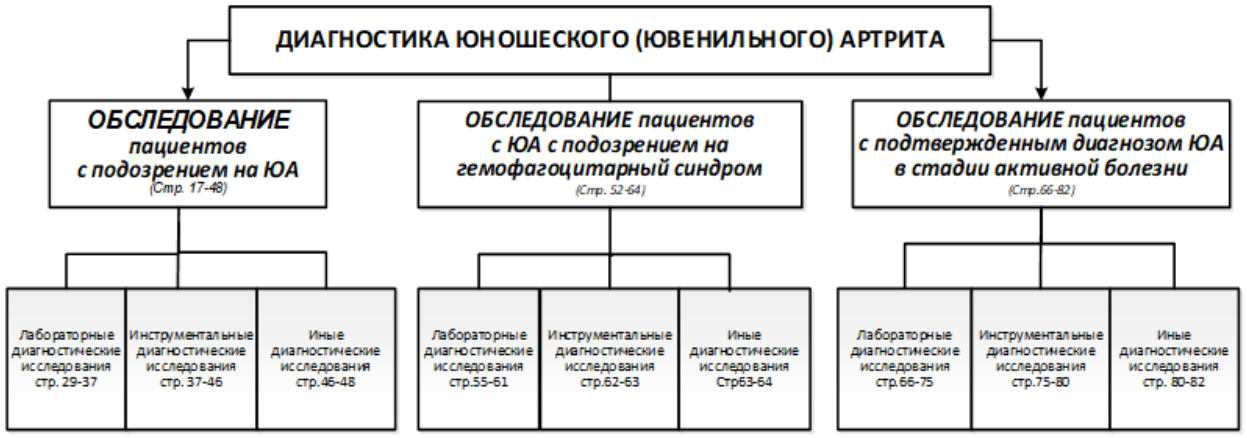
Схема 2
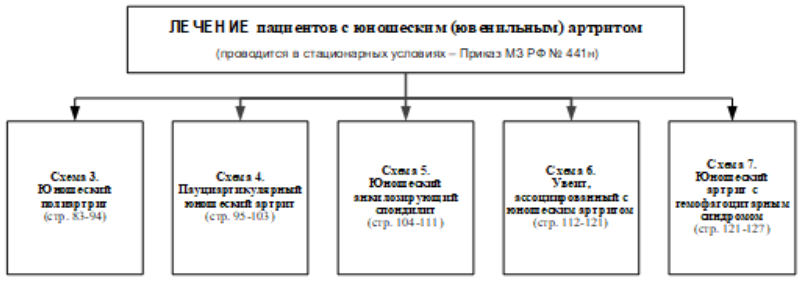
Схема 3
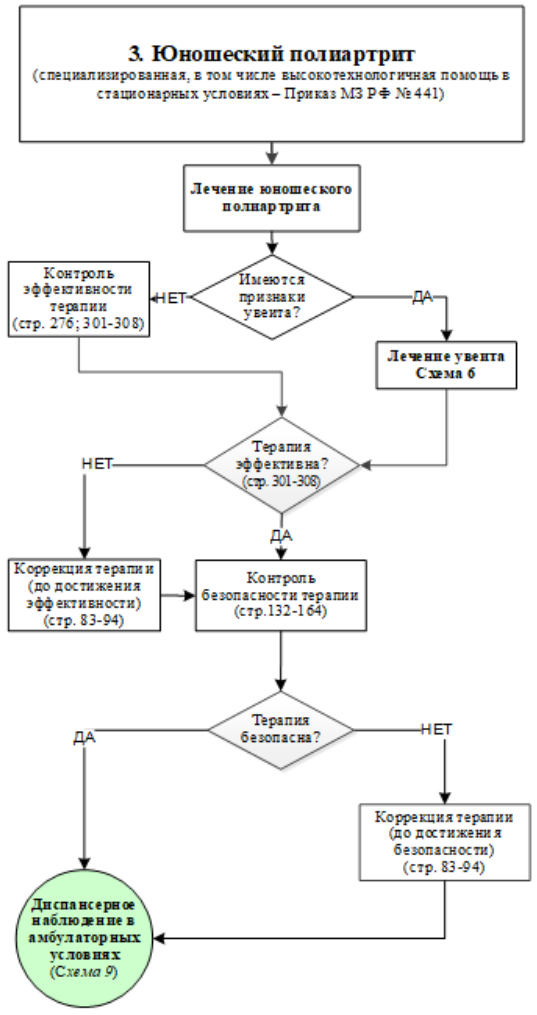
Схема 4
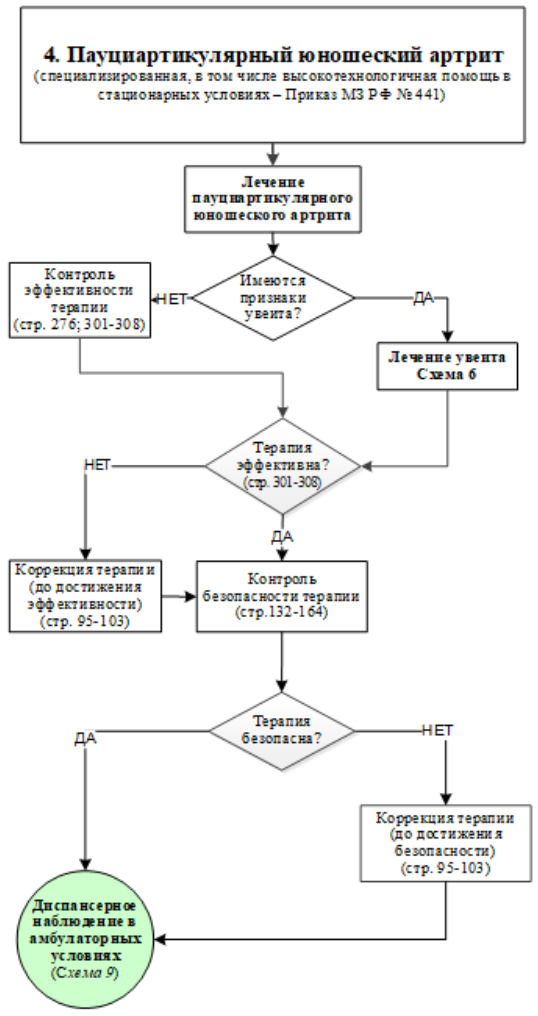
Схема 5
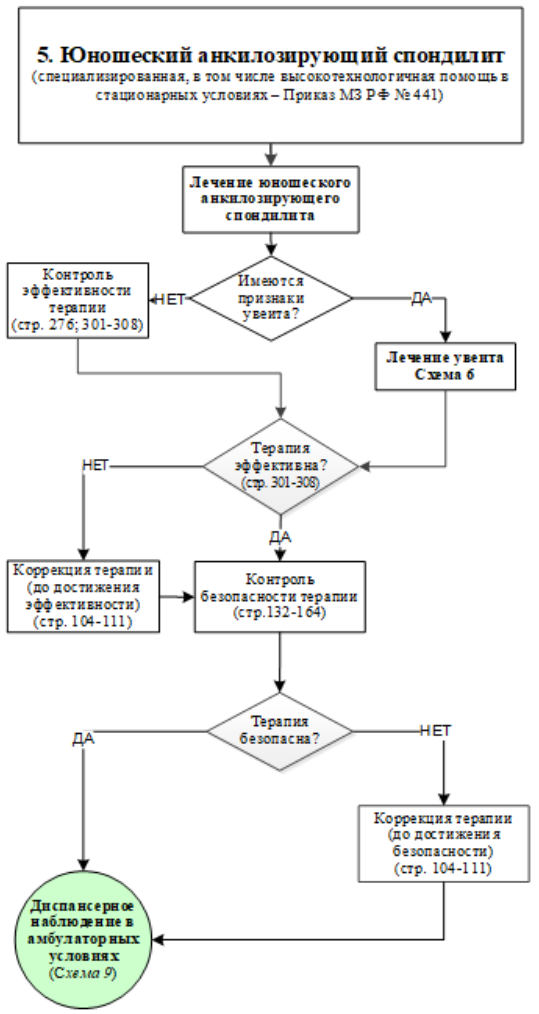
Схема 6
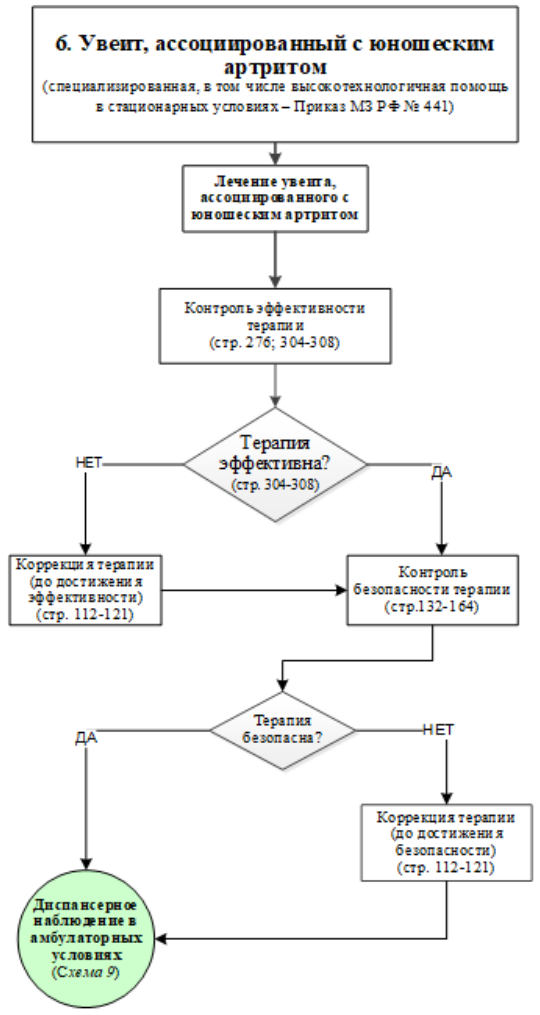
Схема 7
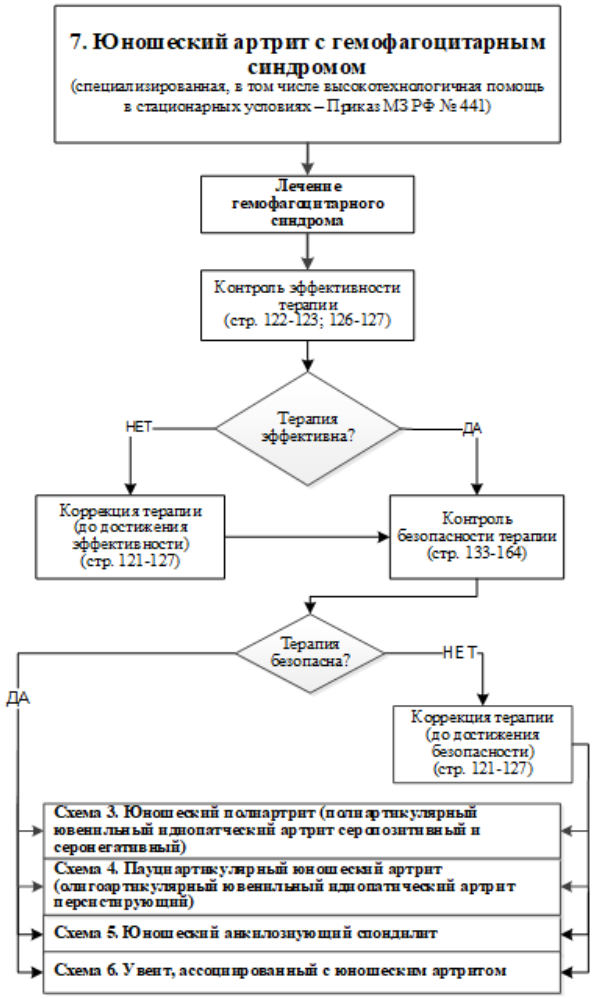
Схема 8
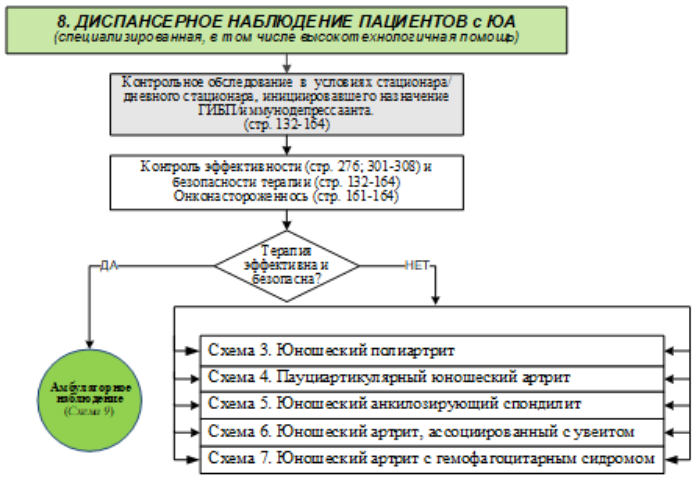
Схема 9
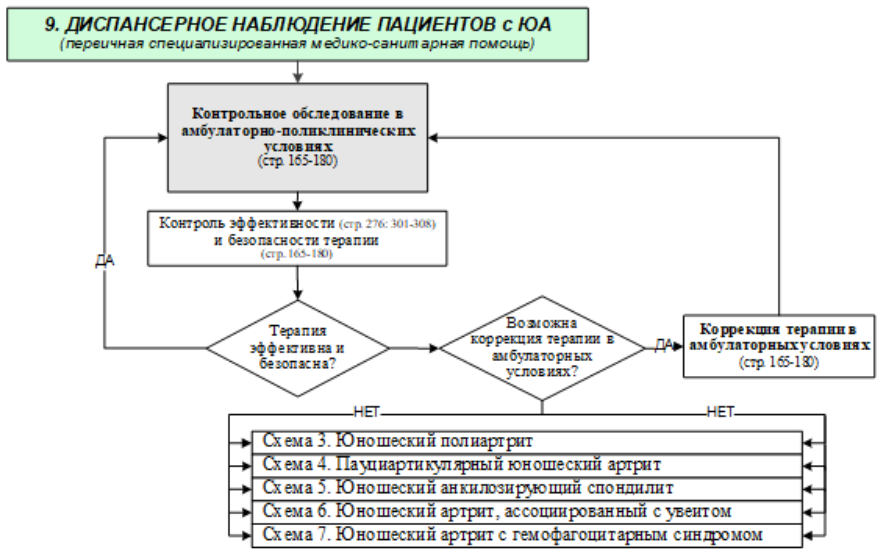
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
1. Что такое идиопатический артрит?
Что это?
Ювенильный идиопатический артрит (синонимы - ювенильный артрит, юношеский артрит) является хроническим заболеванием, которое характеризуется стойким воспалением суставов. Типичными признаками воспаления суставов являются боль, припухлость и ограничение движений. "Идиопатический" означает, что мы не знаем причину заболевания, а "ювенильный" в данном случае означает, что начало симптомов обычно происходит до 16-летнего возраста.
Что означает "хроническое заболевание"?
О заболевании говорят, что оно хроническое, когда соответствующее лечение не во всех случаях приводит к излечению, но позволяет уменьшить симптомы и улучшить лабораторные показатели. Также это означает, что после того, как диагноз установлен, невозможно предвидеть, как долго ребенок будет болеть.
Какова его частота?
ЮА - относительно редкое заболевание, которое поражает приблизительно 1 - 2 детей из каждых 1 000.
Каковы причины заболевания?
Наша иммунная система защищает нас от инфекций, вызванных различными микроорганизмами, такими как вирусы или бактерии. Она способна отличать то, что является потенциально чужеродным и вредным и подлежит уничтожению, от того, что является частью нашего организма. Предполагают, что ЮА является ненормальной реакцией нашей иммунной системы, которая частично теряет способность отличать "чужеродные" клетки от "своих", атакует собственные части тела, что приводит к воспалению, в частности, суставной выстилки. По этой причине такие заболевания, как ЮА, называют также "аутоиммунными". Это означает, что иммунная система реагирует "против собственного организма". Однако точная информация о механизмах, являющихся причиной ЮА так же, как и большинства хронических воспалительных заболеваний человека, отсутствует.
Это наследственное заболевание?
ЮА - это не наследственное заболевание, поскольку оно не может передаваться непосредственно от родителей к их детям. Тем не менее, имеется ряд генетических факторов, по большей части еще не выявленных, которые формируют предрасположенность к болезни. В научном мире достигнуто единство мнений относительно того, что это заболевание является результатом сочетания генетической предрасположенности и воздействия факторов окружающей среды (включая возбудителей инфекций). Но даже в том случае, когда может иметь место генетическая предрасположенность, два ребенка в одной семье заболевают этой болезнью очень редко.
На основании чего диагностируется это заболевание?
Диагноз ЮА основывается на присутствии и персистенции артрита, при этом проводится тщательное исключение какого-либо другого заболевания посредством изучения анамнеза болезни, результатов осмотра больного и лабораторных тестов.
Диагноз ЮА ставят, если заболевание начинается в возрасте до 16 лет, симптомы длятся более 6 недель и все другие заболевания, вызывающие артрит, исключаются.
Этот 6-недельный период обусловлен необходимостью исключить другие формы преходящего артрита, которые могут быть результатом различных инфекций. Термин ЮА включает все формы персистирующего артрита неизвестного происхождения, которые начинаются в детском возрасте. ЮА охватывает различные уже идентифицированные (см. ниже) формы артрита. Следовательно, диагноз ЮА основывается на наличии и персистенции артрита при тщательном исключении любого другого заболевания посредством изучения анамнеза болезни, результатов осмотра больного и лабораторных тестов.
Что происходит с суставами?
Синовиальная оболочка - это тонкая внутренняя оболочка суставной капсулы, которая при артрите становится гораздо толще и заполняется клетками воспалительного инфильтрата, а ее ткань воспаляется. При этом внутри сустава повышается выработка синовиальной жидкости. Это вызывает отек, боль и ограничение движений. Характерным проявлением воспаления сустава является его скованность, которая наблюдается после продолжительных периодов отдыха. Это особенно заметно в утреннее время (утренняя скованность).
Часто ребенок старается уменьшить боль, придавая суставу полусогнутое положение. Это положение называется "анталгическим". Этот термин подчеркивает, что оно направлено на уменьшение боли. В случае если это неправильное положение сохраняется в течение длительного времени (обычно более 1 месяца), это приводит к укорочению (контрактуре) мышц и сухожилий и развитию нарушения сгибания (разгибания). В случае ненадлежащего лечения воспаление сустава может привести к его повреждению. Это происходит под действием двух основных механизмов: вследствие сильного утолщения синовиальной оболочки (с формированием, так называемого, синовиального паннуса) и высвобождения различных веществ, которые провоцируют утрату суставом хрящевой и костной ткани. При рентгенологическом обследовании при этом имеет видны отверстия в кости. Это называется эрозией кости. Продолжительное пребывание в анталгическом положении вызывает мышечную атрофию, натяжение или сокращение мышц и мягких тканей, что приводит к нарушению сгибания.
2. Различные виды ЮИА
2.1. Существуют ли различные формы болезни?
Существует несколько форм ЮА. Они различаются в основном количеством пораженных суставов (олигоартикулярный или полиартикулярный ЮА), а также наличием дополнительных симптомов, таких как повышение температуры, сыпь и другие (см. следующие параграфы). Диагностика различных форм осуществляется путем наблюдения за симптомами в течение первых 6 месяцев болезни. Поэтому их также часто называют "формами начала болезни".
2.1.1 Полиартикулярный ЮА
При полиартикулярном ЮА в первые 6 месяцев болезни поражаются 5 и более суставов. У некоторых пациентов может повышаться температура. Определение уровня ревматоидного фактора (РФ) в крови позволяет различить два типа полиартикулярного ЮА: РФ негативный и РФ-позитивный. РФ-позитивный полиартикулярный ЮА: очень редко встречается у детей (менее 5% от всего числа больных ЮА). Заболевание является эквивалентом РФ позитивного ревматоидного артрита у взрослых (наиболее распространенный тип хронического артрита у взрослых). При этой форме артрит носит симметричный характер, первоначально поражаются в основном мелкие суставы рук и ног, с последующим вовлечением в процесс других суставов. Он встречается намного чаще у лиц женского пола, чем у мужского, и обычно начинается после достижения ребенком 10-летнего возраста. Это заболевание часто протекает в тяжелой форме. РФ-негативный полиартикулярный ЮА: на этот вариант приходится 15 - 20% всех случаев ЮА. Болезнь может развиться у детей любого возраста. Любой сустав может быть поражен. Как правило, воспаляются и крупные, и мелкие суставы. При обеих формах полиартикулярного ЮА лечение необходимо начинать как можно раньше, сразу после подтверждения диагноза. Считается, что раннее и адекватное лечение дает лучшие результаты. Тем не менее, на ранних стадиях заболевания ответ на лечение предсказать трудно. Он может варьировать у разных детей.
2.1.2 Пауциартикулярный ЮА (олигоартикулярный ЮИА (персистирующий или распространившийся))
Олигоартикулярный ЮИА является наиболее часто встречающимся подтипом ЮИА; на него приходится почти 50% всех случаев. Характерными признаками этой формы ЮИА является то, что в первые 6 месяцев болезнь поражает менее 5 суставов, а системные проявления отсутствуют. Болезнь поражает крупные суставы (такие, как коленные и голеностопные). Артрит, как правило, асимметричный. Иногда поражается только один сустав (моноартикулярная форма). У некоторых пациентов число пораженных суставов увеличивается после первых 6 месяцев болезни до 5 и более; это называется "распространившийся олигоартрит". Если же число пораженных суставов на протяжении всего заболевания составляет менее 5, то этот тип определяется как персистирующий олигоартрит. Олигоартрит обычно начинается в возрасте до 6 лет и наблюдается преимущественно у девочек. При своевременном и правильно подобранном лечении прогноз состояния суставов часто хороший, особенно если поражены единичные суставы. Если же в процесс вовлекаются новые суставы, и развивается полиартрит, прогноз часто варьирует в широких пределах. У значительной части больных могут развиться серьезные осложнения со стороны глаз, такие как воспаление переднего отдела глазного яблока (передний увеит), богатой сосудами оболочки, покрывающей глаз. В связи с тем, что передняя часть сосудистой оболочки глаза состоит из радужки и ресничного тела, это осложнение называется либо хроническим иридоциклитом, либо хроническим передним увеитом. При ЮИА эта патология развивается незаметно, не вызывая каких-либо явных симптомов (таких как боль или покраснение в глазном яблоке). В случае не распознавания и отсутствия лечения передний увеит прогрессирует и может привести к очень серьезным повреждениям глаза. Поэтому крайне важным является раннее распознание этого проявления. Так как глаз не краснеет, и ребенок не жалуется на ухудшение зрения, родители или лечащие врачи могут не заметить передний увеит. Факторами риска развития увеита являются ранняя манифестация ЮИА и положительный результат теста на антинуклеарный фактор (АНФ). Для детей с высоким риском развития увеита крайне важно проходить регулярные осмотры у офтальмолога с помощью специального прибора, который называется "щелевая лампа". Частота проведения обследований у офтальмолога составляет, как правило, раз в 3 месяца в течение длительного периода
2.2 Что вызывает хронический иридоциклит? Имеется ли взаимосвязь между иридоциклит и артритом?
Воспаление глаза (иридоциклит) вызвано аномальной иммунной реакцией (аутоиммунной), направленной против глаза. Однако точные механизмы этой патологии неизвестны. Это осложнение наблюдается в основном у пациентов с ранним началом ЮИА при наличии положительного результата теста на АНФ (антинуклеарный фактор). Причины, по которым развивается поражение глаз при заболевании суставов, неизвестны. Однако важно помнить, что артрит и иридоциклит могут иметь независимое друг от друга течение, поэтому периодические осмотры с помощью щелевой лампы необходимы, даже если артрит находится в состоянии ремиссии, так как воспаление глаз может рецидивировать без симптомов и даже при улучшении со стороны артрита. Течение иридоциклита характеризуется периодическими обострениями, которые также протекают независимо от обострений артрита. Обычно иридоциклит развивается после манифестации артрита или может быть выявлен одновременно с ним. Намного реже он предшествует артриту. Обычно такие ситуации являются самыми неблагоприятными: поскольку заболевание протекает бессимптомно, поздняя диагностика может привести к нарушению зрения.
3. Диагностика и лечение
Какие необходимы лабораторные анализы?
В момент постановки диагноза для более точного определения варианта ЮИА и для выявления пациентов с риском развития специфических осложнений, таких как хронический иридоциклит, проводят лабораторные, инструментальные исследования в сочетании с обследованием суставов и приемом (осмотром, консультацией) врача-офтальмолога. Определение содержания ревматоидного фактора (РФ) в крови представляет собой лабораторный тест, выявляющий аутоантитела. Положительный результат и наличие высоких концентраций РФ указывает на подтип ЮА.
Проводятся также и другие исследования: исследование скорости оседания эритроцитов в крови (СОЭ), исследование уровня С-реактивного белка в сыворотке крови (СРБ), которые определяют выраженность воспаления в целом. Однако диагноз, а также назначение лечения в гораздо большей степени основываются на клинических проявлениях, чем на лабораторных показателях. В зависимости от применяемого лечения, пациенты могут нуждаться в периодических исследованиях (таких как общий клинический анализ крови, анализ крови биохимический общетерапевтический), позволяющих выявлять побочные реакции и определять степень возможной токсичности лекарственных средств, которая может быть бессимптомной. Воспаление в суставе оценивается в основном путем клинического осмотра, иногда с применением методов визуализации, таких как ультразвуковое исследование сустава. Периодическое рентгеновское обследование или магнитно-резонансная томография суставов (один сустав) с контрастированием (МРТ) позволяют оценить состояние костной ткани и рост костей, что может явиться основанием для коррекции лечения.
Как мы можем это лечить?
Какой-либо специфической терапии ЮА не существует. Целью лечения является купирование боли, утомляемости и скованности, предотвращение разрушения суставов и костей, минимизация деформаций и улучшение подвижности суставов с сохранением роста и развития ребенка. За последние десять лет были достигнуты значительные успехи в лечении ЮА с применением лекарственных средств, известных как генно-инженерные биологические препараты. Однако у некоторых детей имеется "резистентность к лечению". Это означает, что, несмотря на лечение, активность болезни не снижается, и воспаление суставов не проходит. Существуют некоторые общие принципы планирования лечения, однако терапия должна быть индивидуальной для каждого ребенка. Очень важно участие родителей в принятии решений по лечению.
Лечение основывается, как правило, на применении препаратов, которые подавляют системное и/или суставное воспаление, и на реабилитационных процедурах, которые позволяют сохранить функцию суставов и способствуют предотвращению развития деформаций. Лечение является комплексным и требует сотрудничества ряда специалистов (врача-ревматолога, врача - травматолога-ортопеда, врача-физиотерапевта, врача-офтальмолога).
Нестероидные противовоспалительные и противоревматические препараты (НПВП) (Код АТХ M01A)
НПВП традиционно остаются основным средством лечения всех форм ЮА и других детских ревматических заболеваний. Это средства для симптоматического противовоспалительного и антипиретического (понижающего температуру) лечения; "симптоматическое" значит, что они не способны вызвать ремиссию заболевания, а лишь купируют симптомы, связанные с воспалением. Наиболее часто применяются диклофенак**, нимесулид, мелоксикам, ибупрофен**. НПВП обычно хорошо переносятся детьми: дискомфорт в области желудка, являющийся наиболее частым побочным эффектом у взрослых, у детей встречается реже. Иногда один НПВП может быть эффективен в том случае, когда другой недостаточно эффективен. Комбинирование различных НПВП не показано. Оптимальное воздействие на воспаление суставов отмечается через несколько недель после начала лечения.
Внутрисуставные инъекции глюкокортикоидов (Код АТХ H02AB)
Внутрисуставные инъекции используются в случае, когда имеется один или несколько суставов с выраженным воспалением, которое значительно ограничивает нормальное движение сустава и/или сопровождается сильной болью в суставе. В сустав вводят ГК пролонгированного (длительного) действия. В Российской Федерации предпочтение отдается #бетаметазону** - препарату, который действует длительное время (часто на протяжении многих месяцев). Его всасывание в системный кровоток является минимальным. Этот препарат применяется только как дополнительное средство для лечения ЮА. Этот препарат можно использовать много раз для лечения одного и того же сустава. Внутрисуставная инъекция может выполняться под местной анестезией или под общим наркозом (обычно в младшем возрасте), в зависимости от возраста ребенка, типа сустава и количества суставов, в которые выполняются инъекции. Как правило, рекомендуется проводить не более 3 - 4 инъекций в год в один и тот же сустав.
Препараты второй линии
Препараты второй линии показаны детям, у которых полиартрит прогрессирует, несмотря на адекватное лечение при помощи нестероидных противовоспалительных и противоревматических препаратов (НПВП) (Код АТХ M01A) и инъекций глюкокортикоидов (Код АТХ H02AB). Препараты второй линии в основном добавляются к предшествующему лечению НПВП, которое при этом обычно продолжается. Эффект большинства препаратов второй линии становится полностью очевидным только спустя несколько недель или месяцев лечения.
#Метотрексат** (Код АТХ L04AX03)
Вне всяких сомнений, среди препаратов второй линии, применяемых для лечения детей с ЮА, во всем мире предпочтение отдается #метотрексату** (Код АТХ L04AX03). В нескольких исследованиях была доказана его эффективность, а также изучен его профиль безопасности на протяжении нескольких лет применения. В медицинской литературе в настоящее время определена максимальная эффективная доза - 15 мг/м2 площади поверхности тела). Она вводится либо перорально, либо парентеральным путем (обычно путем подкожных инъекций). #Метотрексат** (Код АТХ L04AX03), применяется у детей с активным артритом в сочетании с другими препаратами, в том числе генно-инженерными биологическими препаратами (ГИБП) (Код АТХ L04AB, L01XC, L04AC). #Метотрексат** (Код АТХ L04AX03), как правило, хорошо переносится детьми. Наиболее распространенными побочными явлениями считаются непереносимость со стороны желудка и повышение уровня печеночной трансаминазы в крови. Поскольку препарат обладает потенциальной токсичностью, во время лечения необходимо периодически контролировать лабораторные показатели. В настоящее время #метотрексат** зарегистрирован для применения при ЮА во многих странах по всему миру. Рекомендуется также комбинированная терапия #метотрексатом** (Код АТХ L04AX03), с фолиевой кислотой** - витамином, который снижает риск развития побочных эффектов, особенно со стороны функции печени.
#Лефлуномид** - это альтернатива #метотрексату**, особенно для лечения детей, которые не переносят #метотрексат**. #Лефлуномид** применяют в таблетках. Этот вид терапии был изучен в исследованиях с участием больных ЮА, и его эффективность была доказана. Однако это лечение является более дорогим, чем при применении метотрексата.
Глюкокортикоиды (Код АТХ H02AB)
Глюкокортикоиды (Код АТХ H02AB) являются наиболее эффективными из доступных противовоспалительных препаратов, но их использование ограничено тем, что длительное их применение сопровождается рядом серьезных побочных явлений, в том числе остеопорозом и замедлением роста. Тем не менее, преимуществом глюкокортикоидов (Код АТХ H02AB) является то, что их можно применять для лечения системных симптомов, которые не поддаются другому лечению, при жизнеугрожающих системных осложнениях, а также как "переходное" лечение в острый период заболевания и в период ожидания появления эффекта от действия препаратов второй линии.
Генно-инженерные биологические препараты (ГИБП) (Код АТХ L04AB - ингибиторы фактора некроза опухоли альфа (фно-альфа), L01XC - моноклональные антитела, L04AC - ингибиторы интерлейкина)
В течение последних нескольких лет открылись новые перспективы применения препаратов, известных как ГИБП (Код АТХ L04AB, L01XC, L04AC). Врачи используют этот термин для обозначения производимых с помощью биологической инженерии лекарственных средств, действие которых, в отличие от #метотрексата** или других иммунодепрессантов, направлено, в первую очередь, против специфических молекул (фактора некроза опухоли (ФНО), интерлейкина 1, интерлейкина 6 или молекулы, стимулирующей T-лимфоциты). Было показано, что биологические препараты являются мощными средствами для блокирования воспалительного процесса, характерного для ЮА. В настоящее время имеется целый ряд ГИБП, и почти все они одобрены для применения при ЮА.
Ингибиторы ФНО-альфа (L04AB)
Ингибиторы ФНО-альфа (L04AB) являются препаратами, которые селективно блокируют ФНО - важный медиатор воспалительного процесса. Они используются отдельно или в сочетании с метотрексатом** и эффективны у большинства пациентов с активным артритом. Их эффект достигается достаточно быстро, и в настоящее время показано, что им присущ хороший уровень безопасности, по крайней мере в течение нескольких лет лечения. Однако для установления потенциальных долгосрочных побочных эффектов необходимо более длительное наблюдение. Ингибиторы ФНО-альфа (L04AB) наиболее широко используются для лечения ЮА. Существует несколько видов блокаторов ФНО-альфа, которые в значительной степени различаются по способу и частоте введения. Например, этанерцепт** вводят подкожно дважды или один раз в неделю, адалимумаб** - подкожно раз в 2 недели, а голимумаб** - подкожно один раз в месяц. Другие препараты этого класса все еще проходят клинические исследования (например, цертолизумаб пегол**) для применения у детей. Имеются также препараты, проходящие клинические испытания в исследованиях с участием взрослых пациентов, которые в будущем могут стать доступными для детей. Ингибиторы ФНО-альфа (L04AB) применяют по отдельности или в комбинации с метотрексатом. Как и остальные препараты второй линии, они должны применяться под строгим медицинским контролем.
Блокатор ко-стимуляции T-лимфоцитов (абатацепт** (Код АТХ L04AA24)
Абатацепт** имеет своеобразный механизм действия, направленный против некоторых белых кровяных клеток, называемых T-лимфоцитами. В настоящее время он может быть использован для лечения детей с полиартритом, у которых лечение метотрексатом** или другими ГИБП не дало эффекта.
Ингибитор интерлейкина 6 (тоцилизумаб** (Код АТХ L04AA)
Этот препарат особенно хорош для лечения сЮА. Тоцилизумаб** также зарегистрирован в Российской Федерации для лечения суставных форм ЮА. Он вводится путем внутривенных инфузий 1 раз в 4 недели. Применяется в случаях неэффективности терапии метотрексатом** или другими ГИБП.
Другие дополнительные способы лечения
Реабилитация
Реабилитация является важным компонентом лечения. Она включает соответствующие упражнения, а также, при наличии показаний, использование суставных шин для удержания суставов в удобной позе, чтобы предотвратить боль, скованность, мышечные контрактуры и деформации суставов. Реабилитация должна начинаться на ранней стадии и проводиться рутинно для улучшения или сохранения состояния суставов и мышц.
Ортопедическая хирургия
Основными показаниями для ортопедической хирургии является необходимость эндопротезирования сустава (в основном, применяется эндопротезирование тазобедренного или коленного сустава в случае его разрушения) и хирургическое высвобождение мягких тканей при стойких контрактурах.
Как насчет нетрадиционных методов лечения/дополнительной терапии?
Есть много дополнительных и альтернативных методов лечения, и это может ввести в заблуждение пациентов и их семьи. Подумайте хорошенько о рисках и преимуществах применения такой терапии, поскольку ее эффективность не доказана и может обходиться дорого как в плане времени, нагрузки на ребенка, так и в денежном выражении. Если вы хотите разобраться в возможностях дополнительных и альтернативных методов лечения, пожалуйста, обсудите эти варианты со своим детским ревматологом. Некоторые методы лечения способны взаимодействовать с обычными лекарствами. Большинство врачей не будут против альтернативных методов лечения при условии, что вы будете следовать рекомендациям врача. Очень важно не прекращать прием лекарств, прописанных врачом. Когда лекарства, такие как ГК (Код АТХ H02AB), необходимы, чтобы держать болезнь под контролем, то прекращение их приема может оказаться очень опасным, если заболевание по-прежнему находится в активной фазе. Пожалуйста, обсудите вопросы, которые вас беспокоят в отношении назначенного препарата, с врачом вашего ребенка.
Когда необходимо начинать лечение?
В настоящее время существуют международные и национальные рекомендации, которые помогут врачам и семьям выбрать лечение. Американской коллегией ревматологов (ACR, см. www.rheumatology.org) недавно выпущены Международные рекомендации, и еще одни рекомендации в настоящее время находятся на стадии подготовки Европейским обществом детских ревматологов (PRES, см. www.pres.org.uk).
Как обстоят дела с законодательством относительно применения для детей будущих перспективных методов лечения по утвержденным и неутвержденным показаниям?
15 лет назад все препараты, используемые для лечения ЮА и многих других детских заболеваний, не были должным образом изучены для применения у детей. Это означает, что врачи назначали лекарства, основываясь на личном опыте или на исследованиях, проведенных с участием взрослых пациентов. В самом деле, в прошлом проведение клинических испытаний в педиатрической ревматологии было затруднено, в основном из-за отсутствия финансирования исследований с участием детей и недостаточной заинтересованности со стороны фармацевтических компаний ввиду того, что педиатрический рынок невелик и затраты на исследования не окупаются. Ситуация резко изменилась несколько лет назад. Это было связано с принятием в США Закона об улучшении фармакотерапии в педиатрии и специфического законодательства для разработки лекарств для детей (Педиатрический регламент) в Европейском Союзе (ЕС). Эти инициативы, по сути, вынуждают фармацевтические компаний проводить исследования лекарств также и с участием детей. Инициативы США и ЕС, наряду с наличием 2 крупных сетей: Организации по проведению международных исследований в области педиатрической ревматологии (PRINTO - www.printo.it), которая объединяет более 50 стран по всему миру, и Совместной исследовательской группы по педиатрической ревматологии (PRCSG - www.prcsg.org), базирующейся в Северной Америке, - оказали очень положительное влияние на развитие педиатрической ревматологии, в частности, на разработку новых методов лечения для детей с ЮИА. Российская Федерация является активным участником практически всех клинических исследование биологических препаратов у детей. Иногда проведение исследований требует применения плацебо (таблетки или инфузии без активного вещества), чтобы убедиться, что исследуемый препарат приносит больше пользы, чем вреда. Благодаря этому важному исследованию, на сегодняшний день зарегистрированы некоторые препараты, в частности для лечения ЮА. Это означает, что регулирующие органы, такие как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), Европейское агентство по лекарственным средствам (EMA) и несколько национальных органов, пересмотрели научную информацию, поступающую в результате клинических испытаний, и позволили фармацевтическим компаниям заявить на этикетке препарата, что он является эффективным и безопасным для детей. Список лекарств, специально одобренных для лечения ЮА, включает метотрексат** (L01BA), этанерцепт** (L04AB), адалимумаб** (L04AB), голимумаб** (L04AB) абатацепт** (LO4AA24), тоцилизумаб** (L04AC), тофацитиниб** (L04AA), секукинумаб** (L04AC10). В настоящее время исследуются некоторые другие препараты для детей, так что вашему ребенку его врач может предложить участвовать в таких исследованиях. Есть другие препараты, которые формально не одобрены для применения при ЮА. Эти препараты могут применяться даже без утвержденного показания (так называемое применение по незарегистрированным показаниям), и ваш врач может предложить их применение, особенно если нет других доступных видов лечения.
Каковы основные побочные эффекты лечения?
Препараты, используемые при лечении ЮА, как правило, хорошо переносятся. Непереносимость со стороны желудка - самое частое побочное действие НПВП (Код АТХ M01A) (которые именно поэтому необходимо принимать с пищей) - у детей отмечается менее часто, чем у взрослых. НПВП (Код АТХ M01A) могут вызывать повышение уровня некоторых ферментов печени в крови, но это редкое явление при приеме препаратов. Метотрексат** (Код АТХ L04AX03) также хорошо переносится. Нередки желудочно-кишечные побочные эффекты, такие как тошнота и рвота. Для контроля потенциальной токсичности важно проверять уровень ферментов печени, делая обычные анализы крови. Наиболее частым лабораторным изменением является повышение активности ферментов печени, которое нормализуется при отмене или снижении дозы метотрексата** (Код АТХ L04AX03). Применение фолиновой или фолиевой кислоты** (B03BB) позволяет снизить частоту гепатотоксичности. Реакции гиперчувствительности на метотрексат** (Код АТХ L04AX03) встречаются редко. Длительное применение ГК (Код АТХ H02AB) в высоких дозах сопровождается рядом важных побочных эффектов. Они включают задержку роста и остеопороз. Высокие дозы ГК (Код АТХ H02AB) вызывают заметное повышение аппетита, что в свою очередь может привести к ожирению. Поэтому важно поощрять детей есть пищу, которая может удовлетворить их аппетит без увеличения потребления калорий.
ГИБП (Код АТХ L04AB, L01XC, L04AC), как правило, хорошо переносятся, по крайней мере, в первые годы лечения. Пациентов необходимо тщательно контролировать на предмет возможного возникновения инфекций или других нежелательных явлений. Тем не менее, важно понимать, что опыт применения лекарственных средств, используемых для лечения ЮА, ограничен количественно (только несколько сотен детей приняли участие в клинических испытаниях) и по времени (биологические препараты стали доступны только с 2000 года). По этим причинам в настоящее время существует несколько реестров ЮА для контроля за лечением детей биологическими препаратами на национальном (например, в Германии, Великобритании, США и др.) и международном уровне (например, Pharmachild, который является проектом, осуществляемым Организацией по проведению международных исследований в области педиатрической ревматологии (PRINTO) и Европейским обществом детских ревматологов (PRES)), целью которых является тщательный мониторинг детей с ЮА и определение возможного возникновения явлений, связанных с безопасностью в долгосрочной перспективе (через несколько лет после применения лекарственных средств). В Российской Федерации также ведется Регистр детей с системным ЮА, целью которого, является мониторинг особенностей клинической картины заболевания, качества оказания медицинской помощи, эффективности и безопасности противоревматических препаратов, в том числе биологических.
Как долго необходимо продолжать лечение?
Лечение должно продолжаться до тех пор, пока имеется болезнь. Продолжительность заболевания непредсказуема; в большинстве случаев ЮА после лечения в течение от нескольких до многих лет наступает спонтанная ремиссия. Течение ЮА часто характеризуется периодическими ремиссиями и обострениями, которые требуют серьезных изменений в лечении. Вопрос о полной отмене терапии рассматривается только после того, как артрит не проявляет себя на протяжении длительного времени (2 года и более). Однако четкая информация о возможности рецидива заболевания после прекращения применения лекарства отсутствует. Врачи обычно осуществляют наблюдение за состоянием детей, больных ЮА, пока они не станут взрослыми, даже если артрит затихает.
Обследование глаз (исследование с помощью щелевой лампы): как часто его проводить и какова продолжительность?
У пациентов из группы риска (особенно в случае положительного АНФ) обследование с применением щелевой лампы необходимо проводить как минимум раз в 3 месяца. В случае развития иридоциклита пациентов нужно обследовать чаще; частота осмотров зависит от степени тяжести поражения глаз, которая устанавливается во время обследования офтальмологом.
Риск развития иридоциклита со временем снижается; однако он может развиться и спустя много лет после начала артрита. Следовательно, целесообразно проверять глаза в течение многих лет, даже если артрит находится в стадии ремиссии.
Острый увеит, который может развиваться у пациентов с артритом и энтезитами, протекает с клиническими проявлениями (покраснение глаз, боль в глазах и дискомфорт при воздействии света - светобоязнь). При наличии таких жалоб требуется срочный прием (осмотр, консультация) врача-офтальмолога. В отличие от иридоциклита, для ранней диагностики не требуются периодические осмотры при помощи щелевой лампы.
Каков долгосрочный прогноз артрита?
Прогноз артрита с годами значительно улучшился, но по-прежнему он зависит от тяжести и клинической формы ЮА, а также от своевременности и адекватности лечения. Постоянно проводятся исследования с целью разработки новых лекарственных средств и ГИБП (Код АТХ L04AB, L01XC, L04AC), а также, чтобы сделать лечение доступным для всех детей. Прогноз артрита значительно улучшился за последние десять лет. В целом, отмечается, что примерно у 40% детей в течение 8 - 10 лет от начала заболевания необходимости в применении лекарств не возникнет, и у них не будут проявляться симптомы заболевания (ремиссия).
Наиболее высокая степень ремиссии наблюдаются при пауциартикулярном и системном вариантах заболевания.
При РФ-позитивном полиартикулярном ЮА наиболее часто отмечается прогрессирующее течение артрита, что может привести к тяжелому поражению суставов. Эта форма является детским аналогом РФ-позитивного ревматоидного артрита у взрослых.
РФ негативный полиартикулярный ЮА носит сложный характер в плане, как клинических проявлений, так и прогноза. Однако общий прогноз намного лучше, чем при РФ-позитивном полиартикулярном ЮА; деструкция суставов развивается примерно только у четверти пациентов.
Олигоартикулярный ЮА часто имеет хороший прогноз по суставам, когда болезнь ограничивается поражением единичных суставов (так называемый персистирующий олигоартрит). У пациентов, у которых заболевание протекает с постепенным вовлечением нескольких суставов (распространившийся олигоартрит), прогноз, сходный с прогнозом для пациентов с полиартикулярным РФ-негативным ЮА.
В настоящее время для больных на ранней стадии заболевания не имеется доступных достоверных клинических и лабораторных характеристик, и врачи не могут предсказать, у кого из пациентов будет наиболее неблагоприятный прогноз. Такие прогностические индикаторы могли бы представлять значительный клинический интерес, поскольку они позволили бы выделить тех пациентов, которым необходимо назначить более агрессивное лечение с самого начала заболевания. В стадии изучения находится еще ряд лабораторных маркеров, которые, как ожидается, смогут помочь определить время, когда следует прекращать лечение метотрексатом или биологическими препаратами.
А как насчет иридоциклита?
Иридоциклит, если его не лечить, может иметь очень серьезные последствия, включая такие проблемы, как помутнение хрусталиков глаз (катаракта) и слепота. Однако если лечение иридоциклита начато на ранних стадиях, эти симптомы обычно уменьшаются в ходе применения терапии, которая включает глазные капли, предназначенные для купирования воспаления и для расширения зрачков. Если симптомы не удается купировать с помощью глазных капель, может быть назначено лечение биологическими препаратами. Однако ввиду нестабильности реакции на лечение у разных детей, четкие данные, на основании которых можно было бы рекомендовать лучшее средство лечения тяжелого иридоциклита, пока отсутствуют. Следовательно, ранняя диагностика является определяющим фактором для прогноза. Катаракты могут быть также следствием длительного лечения кортикостероидами, особенно у пациентов с системным ЮА
4. Повседневная жизнь
Может ли диета повлиять на течение болезни?
Никаких доказательств того, что диета может влиять на болезнь, не существует. В целом, ребенок должен соблюдать сбалансированную, нормальную для своего возраста диету. Пациентам, принимающим ГК (Код АТХ H02AB), нужно избегать переедания, так как эти препараты повышают аппетит. Кроме того, следует избегать пищи с высоким содержанием калорий и натрия во время лечения ГК (Код АТХ H02AB), даже если их доза небольшая.
Может ли климат повлиять на течение болезни?
Доказательства того, что климат может повлиять на проявления болезни, отсутствуют. Тем не менее, смена климата, особенно выраженная инсоляция, острые респираторные, кишечные и другие инфекции, которыми дети часто болеют в жарком климате, могут спровоцировать обострение заболевания. В холодную погоду утренняя скованность может сохраняться дольше.
Что могут дать физическая нагрузка и лечебная физкультура?
Цель физической нагрузки и лечебной физкультуры - обеспечить ребенку возможность оптимально участвовать во всей повседневной деятельности и выполнять все необходимые социальные роли. Кроме того, физическая нагрузка и лечебная физкультура могут быть использованы для мотивации к активному, здоровому образу жизни. Необходимым условием для достижения этих целей являются здоровые суставы и мышцы. Физическая нагрузка и лечебная физкультура могут применяться для улучшения подвижности суставов, стабилизации суставов, повышения гибкости мышц, мышечной силы, координации и выносливости (жизнеспособности). Эти аспекты здорового опорно-двигательного аппарата позволяют ребенку успешно и безопасно участвовать в школьных и внеклассных мероприятиях, таких как активный отдых и спортивные мероприятия. Лечение и программа домашних упражнений могут быть полезными для достижения требуемого уровня силы и выносливости.
Разрешены ли занятия спортом?
Игровые виды спорта - это важный аспект повседневной жизни здорового ребенка. Одной из главных задач лечения ЮА является обеспечение детям возможности вести по возможности нормальный образ жизни и считать себя ничем не отличающимися от своих сверстников. Лучше отдавать предпочтение тем видам спорта, в которых механический стресс для суставов отсутствует или минимален, например, таким как плавание или катание на велосипеде.
Может ли ребенок регулярно посещать школу?
Крайне важно, чтобы ребенок систематически посещал школу. Ограниченная подвижность может быть проблемой для посещения школы; она может вызвать трудности при ходьбе, быстрое уставание, боль или скованность. В остром периоде болезни предпочтительнее обучение на дому. В ремиссии ребенок может посещать школу как его здоровые сверстники. Физическое воспитание и участие в спортивных мероприятиях рекомендуется с учетом ограничения в подвижности, обусловленного активностью болезни. Школа для детей столь же важна, как работа для взрослых - это место, где ребенок учится, как стать самостоятельной личностью, продуктивной и независимой. Родителям и учителям необходимо сделать все возможное, чтобы стимулировать больных детей участвовать в школьных мероприятиях в обычном порядке, чтобы они были успешными в учебе, способными общаться со сверстниками и взрослыми, чтобы быть принятыми и ценимыми друзьями.
Разрешена ли вакцинация?
Если пациент находится на лечении иммуносупрессорами (ГК (Код АТХ H02AB), метотрексат**, ГИБП (Код АТХ L04AB, L01XC, L04AC)) вакцинацию живыми ослабленными микроорганизмами проводить не рекомендуется из-за потенциального риска распространения инфекции в результате сниженной иммунной защиты. Вакцины, которые живых микроорганизмов не содержат, а содержат только патогенные белки, вводятся по индивидуальному графику, по жестким показаниям после приема (осмотра, консультации) врача-ревматолога.
Будет ли у ребенка нормальная взрослая жизнь?
Это основная цель лечения, и в большинстве случаев так и происходит. Терапия ЮА, действительно, кардинально улучшилась, и с новыми лекарственными средствами в будущем станет еще лучше. В настоящее время комбинированное использование фармакологического лечения и реабилитации дает возможность предотвратить разрушение суставов у большинства пациентов. Также следует уделять пристальное внимание психологическому воздействию болезни на ребенка и его семью. Хронические заболевания, к числу которых относится ЮА, тяжело отражаются на всей семье, и, конечно, чем серьезнее заболевание, тем труднее с ним бороться. Ребенку будет тяжело справляться со своей болезнью должным образом, если этого не делают родители. Велика привязанность родителей к своему ребенку, и чтобы упредить возможные проблемы ребенка, они его чрезмерно опекают. Положительно направленное отношение родителей, которые поддерживают ребенка и поощряют его к тому, чтобы он был, насколько это возможно, максимально самостоятельным, несмотря на болезнь, будет чрезвычайно ценной помощью ребенку для преодоления трудностей, связанных с заболеванием, позволит справляться со всем наравне со своими сверстниками и развиться в независимую, уравновешенную личность. Команда детских ревматологов в случае необходимости должна предоставлять пациентам психосоциальную поддержку. Группа поддержки семей и благотворительные организации также могут помогать семьям справляться с болезнью.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОЦЕНКА ЭФФЕКТИВНОСТИ ТЕРАПИИ
Название на русском языке: Опросный лист состояния здоровья ребенка
Оригинальное название (если есть): Childhood Health Assessment Questionnaire (CHAQ)
Источник (официальный сайт разработчиков, публикация с валидацией): Кузьмина, Н.Н., Никишина, И.П., Шайков, А.В., Руперта, Н., Шелепина, Т.А., & Салугина, С.О. (2002). Российский адаптированный вариант опросников для оценки качества жизни и состояния здоровья детей с ювенильными хроническими артритами. Научно-практическая ревматология, (1), 40 - 44.
Тип (подчеркнуть): - вопросник
Назначение: оценка степени функциональных нарушений
Содержание (шаблон):
|
Опросный лист состояния здоровья ребенка (CHAQ)
|
|||||||
|
В этой части мы хотим получить информацию о том, как болезнь Вашего ребенка влияет на его/ее приспособленность к жизни. Вы можете дать любые замечания на оборотной стороне этой страницы. Отвечая на вопросы, Вы должны отметить один ответ, который наиболее полно отражает физические возможности ребенка (среднее состояние в течение всего дня) ЗА ПОСЛЕДНЮЮ НЕДЕЛЮ. ИМЕЙТЕ В ВИДУ ТОЛЬКО ТЕ ПРОБЛЕМЫ, КОТОРЫЕ ОБУСЛОВЛЕНЫ БОЛЕЗНЬЮ. Если ребенок из-за возраста не может выполнить какую-либо из функций, применяется термин "Нельзя оценить". Например, если Ваш ребенок из-за возраста с трудом выполняет некоторые функции или не может вовсе их выполнить, но это не связано с его болезнью, используйте термин "НЕЛЬЗЯ оценить".
|
|||||||
|
Без затруднений
|
Умеренные затруднения
|
Серьезные трудности
|
НЕ может выполнить
|
Нельзя оценить
|
|||
|
1. ОДЕВАНИЕ И ТУАЛЕТ
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Одеться, включая завязывание шнурков и застегивание пуговиц?
|
 |
 |
 |
 |
 |
||
|
- Вымыть шампунем свои волосы?
|
 |
 |
 |
 |
 |
||
|
- Снять носки?
|
 |
 |
 |
 |
 |
||
|
- Подстричь ногти?
|
 |
 |
 |
 |
 |
||
|
2. ПОДЪЕМ
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Встать с низкого кресла или пола?
|
 |
 |
 |
 |
 |
||
|
- Лечь и встать с постели либо встать в детской кроватке?
|
 |
 |
 |
 |
 |
||
|
3. ЕДА
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Порезать кусок мяса?
|
 |
 |
 |
 |
 |
||
|
- Поднести ко рту чашку или стакан?
|
 |
 |
 |
 |
 |
||
|
- Открыть новую коробку с кукурузными хлопьями?
|
 |
 |
 |
 |
 |
||
|
4. ХОДЬБА
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Ходить вне дома по ровной земле?
|
 |
 |
 |
 |
 |
||
|
- Подняться на 5 ступеней?
|
 |
 |
 |
 |
 |
||
|
Укажите, какие ПРИСПОСОБЛЕНИЯ использует Ваш ребенок, выполняя указанные функции:
|
|||||||
|
- Трость
|
 |
- При одевании (пуговичный крючок, крючок для молнии, обувной рожок с длинной ручкой и т.д.)
|
 |
||||
|
- Ходилки
|
 |
- Толстый карандаш или специальные приспособления
|
 |
||||
|
- Костыли
|
 |
- Специальное или возвышенное кресло
|
 |
||||
|
- Инвалидное кресло
|
 |
- Другие (Уточните) ________________________)
|
 |
||||
|
Укажите, при каких ежедневных действиях ребенка ему требуется ИЗ-ЗА БОЛЕЗНИ дополнительная помощь других лиц:
|
|||||||
|
- Одевание и Туалет
|
 |
- Еда
|
 |
||||
|
- Подъем
|
 |
- Ходьба
|
 |
||||
|
Без затруднений
|
Умеренные затруднения
|
Серьезные трудности
|
НЕ может выполнить
|
Нельзя оценить
|
|||
|
5. ГИГИЕНА
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Вымыть и вытереть все тело?
|
 |
 |
 |
 |
 |
||
|
- Войти и выйти из ванны?
|
 |
 |
 |
 |
 |
||
|
- Сесть и встать с унитаза или горшка?
|
 |
 |
 |
 |
 |
||
|
- Чистить зубы?
|
 |
 |
 |
 |
 |
||
|
- Причесаться?
|
 |
 |
 |
 |
 |
||
|
6. ДОСТАТЬ ЧТО-ЛИБО
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Взять на уровне головы и опустить вниз тяжелую вещь (большую игру, книги)?
|
 |
 |
 |
 |
 |
||
|
- Нагнуться и поднять с пола одежду или лист бумаги?
|
 |
 |
 |
 |
 |
||
|
- Надеть свитер через голову?
|
 |
 |
 |
 |
 |
||
|
- Повернув шею, посмотреть назад?
|
 |
 |
 |
 |
 |
||
|
7. СЖАТИЕ
|
|||||||
|
Может ли Ваш ребенок:
|
 |
 |
 |
 |
 |
||
|
- Писать ручкой/карандашом?
|
 |
 |
 |
 |
 |
||
|
- Открыть дверь автомобиля?
|
 |
 |
 |
 |
 |
||
|
- Открыть ранее вскрытую банку?
|
 |
 |
 |
 |
 |
||
|
- Открыть и закрыть водопроводный кран?
|
 |
 |
 |
 |
 |
||
|
- Отворить дверь, предварительно повернув дверную ручку?
|
 |
 |
 |
 |
 |
||
|
8. ФУНКЦИИ
|
|||||||
|
Может ли Ваш ребенок:
|
|||||||
|
- Выполнить поручения вне дома, ходить в магазин?
|
 |
 |
 |
 |
 |
||
|
- Войти и выйти из машины, детской машины, школьного автобуса?
|
 |
 |
 |
 |
 |
||
|
- Ездить на велосипеде?
|
 |
 |
 |
 |
 |
||
|
- Выполнять работу по дому (мыть посуду, выносить мусор, пылесосить, работать во дворе, убирать постель и комнату)?
|
 |
 |
 |
 |
 |
||
|
- Бегать и играть?
|
 |
 |
 |
 |
 |
||
|
Укажите ПРИСПОСОБЛЕНИЯ, необходимые ребенку при выполнении следующих функций:
|
|||||||
|
- Приподнятое сидение унитаза
|
 |
- Специальная перекладина в ванной комнате
|
 |
||||
|
- Специальное сидение в ванной
|
 |
- Предметы с длинной ручкой, чтобы что-либо достать?
|
 |
||||
|
- Консервный нож (если банка уже вскрыта)
|
 |
- Предметы с длинной ручкой для мытья в ванной?
|
 |
||||
|
Укажите повседневные функции, при выполнении которых ребенок ИЗ-ЗА БОЛЕЗНИ нуждается в дополнительной помощи других лиц:
|
|||||||
|
- Гигиена
|
 |
- Сжатие и открывание предметов
|
 |
||||
|
- Для того, чтобы что-нибудь достать
|
 |
- Выполнение поручений и работа по дому
|
 |
||||
|
9. БОЛЬ: кроме того, мы хотели бы уточнить сопровождается ли болезнь Вашего ребенка болью или нет?
Если "ДА", оцените, какую боль испытывал Ваш ребенок ЗА ПОСЛЕДНЮЮ НЕДЕЛЮ?
Дайте оценку боли Вашего ребенка, отмечая ее на специальной линии
|
|||||||
|
Без боли 0 100 Очень сильная боль
|
|||||||
|
ФИНАЛЬНАЯ ОЦЕНКА: Учитывая все негативные стороны болезни, дайте общую оценку состояния здоровья Вашего ребенка, отмечая это на специальной линии:
Очень хорошее 0 ___________________________________________________________________________________
100 Очень плохое
|
|||||||
1990 Original version Singh G et al. 1999 Cross-cultural adapted version Kuzmina N, Shaikov A et al for PRINTO
Ключ (интерпретация):
Результатом является вычисленный балл (0 - 3):
- 0 - 0,13 - минимальные функциональные нарушения
- 0,14 - 0,63 - минимальным и умеренные функциональным нарушения
- 0,64 - 1,6 - умеренные функциональные нарушения
- > 1,6 - выраженная функциональная недостаточность
Пояснения: нет
Приложение Г2
ВИЗУАЛЬНАЯ АНАЛОГОВАЯ ШКАЛА (ВАШ)
Название на русском языке: Визуальная аналоговая шкала (ВАШ)
Оригинальное название (если есть): Visual Analog Scale for Pain (VAS Pain)
Источник (официальный сайт разработчиков, публикация с валидацией): Hawker G.A., Mian S., Kendzerska T., French M. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken) 2011; 63 (Suppl 11): S240 - 52
Тип (подчеркнуть): шкала оценки
Назначение: оценка степени тя<...> функциональных нарушений
Содержание (шаблон), Состояние пациента оценивается по показателю субъективной оценки самого пациента или его родителей и активности болезни, по оценке врача.
Проводятся:
а) общая оценка состояния здоровья по субъективной оценке пациента или его родителей по 100 мм ВАШ в баллах.
"0" баллов соответствует очень хорошему состоянию здоровья, "100" баллов - очень плохому состоянию здоровья. Ребенок или родитель отмечают точку на линии, соответствующую, по их мнению, состоянию здоровья. Затем с помощью линейки измеряется расстояние между выбранной точной и "0".
б) глобальная оценка активности болезни лечащим врачом по 100 мм ВАШ (баллы), где "0" - отсутствие активности, "100" - самая высокая активность болезни.
Врач отмечает точку на линии, соответствующую, по его мнению, состоянию здоровья. Затем с помощью линейки измеряется расстояние между выбранной точной и "0".
Ключ (интерпретация): Полученный результат измеряется в мм (баллах) от 0 до 100.
Пояснения: нет
Приложение Г3
КРИТЕРИИ
АКТИВНОСТИ БОЛЕЗНИ АМЕРИКАНСКОЙ КОЛЛЕГИИ РЕВМАТОЛОГОВ
(АКР, 2011)
Название на русском языке: Критерии активности болезни Американской коллегии ревматологов (АКР, 2011)
Оригинальное название (если есть): Criteria for clinical inactive disease (CID)
Источник (официальный сайт разработчиков, публикация с валидацией): Wallace C. A. et al. American College of Rheumatology provisional criteria for defining clinical inactive disease in select categories of juvenile idiopathic arthritis//Arthritis care & research. - 2011. - Т. 63. - N. 7. - С. 929 - 936.
Тип (подчеркнуть): - другое
Назначение: оценка активности заболевания
Содержание (шаблон), ключ (интерпретация):
Юношеский артрит с системным началом с активными системными проявлениями и разной степенью активности артритом:
- Низкая активность (наличие всех критериев):
- число пораженных суставов <= 4;
- СОЭ или СРБ в норме;
- оценка активности болезни врачом по ВАШ < 4 из 10 баллов;
- оценка общего состояния пациентом или родителем по ВАШ < 2 из 10 баллов.
- Средняя активность (по наличию критериев не соответствует низкой и высокой):
- наличие > 1-го критерия низкой степени и < 3-х критериев высокой активности.
- Высокая активность (наличие >= 3-х критериев):
- число пораженных суставов > 8;
- СОЭ или СРБ выше нормы в 2 раза;
- оценка активности болезни врачом по ВАШ >= 7 из 10 баллов;
- оценка общего состояния пациентом или родителем по ВАШ >= 5 из 10 баллов.
Критерии оценки эффективности противоревматической терапии у пациентов с сЮА
Эффективность терапии оценивается по педиатрическим критериям Американской коллегии ревматологов (АКРпеди) и критериям стадии неактивной болезни/ремиссии C. Wallace et al., 2011:
Для оценки эффекта по критериям АКРпеди используются следующие показатели:
- число суставов с признаками активного воспаления;
- число суставов с ограничением функции;
- СОЭ или сывороточная концентрация СРБ;
- общая оценка врачом активности болезни (с помощью 100-мм ВАШ);
- оценка пациентом или его родителем общего самочувствия (с помощью ВАШ);
- оценка функциональной способности с помощью опросника CHAQ.
Показатели улучшения АКРпеди 30, 50 и 70 определяются как улучшение, соответственно, на 30, 50 или 70% по сравнению с исходным значением не менее, чем 3 из 6 показателей при возможном ухудшении на 30% не более чем 1 показателя.
Неэффективность препарата констатируется в случае отсутствия 30% улучшения по педиатрическим критериям АКР в течение 3 мес.
Критерии стадии неактивной болезни/ремиссии (C. Wallace et al., 2011)
- отсутствие суставов с активным артритом;
- отсутствие лихорадки, сыпи, серозита, спленомегалии или генерализованной лимфаденопатии, типичных для ювенильного артрита; а не типичных?
- отсутствие активного увеита;
- нормальный показатель СОЭ и (или) СРБ;
- отсутствие активности болезни по общей оценке врача (по ВАШ);
- утренняя скованность меньше 15 минут.
Чтобы констатировать отсутствие активности болезни (неактивная фаза болезни), пациент должен удовлетворять всем перечисленным критериям.
Фармакологическая клиническая ремиссия устанавливается в случае, если болезнь находится в неактивном состоянии на фоне лекарственной терапии в течение 6 мес. подряд.
Нефармакологическая клиническая ремиссия устанавливается в случае, если болезнь находится в неактивном состоянии в течение 12 месяцев подряд без противоревматических препаратов.
Показатель "Продолжительность ремиссии" выражается в месяцах, прошедших с момента наступления неактивной фазы болезни.
Пояснения: нет
Приложение Г4
ИНДЕКС
АКТИВНОСТИ БОЛЕЗНИ В 71 СУСТАВЕ JUVENILE ARTHRITIS
DISEASE ACTIVITY SCORE (JADAS71)
Название на русском языке: Индекс активности болезни в 71 суставе Juvenile Arthritis Оригинальное название (если есть): Juvenile Arthritis Disease Activity Score (JADAS71)
Источник (официальный сайт разработчиков, публикация с валидацией): Consolaro A. et al. Development and validation of a composite disease activity score for juvenile idiopathic arthritis//Arthritis Care & Research: Official Journal of the American College of Rheumatology. - 2009. - Т. 61. - N. 5. - С. 658 - 666.
Тип (подчеркнуть): - индекс
Назначение: оценка активности заболевания
Содержание (шаблон): число суставов с активным артритом;
- оценка активности болезни врачом по 100 мм ВАШ; 0 - минимальная активность, 10 см - максимальная активность, см приравнивали баллам;
- оценка состояния здоровья родителем/пациентом по 100 мм ВАШ; 0 - очень хорошее состояние, 10 см - очень плохое состояние, см приравнивали баллам;
- скорость оседания эритроцитов. Для формирования шкалы от 0 до 10 использовали формулу: (СОЭ - 20)/10. Значение менее 20 мм/ч оценивается как 0, а более 120 мм/ч - 10.
Ключ (интерпретация):
Итоговый индекс JADAS71 рассчитывается как сумма всех показателей (0 - 101).
Стадии неактивной болезни соответствует индекс JADAS71 < 1 балла.
Пояснения: нет