МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РЕДКИЕ КОАГУЛОПАТИИ: НАСЛЕДСТВЕННЫЙ ДЕФИЦИТ ФАКТОРОВ
СВЕРТЫВАНИЯ КРОВИ II, VII, X
МКБ 10: D68.2
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: КР149
URL
Профессиональные ассоциации
- Национальное гематологическое общество Национальное общество детских гематологов и онкологов
Ключевые слова
- антиингибиторный коагулянтный комплекс
- геморрагический синдром
- гемостатические препараты
- дефицит факторов свертывания крови
- коагулопатия
- концентрат протромбинового комплекса
- концентраты факторов свертывания крови
- плазменный гемостаз
- препараты шунтирующего действия
- редкие нарушения свертывания крови
- свертывание крови
- спонтанные кровотечения
- укорочение протромбинового индекса
- фактор свертывания крови II
- фактор свертывания крови VII
- фактор свертывания крови X
- эптаког альфа (активированный)
Список сокращений
АЧТВ - активированное частичное тромбопластиновое время
АИКК - антиингибиторный коагулянтный комплекс
ВК - время кровотечения
ЖКТ - желудочно-кишечный тракт
КПК - концентрат протромбинового комплекса
НПВП - нестероидные противовоспалительные препараты
ПВ - протромбиновое время
РНСК - редкие нарушения свертывания крови
СЗП - свежезамороженная плазма
ТФ - тканевой фактор
ТВ - тромбиновое время
ЦНС - центральная нервная система
FII - фактор свертывания крови II
FVII - фактор свертывания крови VII
FVIII - фактор свертывания крови VIII
FIX - фактор свертывания крови IX
FX - фактор свертывания крови X
ISTH - Международное Общество по Тромбозу и Гемостазу
rFVIIa - рекомбинантный фактор свертывания крови VII активированный
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
Термины и определения
Болезнь Стюарта-Прауэра - дефицит фактора свертывания крови X.
Гемартроз - кровоизлияние в полость сустава.
Гематома - ограниченное скопление крови при закрытых и открытых повреждениях органов и тканей с разрывом сосудов, в результате чего образуется полость, содержащая жидкую или свернувшуюся кровь.
Гематурия - наличие эритроцитов в моче сверх физиологических норм.
Гемостатическая терапия - терапия, направленная на остановку кровотечения.
Гипопроконвертинемия - дефицит фактора свертывания крови VII.
Гипопротромбинемия - дефицит фактора свертывания крови II.
Диспротромбинемия - функциональная недостаточность фактора свертывания крови II.
Коагулограмма - исследование свертывающей системы крови.
Коагулопатия - нарушение в свертывающей системе крови.
Фактор свертывания крови - белок, содержащийся в плазме крови и тромбоцитах, участвующий в свертывании крови.
1. Краткая информация
1.1 Определение
Наследственный дефицит фактора свертывания крови II (гипопротромбинемия) - геморрагическое заболевание, характеризующееся снижением активности протромбина в плазме, возникающим вследствие генетических дефектов, обусловливающих количественные (гипопротромбинемия) или качественные (диспротромбинемия) нарушения фактора свертывания крови II (FII).
Наследственный дефицит фактора свертывания крови VII (гипопроконвертинемия) - геморрагическое заболевание, возникающее вследствие генетически обусловленного снижения активности фактора свертывания крови VII (FVII) в плазме.
Наследственный дефицит фактора свертывания крови X - геморрагическое заболевание, возникающее вследствие генетически обусловленного количественного или качественного дефекта FX, приводящего к снижению активности FX в плазме [6].
1.2 Этиология и патогенез
К редким нарушениям свертывания крови (РНСК) относят моногенные коагулопатии, вызванные дефицитом плазменных белков, участвующих в гемостазе, не относящиеся к болезни Виллебранда и гемофилии A или B. РНСК включают наследственные дефициты или аномалии фибриногена, протромбина (фактора II), факторов свертывания крови V, VII, X, XI, XII, XIII. Все эти нарушения в подавляющем большинстве случаев приводят к нарушениям формирования фибрина [38].
Причинами развития РНСК являются, как правило, рецессивное наследование уникального нарушения или редких нуклеотидных изменений в генах, кодирующих коагуляционные факторы, или в белках, необходимых для посттрансляционных модификаций данных факторов. РНСК наиболее распространены в этнических группах, в которых приняты близкородственные браки, вследствие большей вероятности гомозиготного носительства дефекта гена.
Опубликованные описания РНСК до недавнего времени исторически состояли из исследований случай-контроль или малочисленных когортных исследований. Однако, в течение последних 10 лет появилось несколько специфических регистров (European Network of Rare Bleeding Disorders, Peyvandi et al, 2012; the North American Rare Bleeding Registry, Acharya et al, 2004; RCD-Registries: Herrmann et al, 2006, 2009; Ivaskevicius et al, 2007; Bernardi et al, 2009), позволивших улучшить понимание РНСК. Создание международной базы РНСК способствовало определению четких лабораторных критериев тяжести большинства РНСК, которые были разработаны под эгидой Международного Общества по Тромбозу и Гемостазу (ISTH) в 2012 году.
Наследственный дефицит фактора свертывания крови II (протромбина) - аутосомно-рецессивное заболевание. Характеристика: FII - гликопротеид, образуется в печени в присутствии витамина K. Под влиянием активированного фактора свертывания крови X (FXa) в инициирующей фазе коагуляционного каскада и протромбиназного комплекса (фаза амплификации) переходит в тромбин. Тромбин, в свою очередь, активирует другие плазменные белки свертывания крови и тромбоциты с конечным формированием фибринового сгустка. Кроме того, тромбин участвует в активации ингибиторов свертывания крови и в регуляции фибринолиза.
Дефицит FII обусловлен вариациями в F2 гене, который кодирует протромбин. Не существует прямой корреляции между F2 генотипом и фенотипом заболевания. Гемостатически достаточный уровень FII составляет около 40%. Период полувыведения FII - около 60 часов.
Наследственный дефицит фактора свертывания крови VII - аутосомно-рецессивное заболевание. Физиологическая роль FVII заключается в инициации процесса свертывания крови в зоне повреждения сосудистой стенки. В комплексе с тканевым фактором (ТФ), FVIIa активирует FX и FIX, участвующих в генерации тромбина.
Период полувыведения FVII составляет 4 - 6 часов. Достаточный гемостатический уровень - не менее 10%. При тяжелых травмах клинически значимое кровотечение может развиться при активности FVII более 20%.
Наследственный дефицит фактора свертывания крови X - аутосомно-рецессивное заболевание. Активация FX происходит в инициирующей фазе свертывания крови при участии комплекса ТФ-FVIIa и в фазе амплификации с теназным комплексом. Активированный FX (FXa) и его кофактор, фактор свертывания крови V (FV), входят в состав протромбиназного комплекса, который активирует протромбин.
Период полувыведения FX составляет 30 - 50 часов. Достаточный гемостатический уровень: кровотечения не наблюдаются у лиц с активностью FX > 40% [11].
1.3 Эпидемиология
Распространенность наследственного дефицита фактора свертывания крови II (протромбина) в большинстве стран составляет 1:2 000 000 населения.
Распространенность гипопроконвертинемии - 1:300 000 - 500 000 населения.
Средняя распространенность спорадических форм наследственного дефицита фактора свертывания крови X составляет 1:1 000 000 населения [6].
1.4 Кодирование по МКБ 10
D68.2 - наследственный дефицит других факторов свертывания крови
1.5 Классификация
Существует 3 формы тяжести РНСК в зависимости от активности FII, FVII, FX, определяемой лабораторно (табл. 1) [39].
Таблица 1. Формы РНСК по степени тяжести
|
Фактор свертывания крови
|
Форма заболевания (по активности факторов свертывания крови, %)
|
||
|
тяжелая
|
средней тяжести
|
легкая
|
|
|
FII
|
не определяется
|
<= 10%
|
> 10%
|
|
FVII
|
< 10%
|
10 - 20%
|
> 20%
|
|
FX
|
< 10%
|
10 - 40%
|
> 40%
|
Тяжелый дефицит факторов, как правило, связан с развитием тяжелых спонтанных кровотечений/кровоизлияний.
Умеренный дефицит факторов проявляется в виде легких/умеренных спонтанных и посттравматических эпизодов кровотечений.
Легкие формы дефицита факторов в большинстве случаев протекают бессимптомно.
1.6 Клиническая картина
Типичными для РНСК являются кровотечения/кровоизлияния, возникающие спонтанно или вследствие травмы. Геморрагический синдром представлен кровотечениями из слизистых (носовые, десневые, луночковые), экхимозами, гематомами мягких тканей различной локализации, кровотечениями во время и после хирургических вмешательств, меноррагиями, гематуриями, реже - кровоизлияниями в суставы (гемартрозами). Кроме того, при значительных дефицитах факторов у пациентов отмечаются жизнеугрожающие кровотечения, к которым относятся [1, 4, 11]:
- кровотечения/кровоизлияния в ЦНС;
- кровотечения/кровоизлияния в ЖКТ;
- кровотечения/кровоизлияния в шею/горло;
- забрюшинная гематома.
При гипопротромбинемии с активностью FII < 10%, как правило, отмечаются более тяжелые кровотечения по сравнению с кровотечениями, возникающими при активности FII >= 10%. В последнем случае наиболее типичны легкие и умеренные кровотечения из слизистых оболочек. Пациенты с активностью FII менее 4% не описаны.
Для диспротромбинемии характерна слабая взаимосвязь между клиническим и лабораторным фенотипами заболевания. У гетерозиготных носителей дефицита FII в большинстве случаев определяется активность FII в пределах 40 - 75% с асимптомным течением заболевания.
При гипопроконвертинемии приблизительно в 60% случаев течение заболевания бессимптомное, и поводом для диагностики является случайное обнаружение увеличения ПВ. Кровоизлияния в ЦНС регистрируются у 3 - 10% пациентов с дефицитом FVII.
Тяжелые кровотечения наиболее характерны при активности FVII <= 1%. У пациентов с активностью FVII > 1% отмечаются, как правило, умеренные и легкие кровотечения из слизистых оболочек или бессимптомное течение заболевания. Однако в ряде случаев регистрируются тяжелые проявления геморрагического синдрома у лиц с активностью FVII > 20%, что говорит об отсутствии прямой корреляции между клиническим и лабораторным фенотипом заболевания.
У гетерозиготных носителей дефицита FVII в большинстве случаев определяется активность FVII в пределах 40 - 60% с бессимптомным течением заболевания.
При дефиците FX тяжелые кровотечения наиболее характерны для пациентов с активностью FX <= 10%. У пациентов с активностью FX > 10%, как правило, отмечаются умеренные и легкие кровотечения из слизистых оболочек, кровотечения после хирургических вмешательств или бессимптомное течение заболевания. Кровоизлияния в ЦНС, кровотечения из слизистых ЖКТ, гемартрозы отмечаются у пациентов с активностью FX <= 2%. Тем не менее, в ряде случаев регистрируются тяжелые проявления геморрагического синдрома у лиц с активностью FX 0,1 - 39%, указывая, таким образом, на отсутствие прямой корреляции между клиническим и лабораторным фенотипом заболевания.
У гетерозиготных носителей дефицита FX в большинстве случаев активность FX составляет около 50%, заболевание имеет бессимптомное течение [11].
2. Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
2.1 Жалобы и анамнез
Диагностика РНСК начинается с выявления клиники геморрагического состояния, либо (при отсутствии признаков избыточной кровоточивости) выяснения наличия семейного анамнеза нарушений свертывания крови.
- Рекомендуется для верификации диагноза при сборе анамнеза и жалоб, семейного анамнеза выяснять наличие проявлений геморрагического синдрома: жалоб на легко появляющиеся экхимозы и гематомы в раннем детстве; возникновение спонтанных кровотечений (в том числе гематом различных локализаций); длительных кровотечений после травм или хирургического вмешательства [3, 4, 11, 16].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: Примерно у 2/3 пациентов нет указаний на геморрагические проявления у близких родственников. Данные личного анамнеза могут содержать информацию о геморрагических проявлениях у пациента. При сборе анамнеза заболевания необходимо обращать внимание на наличие геморрагических проявлений в неонатальном периоде в виде кефалогематом, внутричерепных кровоизлияний, кровоточивости и длительном заживлении пупочной ранки; у грудных детей - экхимозов, не связанных со значимой травмой, гематом мягких тканей после незначительных ушибов или спонтанных. Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и/или множественные гематомы, системность геморрагических проявлений (проявления различной локализации). У лиц, с незначительными дефицитами факторов свертывания крови кровотечения могут отсутствовать до первой травмы или хирургического вмешательства. Сбор жалоб и анамнеза позволит определить объем обследования пациента.
2.2 Физикальное обследование
- Рекомендуется у всех пациентов обращать внимание на наличие кожного геморрагического синдрома различной выраженности в виде множественных экхимозов и гематом при значительном снижении активности факторов свертывания крови. Физикальное обследование позволяет определить тяжесть состояния пациента и необходимость проведения гемостатической терапии [6, 11].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: выявление признаков поражения суставов - маловероятно.
2.3 Лабораторная диагностика
Для диагностики РНСК проводятся поэтапные лабораторные исследования - коагулологический скрининг, определение активности факторов и молекулярно-генетическая диагностика [1, 2, 3, 16, 21]. Получение максимального количества данных способствует верификации диагноза и исключению приобретенных дефицитов факторов свертывания крови II, VII, X, а также исключению дефицитов других факторов свертывания крови.
- Рекомендуется при подозрении на геморрагические состояния первым этапом проведение коагулологического скрининга у всех пациентов, который включает определение активированного частичного тромбопластинового времени (АЧТВ), протромбинового времени (ПВ), тромбинового времени (ТВ), концентрации фибриногена (по Клауссу), времени кровотечения (ВК) стандартизованным методом и подсчет количества тромбоцитов по Фонио [1, 14, 16, 18, 23, 24, 30].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Показатели скрининговых тестов для дефицита FII, FVII, FX представлены в таблице 2.
Таблица 2. Скрининговые коагулологические тесты для диагностики РНСК
|
Параметры коагулограммы
|
Дефицит FII
|
Дефицит FVII
|
Дефицит FX
|
|
АЧТВ
|
Увеличение
|
Норма
|
Увеличение
|
|
ПВ
|
Увеличение
|
Увеличение
|
Увеличение
|
|
ТВ
|
Норма
|
Норма
|
Норма
|
|
Уровень фибриногена
|
Норма
|
Норма
|
Норма
|
- Рекомендуется всем пациентам вторым этапом диагностики с целью выявления дефектного звена гемостаза выполнять тест коррекции, определение активности факторов II, V, VII, IX, X, VIII, тест на волчаночный антикоагулянт. При удлинении ВК - анализ функции тромбоцитов и активности фактора Виллебранда [1, 14, 16, 18, 23, 24, 30, 31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Диагноз РНСК считается установленным при выявлении изолированного снижения активности соответствующих факторов - FII, FVII или FX.
- Рекомендуется определять протромбиновое время пациентам с геморрагическим синдромом в анамнезе. При любом удлинении ПВ должны быть исключены все виды приобретенного дефицита факторов протромбинового комплекса, в первую очередь обусловленные тяжелой патологией печени, механической желтухой, токсическим действием антикоагулянтов непрямого действия, эндогенным K-гиповитаминозом [16, 18, 19, 22, 24, 32, 41].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: следует иметь в виду возможность наличия приобретенного дефицита FII при антифосфолипидном синдроме с выработкой антител к протромбину и другим белкам в крови, который отличается от наследственного дефицита FII по клиническому течению и присутствию антифосфолипидных антител, при болезнях печени и желчевыводящих путей, при дефиците витамина K, а также при приеме антагонистов витамина K. Изолированный приобретенный дефицит FVII, как правило, обусловлен иммунными нарушениями, может наблюдаться при системном амилоидозе и нефротическом синдроме. Приобретенный дефицит FX может встречаться в 9 - 14% случаев при системном амилоидозе, после тяжелых инфекций, у онкологических пациентов.
- Рекомендуется проведение молекулярно-генетической диагностики нарушений FII, FVII, FX при выявлении снижения их активности в плазме пациента с целью подтверждения врожденной коагулопатии [10, 16, 26, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: для исключения приобретенных дефицитов FII, FVII, FX.
2.4 Инструментальная диагностика
- Рекомендуется проведение инструментальной диагностики у пациентов с наследственным дефицитом FII, FVII или FX для уточнения диагноза и проведения дифференциальной диагностики с другими заболеваниями с возможным наличием геморрагического синдрома [16, 18, 19, 20, 23, 27, 30, 38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: По показаниям проводится:
- эзофагогастродуоденоскопия,
- ультразвуковое исследование сустава,
- ультразвуковое исследование органов брюшной полости,
- ультразвуковое исследование мочевыводящих путей,
- ультразвуковое исследование органов малого таза,
- ультразвуковое исследование забрюшинного пространства,
- магнитно-резонансная томография сустава, мягких тканей,
- магнитно-резонансная томография головного мозга,
- рентгенография сустава,
- компьютерная томография органов грудной клетки,
- компьютерная томография головного мозга,
- риноскопия эндоскопическая,
- ректороманоскопия,
- кольпоскопия,
- гистероскопия,
- колоноскопия.
Комментарии: исследования позволяют визуализировать кровотечения/кровоизлияния различных локализаций, а также выявить осложнения, развившиеся вследствие геморрагических проявлений.
2.5 Консультации специалистов
- Рекомендуются консультации врачей-специалистов пациентам с выявленным дефицитом FII, FVII или FX для подтверждения наличия геморрагических проявлений (или их последствий) [16, 38]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: По показаниям возможны консультации:
- травматолога-ортопеда
- хирурга
- уролога
- невролога
- оториноларинголога
- стоматолога
- гинеколога
Комментарии: позволяют определить нарушения различных органов и систем вследствие состоявшегося (перенесенного ранее) кровотечения/кровоизлияния.
2.6 Дополнительные исследования
- Рекомендуется пациентам с РНСК в случае невозможности проведения полноценного двухэтапного коагулологического исследования, а также в некоторых случаях для контроля за проводимой терапией выполнять интегральные тесты оценки гемостаза: тромбодинамика, тромбоэластография, тест генерации тромбина. [3, 5, 22, 42].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: с целью выявления и мониторинга нарушений в свертывающей системе крови.
2.7 Критерии установления диагноза РНСК:
- Рекомендуется при установке диагноза РНСК использовать следующие критерии, независимо от наличия геморрагического синдрома в персональном или семейном анамнезе [10, 11, 16, 21, 26, 32, 39]:
1. отсутствие данных о наличии приобретенного дефицита факторов свертывания крови;
2. снижение активности FII/FVII/FX ниже референсных значений;
3. наличие мутаций генов FII, FVII, FX.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Диагноз наследственного РНСК устанавливается при наличии не менее двух из трех вышеперечисленных критериев.
3. Лечение
3.1 Консервативное лечение
- Рекомендуется при наследственном дефиците FII проведение специфической заместительной терапии неактивированными препаратами, содержащими FII. Строго рекомендуется использование плазматических очищенных вирус-инактивированных концентратов протромбинового комплекса (КПК) - факторы свертывания крови II, VII, IX и X в комбинации [протромбиновый комплекс]** и факторы свертывания крови II, IX и X в комбинации** [6, 11, 16, 27, 30].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: КПК вводятся внутривенно. Используется болюсная инфузия со скоростью, рекомендованной производителем. Активность КПК, обычно, указывается по активности содержащегося в них фактора свертывания крови IX (FIX). Поэтому, необходимо отдельно уточнять содержание FII, которое указывается в инструкции. Как правило, КПК содержат приблизительно равное количество FIX и при расчете дозы и схемы заместительной терапии необходимо учитывать, что введение 1 МЕ FII на 1 кг массы тела пациента повышает активность FII, в среднем, на 2% (восстановление активности FII - тест восстановления = 2). Период полувыведения FII составляет около 60 часов. Таким образом, стандартная терапевтическая доза КПК 20 - 30 МЕ/кг массы тела пациента (здесь и далее расчет по FIX) повышает активность плазменного FII до 40 - 60%. У пациентов с активным кровотечением этот показатель может быть меньше.
При тяжелых кровотечениях или больших хирургических вмешательствах у пациентов с дефицитом FII КПК назначается в стартовой насыщающей дозе 20 - 60 МЕ/кг массы тела пациента с последующими повторными инфузиями препарата в дозе 10 - 30 МЕ/кг массы тела пациента с интервалами в 24 - 48 часов для достижения и поддержания активности FII > 20%.
- Рекомендуется проведение профилактического лечения с введением КПК у пациентов с дефицитом FII в дозе 20 - 40 МЕ/кг массы тела пациента с интервалом в 5 - 7 дней с целью достижения активности FII >= 10%, с целью предотвращения развития геморрагического синдрома, при наличии персонального или семейного анамнеза, тяжелого клинического фенотипа, предшествующих кровотечений или при снижении активности FII < 1% [16, 27, 40].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: сведений о возможном возникновении аллоантител к FII не имеется. В настоящее время в РФ зарегистрированы 2 препарата КПК, содержащие FII: факторы свертывания крови II, VII, IX и X в комбинации [протромбиновый комплекс]** и факторы свертывания крови II, IX и X в комбинации**.
В случае недоступности КПК возможно использование карантинизированной СЗП в дозе 15 - 25 мл/кг массы тела пациента, повышающей плазменную активность FII до 30 - 40%. Использование СЗП возможно в исключительных случаях и не должно являться постоянной практикой.
- Рекомендуется для купирования легких кровотечений или в случае проведения малого хирургического вмешательства у пациентов с дефицитом FII назначение транексамовой кислоты** в дозе 15 - 20 мг/кг массы тела пациента или 1,0 г x 4 раза в сутки [16].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
- Рекомендуется для купирования или предупреждения кровотечений у пациентов при гипопроконвертинемии проведение специфической заместительной терапии следующими препаратами: плазматическим концентратом фактора свертывания крови FVII, эптаког альфа (активированным)** - рекомбинантным активированным FVII (rFVIIa) и КПК, содержащими FVII [15, 19, 24, 33, 34, 35, 37, 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Гемостатическая терапия концентратом плазматического FVII проводится при развитии кровотечения/кровоизлияния в дозе 20 - 30 МЕ/кг массы тела пациента каждые 4 - 6 часов до купирования геморрагического синдрома. С целью предупреждения возникновения кровотечения возможно проведение заместительной терапии плазматическим концентратом фактором свертывания крови VII в дозе 10 - 30 МЕ/кг массы тела пациента 3 раза в неделю.
Альтернативой концентрату плазматического фактора свертывания крови VII для лечения пациентов с гипопроконвертинемией является эптаког альфа (активированный)** [11, 34, 35]. Для остановки легкого кровотечения препарат вводится однократно в дозе 30 - 50 мкг/кг массы тела пациента. При возникновении умеренного или тяжелого кровотечения, а также в случае высокого риска развития геморрагических осложнений во время и после проведения хирургических вмешательств рекомендуются повторные введения эптаког альфа (активированного)** в дозе 15 - 30 мкг/кг массы тела пациента с интервалом в 4 - 6 часов (обычно не менее 3-х инфузий) [11].
При выполнении малых хирургических вмешательств или инвазивных процедур минимальная доза эптаког альфа (активированного)** должна составлять 15 мкг/кг массы тела пациента до проведения манипуляции и вводится, как минимум, дважды после окончания процедуры с интервалом в 4 - 6 часов [24, 34, 35].
При проведении хирургического лечения частота введения препаратов определяется объемом хирургического вмешательства. Рекомендуется контролировать ПВ не реже 1 раза в 12 часов и проводить заместительную терапию при снижении МНО менее 1,3.
- Рекомендуется профилактическое введение препаратов фактора свертывания крови VII* пациентам с гипопроконвертинемией при повторных кровоизлияниях в суставы, рецидивирующих кровоизлияниях и кровотечениях другой локализации, при условии, что геморрагический синдром определяет прогноз для здоровья и жизни пациента и значимо нарушает качество его жизни [16, 36, 40].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: Частота введений препаратов подбирается индивидуально с учетом клинической картины заболевания. Профилактическое введение препаратов может быть как краткосрочным (например, при маточных кровотечениях: эптаког альфа (активированный)** в дозе 20 - 40 мкг/кг массы тела пациентки 3 - 4 инфузии с интервалом в 12 - 24 часов до достижения клинического ответа), так и длительным (например, при рецидивирующих гемартрозах - введение плазматического концентрата фактора свертывания крови VII в дозе 20 - 30 МЕ/кг массы тела пациента 3 раза в неделю).
- Рекомендуется у новорожденных с гипопроконвертинемией, не имеющих семейного анамнеза тяжелых кровотечений, но с активностью FVII <= 1%, проведение краткосрочной профилактики эптаког альфа (активированным)** в дозе 20 - 40 мкг/кг массы тела пациента 3 раза в неделю до достижения 6 - 12-месячного возраста [7, 8, 37, 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Эффективность терапии концентратом фактора свертывания крови VII и эптаког альфа (активированным)** идентична. Имеются сведения о возможном появлении аллоантител к FVII при проведении заместительной терапии. При условии равной эффективности и удовлетворительной индивидуальной переносимости выбор лекарственного средства для заместительной терапии зависит от возможности бесперебойного обеспечения пациента этим препаратом.
- Рекомендуется в случае отсутствия эптаког альфа (активированного)** и концентрата плазматического фактора свертывания крови VII для остановки кровотечения при дефиците FVII однократно применять КПК в дозе 20 - 30 МЕ/кг (FIX) массы тела пациента [11].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: В связи с повышенным риском развития тромбозов при использовании этих препаратов повторная инъекция возможна не ранее 24 часов после предыдущего введения препарата.
- Рекомендуется для купирования геморрагического синдрома у пациентов при гипопроконвертинемии использование антиингибиторного коагулянтного комплекса** [11, 37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV).
Комментарии: в дозе 20 - 40 Ед/кг массы тела однократно в сутки до полной остановки кровотечения.
- Рекомендуется, в случае недоступности эптаког альфа (активированного)**, концентрата плазматического фактора свертывания крови VII, КПК и антиингибиторного коагулянтного комплекса**, у пациентов с РНСК применение карантинизированной СЗП в дозе 15 - 25 мл/кг массы тела пациента [11, 27].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: Использование СЗП возможно в исключительных случаях и не должно являться постоянной практикой.
- Рекомендуется при гипопроконвертинемии для купирования легких кровотечений у пациентов или в случае проведения малого хирургического вмешательства с высоким риском развития кровотечения, а также во всех случаях низкого риска развития послеоперационного геморрагического синдрома монотерапии транексамовой кислотой** в дозе 10 - 15 мг/кг массы тела пациента или 1,0 г x 2 - 3 раза в сутки [16].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
- Рекомендуется для лечения пациентов с дефицитом FX специфическая заместительная терапия КПК [6, 11, 17, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: в настоящее время в РФ зарегистрированы 2 препарата КПК, содержащие FX: КПК - факторы свертывания крови II, VII, IX и X в комбинации [протромбиновый комплекс]** и факторы свертывания крови II, IX и X в комбинации**
- Рекомендуется всем пациентам с РНСК использование плазматических очищенных вирус-инактивированных КПК [11, 16, 17, 27, 28, 36, 40, 41].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: КПК вводятся внутривенно. Используется болюсная инфузия со скоростью, рекомендованной производителем. Активность КПК, обычно, указывается по активности содержащегося в них FIX. Поэтому, необходимо отдельно уточнять содержание FX, которое указывается в инструкции. КПК содержат FIX и FX приблизительно в эквивалентной активности. При введении КПК в дозе 1 МЕ/кг массы тела пациента активность FX повышается, в среднем, на 2% (восстановление активности FX - тест восстановления = 2). Таким образом, стандартная терапевтическая доза КПК 20 - 30 (FIX) МЕ/кг массы тела пациента повышает активность плазменного FX до 40 - 60%.
При тяжелых кровотечениях или больших хирургических вмешательствах у пациентов с дефицитом FX КПК назначаются в стартовой насыщающей дозе 20 - 30 (FIX) МЕ/кг массы тела пациента с последующими повторными инфузиями препарата в дозе 10 - 20 (FIX) МЕ/кг массы тела пациента с интервалами в 24 - 48 часов для достижения и поддержания активности FX > 20%.
При дефиците FX рекомендуется проведение долговременного профилактического лечения пациентов с целью предотвращения развития геморрагического синдрома при наличии персонального или семейного анамнеза тяжелого клинического фенотипа предшествующих кровотечений или при снижении активности FX < 2% [11, 16, 17, 27, 28, 36, 40, 41].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: КПК назначается в дозе 20 - 30 (FIX) МЕ/кг массы тела пациента 2 - 3 раза в неделю с целью поддержания активности FX > 1% у взрослых и > 2% у детей. Альтернативный вариант проведения профилактического лечения может быть использован у пациентов с базовой активностью FX < 5%: КПК в дозе 20 - 70 (FIX) МЕ/кг массы тела пациента вводится 1 раз в неделю. Сведений о возможном возникновении изоантител к FX не имеется.
- Рекомендуется в случае недоступности КПК использование карантинизированной СЗП в дозе 15 - 25 мл/кг массы тела пациента, повышающей плазменную активность FX до 30 - 40% [27, 41].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: Использование СЗП возможно в исключительных случаях и не должно являться постоянной практикой.
- Рекомендуется для купирования легких кровотечений у пациентов или в случае проведения малого хирургического вмешательства при дефиците FX проведение монотерапии транексамовой кислотой** в дозе 15 - 20 мг/кг массы тела пациента или 1,0 г x 4 раза в сутки [16, 18].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
4. Реабилитация
- Рекомендуется всем пациентам с РНСК после кровоизлияний в ЦНС, с поражением опорно-двигательного аппарата санаторно-курортное лечение в санаториях общего профиля [16, 27, 39].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - V)
Комментарии: Разработка реабилитационных мероприятий должна проводиться совместно специалистами по реабилитации, курортологии и гематологами, имеющими опыт лечения пациентов с нарушениями свертывания крови. Лечение можно проводить в санаторно-курортных организациях в климатической зоне проживания пациента, а также на бальнеологических курортах.
Целесообразно проведение школ психологической адаптации для пациентов с РНСК.
5. Профилактика
- Рекомендуется пациентам проведение профилактической заместительной терапии при повторных кровоизлияниях в суставы, рецидивирующих кровоизлияниях и кровотечениях другой локализации, при условии, что геморрагический синдром определяет прогноз для здоровья и жизни пациента и значимо нарушает качество его жизни [4, 11, 16, 24, 37, 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Основным принципом предотвращения возникновения геморрагических эпизодов является проведение своевременной заместительной терапии концентратами дефицитных факторов.
Профилактическая терапия может осуществляться после подписания информированного согласия пациентом или его законными представителями. Профилактическое лечение может проводиться на дому пациентом или его родственниками.
- Рекомендуется всем пациентам проводить осмотр пациентов врачом-гематологом, врачом-ортопедом и врачом-стоматологом не менее 2-х раз в год; остальными специалистами - по необходимости [23, 24, 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарии: Целесообразно проведение диспансеризации пациентов 1 раз в год в специализированном центре нарушений гемостаза, если центр располагает достаточной клинико-лабораторной базой. Диспансерное наблюдение за пациентами с РНСК должно включать:
1. обязателен динамический мониторинг состояния пациента с оценкой наличия нежелательных явлений при проведении заместительной терапии: появление ингибитора к факторам свертывания крови, индивидуальная непереносимость препаратов, вирусная контаминация, изменения психологического или социального статуса пациента, оценка состояния периферической венозной системы.
2. лечение осложнений РНСК: коррекция дефицита железа, ингибиторов.
3. выявление и лечение сопутствующих заболеваний, особенно заболеваний зубов, полости рта, ЖКТ, ЛОР-органов, патологии сердечно-сосудистой системы и др.
6. Дополнительная информация, влияющая на течение и исход заболевания
Применение неспецифических гемостатических препаратов
Помимо специфической гемостатической и заместительной терапии врач-гематолог может использовать дополнительные лекарственные средства в лечении пациентов с РНСК, например, гормональную терапию у женщин с рецидивирующими тяжелыми маточными кровотечениями.
Транексамовая кислота** и другие антифибринолитические средства могут применяться для купирования меноррагий и легких кровотечений из слизистых оболочек, за исключением почечных кровотечений. Антифибринолитические препараты могут использоваться в монотерапии или в дополнение к концентратам факторов свертывания крови. В случае высокого риска возможных тромботических осложнений применение антифибринолитических препаратов недопустимо. Для предупреждения хирургических или акушерских кровотечений транексамовая кислота** должна быть назначена перорально или внутривенно не позднее, чем за 2 часа до операции или родов для достижения пиковых значений в плазме во время проведения манипуляции. Транексамовая кислота** должна с осторожностью использоваться одновременно с концентратами протромбинового комплекса из-за высокого риска развития тромботических осложнений.
Особенности дефицита FII у детей
Проявлением дефицита FII у детей могут быть пупочные кровотечения или кровоизлияния в ЦНС. Важно помнить, что у детей в первом полугодии жизни нормальная активность FII составляет 26 - 70%. Взрослых значений активность FII достигает к 6-месячному возрасту. Необходимо проведение неоднократных повторных обследований пациента после достижения 6-месячного возраста. Поэтому точно установить диагноз дефицита FII можно у детей старше 1 года. В любом случае при диагностике удлинения ПВ у детей в этом возрасте показано назначение препаратов витамина K1 [7, 8, 30, 43].
Ведение женщин с дефицитом FII во время беременности и родов
В течение нормально протекающей беременности активность FII существенно не меняется и обычно остается недостаточной для неосложненного родоразрешения у женщин с тяжелым дефицитом протромбина. При активности FII < 20% с целью предотвращения развития геморрагических осложнений в родах необходимо введение КПК* в дозе 20 - 40 МЕ/кг массы тела пациентки однократно при начале родовой деятельности или перед кесаревым сечением для достижения активности FII 20 - 40%. Повторные инфузии препарата производятся с интервалом в 48 часов в дозе 10 - 20 МЕ/кг массы тела пациентки с целью поддержания активности FII > 20% в течение, как минимум, 3 - 5 дней после родов. При отсутствии клинических проявлений заболевания во время беременности заместительная терапия КПК не проводится, в случае развития кровотечения терапия проводится по общим принципам [25].
Особенности течения гипопроконвертинемии у детей
У новорожденных с дефицитом FVII существует опасность возникновения спонтанных кровоизлияний в ЦНС или пупочных кровотечений. Другие проявления геморрагического синдрома нехарактерны. Физиологическая активность FVII при рождении составляет 28 - 104% и достигает нормальных значений к 6-месячному возрасту. Поэтому, окончательный диагноз устанавливается в возрасте после 6 - 12 месяцев [7, 8].
Ведение женщин с гипопроконвертинемией во время беременности и родов
В течение нормально протекающей беременности активность FVII физиологически повышается. Женщины с легким дефицитом FVII могут достигнуть к моменту родов необходимого гемостатического уровня активности FVII без проведения специфической заместительной терапии.
У беременных с тяжелым дефицитом FVII есть риск развития геморрагических осложнений в родах. Женщинам с активностью FVII <= 20% перед проведением кесарева сечения или с началом родовой деятельности необходимо проведение заместительной терапии эптаког альфа (активированным)** в дозе 15 - 30 мкг/кг массы тела пациентки каждые 4 - 6 часов в течение не менее 3-х дней. Для всех остальных женщин с дефицитом FVII эптаког альфа (активированный)** назначается только в случае развития кровотечения согласно FVII общим принципам терапии [12, 25, 29].
Особенности течения дефицита FX у детей
У новорожденных с дефицитом FX возможны кровоизлияния в ЦНС или пупочные кровотечения. Физиологическая активность FX при рождении составляет 12 - 68% и повышается к 6-месячному возрасту. Поэтому окончательное установление диагноза дефицита FX у новорожденных требует обязательного сравнения полученных результатов лабораторного исследования с референсными интервалами допустимых в неонатальном периоде значений и повторного обследования пациента после достижения 6-месячного возраста. При выявлении у детей первого полугодия сниженной активности FX показано назначение препаратов витамина K1 [7, 8, 17, 18, 23].
Ведение женщин с дефицитом FX во время беременности и родов
У женщин с активностью FX менее 30% возможны проблемы с зачатием. Беременность осложняется ранними выкидышами в первом триместре, геморрагическими проявлениями (чаще геморрагическим циститом) во втором и третьем триместре. Необходимый уровень FX до и во время беременности должен быть не менее 30%.
Несмотря на физиологическое повышение активности FX в течение нормально протекающей беременности, у женщин с тяжелым дефицитом FX его уровень к родам обычно остается недостаточным для обеспечения нормального гемостаза. Женщинам с активностью FX <= 30% в третьем триместре беременности с наличием в анамнезе кровотечений до беременности, а также перед проведением кесарева сечения с началом родовой деятельности необходимо проведение заместительной терапии КПК* в дозе 20 - 40 (FIX) МЕ/кг массы тела пациентки для достижения активности FX > 40%. Дальнейшие инфузии КПК* проводятся с интервалом в 24 часа в дозе 10 - 20 (FIX) МЕ/кг массы тела пациентки в течение, как минимум, 3-х дней с целью поддержания активности FX не менее 30% [13, 41, 42].
Проведение лабораторных исследований
Лабораторные анализы лежат в основе диагностики и контроля у пациентов с РНСК. Требования к условиям и технике отбора образцов и выполнения исследований не отличаются от стандартных. Важным аспектом лабораторных исследований является участие в системе контроля качества. При диагностике РНСК оптимально участвовать не только в государственной, но и в международной системе контроля качества лабораторных исследований, охватывающей основные коагулологические параметры [1, 2, 3, 5, 21].
Вакцинация
Пациенты с РНСК могут быть вакцинированы. Особенно важно проведение вакцинации от гепатита B. При вакцинации предпочтение отдается оральному или подкожному введению препарата, по сравнению с внутримышечным или внутрикожным. Если для данной вакцины доступен только внутримышечный путь введения, необходима заместительная терапия для предотвращения развития гематомы. В этом случае заместительную терапию проводят накануне вакцинации. В день вакцинации введение препарата не рекомендуется. Нельзя проводить вакцинацию во время кровотечения [11].
Обучение пациентов и членов их семей
Обучение пациентов и членов их семей - необходимое условие обеспечения адекватной помощи пациентам с РНСК. Обучение начинается сразу после установления диагноза и проводится на постоянной основе врачами и медицинскими сестрами центра, в котором наблюдается пациент. Обучение проводится индивидуально при посещении центра и в рамках школы пациента с РНСК.
Основные направления обучения пациента и членов его семьи: что такое РНСК, особенности заболевания в детском возрасте, навыки оценки состояния ребенка, навыки оценки симптомов, характера и тяжести кровотечения, хранение и использование концентратов факторов свертывания крови, показания и дозы заместительной терапии, навыки проведения инфузии в домашних условиях, уход за венами, применение других гемостатических препаратов, физическая активность, психологическая и социальная адаптация, профессиональная ориентация, юридические аспекты.
Помимо врачей и медсестер к обучению пациентов и членов их семей необходимо привлекать психологов, юристов и членов общественных организаций, представляющих интересы пациентов с нарушениями свертывания крови.
7. Организация медицинской помощи
Показания для плановой госпитализации:
1) плановое оперативное лечение.
Показания для экстренной госпитализации:
1) жизнеугрожающее кровотечение;
2) проведение экстренного оперативного вмешательства.
Показания к выписке пациента из стационара:
1) полная остановка кровотечения
Критерии оценки качества медицинской помощи
|
N
|
Критерии качества
|
Уровень достоверности доказательств
|
Уровень убедительности рекомендаций
|
|
1.
|
Выполнен сбор жалоб, анамнеза, объективный статус пациента (наличие геморрагического синдрома)
|
V
|
D
|
|
2
|
Выполнен общий анализ крови с подсчетом тромбоцитов
|
V
|
D
|
|
3
|
Выполнена коагулограмма (основные тесты: АЧТВ, ПТИ, ТВ, ВК, фибриноген)
|
IV
|
C
|
|
4
|
Выполнено определение активности факторов свертывания крови
|
IV
|
C
|
|
5
|
Выполнено определение волчаночного антикоагулянта
|
IV
|
C
|
|
6
|
Проведена молекулярно-генетическая диагностика нарушений FII, FVII, FX*
|
IV
|
C
|
|
7
|
Проведена заместительная терапия концентратами факторов свертывания крови в соответствии с выявленным дефицитом
|
V
|
D
|
|
8
|
Выполнено определение повышения активности дефицитных факторов свертывания крови при динамическом контроле проводимой терапии*
|
IV
|
C
|
|
9
|
Выполнено купирование геморрагического синдрома.
|
V
|
D
|
|
10
|
Проведена гемостатическая терапия компонентами крови (при отсутствии специфических лекарственных препаратов)
|
V
|
D
|
|
11
|
Достигнута положительная динамика клинических проявлений геморрагического синдрома у пациента в течение 24 часов от начала терапии
|
V
|
D
|
|
12
|
Достигнуто клиническое улучшение состояния пациента
|
V
|
D
|
Список литературы
1. Баркаган З.С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза. М., 2001.
2. Добровольский А.Б., Косырев А.Б. Протромбиновый тест: Методика выполнения и клиническое значение. Ассоциация медицинской лабораторной диагностики. Информационный бюллетень, 1995; 2: 34 - 38.
3. Момот А.П. Принципы и алгоритмы клинико-лабораторной диагностики. СПб., 2006.
4. Основы клинической гемостазиологии и гемореологии: монография / Под ред. И.Л. Давыдкина, А.П. Момота, Н.И. Зозули, Е.В. Ройтмана. - Самара: ООО ИПК "Самарская Губерния", 2017.
5. Рекомендации Всероссийской ассоциации по изучению тромбозов, геморрагий и патологии сосудов. М., 2002.
6. Руководство по гематологии: в 3 т. Т. 3 / Под редакцией А.И. Воробьева. 3-е изд. М., 2005.
7. Суворова А.В., Абраменко Л.И., Курденко И.В., Назарова Р.В. Патология системы гемостаза у новорожденных. Барнаул, 2004.
8. Шабалов Н.П. Гемостаз в динамике первой недели жизни как отражение механизмов адаптации к внеутробной жизни новорожденных. Педиатрия, 2000; 3: 84 - 91.
9. Acharya, S.S., Coughlin, A., Dimichele, D.M. & North American Rare Bleeding Disorder Study, G. Rare Bleeding Disorder Registry: deficiencies of factors II, V, VII, X, XIII, fibrinogen and dysfibrinogenemias. Journal of Thrombosis and Haemostasis, 2004; 2: 248 - 256.
10. Akhavan, S., Mannucci, P.M., Lak, M., Mancuso, G., Mazzucconi, M.G., Rocino, A., Jenkins, P.V. & Perkins, S.J. Identification and three-dimensional structural analysis of nine novel mutations in patients with prothrombin deficiency. Thrombosis and Haemostasis, 2000; 84: 989 - 997.
11. Andrew D. Mamford, Writing Group Chair and BCSH Task Force Member Sam Ackroyd, Raza Alikhan, Louise Bowles, Pratima Chowdary, John Grainger, Jason Mainwaring, Mary Mathias and Niamh O'Connell on behalf of the BCSH Committee. Guideline for the diagnosis and management of the rare coagulation disorders. British Journal of Haematology 2014; 5: 1 - 23.
12. Baumann Kreuziger, L.M., Morton, C.T. & Reding, M.T. Is prophylaxis required for delivery in women with factor VII deficiency. Haemophilia, 2013; 19: 827 - 832.
13. Beksac, M.S., Atak, Z. & Ozlu, T. Severe factor X deficiency in a twin pregnancy. Archives of Gynecology and Obstetrics, 2010; 281: 151 - 152.
14. Bernardi, F., Dolce, A., Pinotti M., Shapiro, A.D., Santagostino, E., Peyvandi, F., Batorova, A., Lapecorella, M., Schved, J.F., Ingerslev, J., Mariani, G. & International Factor VII Deficiency Study Group. Major differences in bleeding symptoms between factor VII deficiency and hemophilia B. Journal of Thrombosis and Haemostasis, 2009; 7: 774 - 779.
15. Berrettini, M., Mariani, G., Schiavoni, M., Rocino, A., Di Paolantonio, T., Longo, G. & Morfini, M. Pharmacokinetic evaluation of recombinant, activated factor VII in patients with inherited factor VII deficiency. Haematologica, 2001; 86: 640 - 645.
16. Bolton-Maggs, P.H., Perry, D.J., Chalmers, E.A., Parapia, L.A., Wilde, J.T., Williams, M.D., Collins, P.W., Kitchen, S., Dolan, G. & Mumford, A.D. The rare coagulation disorders - review with guidelines for management from the United Kingdom Haemophilia Centre Doctors' Organisation. Haemophilia, 2004; 10: 593 - 628.
17. Bowles, L., Baker, K., Khair, K., Mathias, M. & Liesner, R. Prophylaxis with prothrombin complex concentrate in four children with severe congenital factor X deficiency. Haemophilia, 2009; 15: 401 - 403.
18. Brown, D.L. & Kouides, P.A. Diagnosis and treatment of inherited factor X deficiency. Haemophilia, 2008; 14: 1176 - 1182.
19. Di Minno, M.N., Dolce, A., Mariani, G. & STER Study Group. Bleeding symptoms at disease presentation and prediction of ensuing bleeding in inherited FVII deficiency. Thrombosis and Haemostasis, 2013; 109: 1051 - 1059.
20. Giansily-Blaizot, M., Marty, S., Chen, S.W., Pellequer, J.L. & Schved, J.F. Is the coexistence of thromboembolic events and Factor VII deficiency fortuitous? Thrombosis Research, 2012; 130: S47 - S49.
21. Girolami, A., Vettore, S., Scarparo, P. & Lombardi, A.M. Persistent validity of a classification of congenital factor X defects based on clotting, chromogenic and immunological assays even in the molecular biology era. Haemophilia, 2011; 17: 17 - 20.
22. Girolami, A., Scarparo, P., Bonamigo, E., Treleani, M. & Lombardi, A.M. Homozygous FVII deficiencies with different reactivity towards tissue thromboplastins of different origin. Hematology, 2012; 17: 350 - 354.
23. Herrmann F.H., Auerswald G., Ruiz-Saez A., Navarrete M., Pollmann H., Lopaciuk S., Batorova A., Wulff K. & Greifswald Factor X Deficiency Study Group. Factor X deficiency: clinical manifestation of 102 subjects from Europe and Latin America with mutations in the factor 10 gene. Haemophilia, 2006; 12: 479 - 489.
24. Herrmann, F.H., Wulff, K., Auerswald, G., Schulman, S., Astermark, J., Batorova, A., Kreuz, W., Pollmann, H., Ruiz-Saez, A., De Bosch, N., Salazar-Sanchez, L. & Greifswald Factor VII Deficiency Study Group. Factor VII deficiency: clinical manifestation of 717 subjects from Europe and Latin America with mutations in the factor 7 gene. Haemophilia, 2009; 15: 267 - 280.
25. Kadir, R., Chi, C. & BoltonMaggs, P. Pregnancy and rare bleeding disorders. Haemophilia, 2009; 15: 990 - 1005.
26. Karimi, M., Vafafar, A., Haghpanah, S., Payandeh, M., Eshghi P., Hoofar, H., Afrasiabi, A., Gerdabi, J., Ardeshiri, R., Menegatti, M. & Peyvandi, F. Efficacy of prophylaxis and genotype-phenotype correlation in patients with severe Factor X deficiency in Iran. Haemophilia, 2012; 18: 211 - 215.
27. Keeling, D., Tait, C. & Makris, M. Guideline on the selection and use of therapeutic products to treat haemophilia and other hereditary bleeding disorders. A United Kingdom Haemophilia Center Doctors' Organisation (UKHCDO) guideline approved by the British Committee for Standards in Haematology. Haemophilia, 2008; 14: 671 - 684.
28. Kouides, P.A. & Kulzer, L. Prophylactic treatment of severe factor X deficiency with prothrombin complex concentrate. Haemophilia, 2001; 7: 220 - 223.
29. Kulkarni, A.A., Lee, C.A. & Kadir, R.A. Pregnancy in women with congenital factor VII deficiency. Haemophilia, 2006; 12: 413 - 416.
30. Lancellotti, S., Basso, M. & De Cristofaro, R. Congenital prothrombin deficiency: an update. Seminars in Thrombosis and Hemostasis, 2013; 39: 596 - 606.
31. Mannucci, P.M., Duga, S. & Peyvandi, F. Recessively inherited coagulation disorders. Blood, 2004; 104: 1243 - 1252.
32. Mariani, G., Herrmann, F.H., Dolce, A., Batorova, A., Etro, D., Peyvandi, F., Wulff, K., Schved, J.F., Auerswald, G., Ingerslev, J. & Bernardi, F. Clinical phenotypes and factor VII genotype in congenital factor VII deficiency. Thrombosis and Haemostasis, 2005; 93: 481 - 487.
33. Mariani G., Konkle B.A. & Ingerslev J. Congenital factor VII deficiency: therapy with recombinant activated factor VII - a critical appraisal. Haemophilia, 2006; 12: 19 - 27.
34. Mariani, G., Dolce, A., Batorova, A., Auerswald, G., Schved, J.F., Siragusa, S., Napolitano, M., Knudsen, J.B. & Ingerslev, J. Recombinant, activated factor VII for surgery in factor VII deficiency: a prospective evaluation - the surgical STER. British Journal of Haematology, 2011; 152: 340 - 346.
35. Mariani, G., Napolitano, M., Dolce, A., Perez Garrido, R., Batorova, A., Karimi, M., Platokouki, H., Auerswald, G., Bertrand, A.M., Di Minno, G., Schved, J.F., Bjerre, J., Ingerslev, J., Sorensen, B., Ruiz-Saez, A., Seven Treatment Evaluation R. & International Factor V.I.I.D.S.G. Replacement therapy for bleeding episodes in factor VII deficiency. A prospective evaluation. Thrombosis and Haemostasis, 2013; 109: 238 - 247.
36. McMahon, C., Smith, J., Goonan, C., Byrne, M. & Smith, O.P. The role of primary prophylactic factor replacement therapy in children with severe factor X deficiency. British Journal of Haematology, 2002; 119: 789 - 791.
37. Napolitano, M., Giansily-Blaizot, M., Dolce, A., Schved, J.F., Auerswald, G., Ingerslev, J., Bjerre, J., Altisent, C., Charoenkwan, P., Michaels, L., Chuansumrit, A., Di Minno, G., Caliskan, U. & Mariani, G. Prophylaxis in congenital factor VII deficiency: indications, efficacy and safety. Results from the Seven Treatment Evaluation Registry (STER). Haematologica, 2013; 98: 538 - 544.
38. Peyvandi, F., Palla, R., Menegatti, M., Siboni, S.M., Halimeh, S., Faeser, B., Pergantou, H., Platokouki, H., Giangrande, P., Peerlinck, K., Celkan, T., Ozdemir, N., Bidlingmaier, C., Ingerslev, J., Giansily-Blaizot, M., Schved, J.F., Gilmore, R., Gadisseur, A., Benedik-Dolnicar, M., Kitanovski, L., Mikovic, D., Musallam, K.M. & Rosendaal, F.R. Coagulation factor activity and clinical bleeding severity in rare bleeding disorders: results from the European Network of Rare Bleeding Disorders. Journal of Thrombosis and Haemostasis, 2012; 10: 615 - 621.
39. Peyvandi, F., Di Michele, D., Bolton-Maggs, P.H., Lee, C.A., Tripodi, A., Srivastava, A. & Project on Consensus Definitions in Rare Bleeeding Disorders of the Factor VIII/Factor IX Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. Classification of rare bleeding disorders (RBDs) based on the association between coagulant factor activity and clinical bleeding severity. Journal of Thrombosis and Haemostasis, 2012; 10: 1938 - 1943.
40. Todd, T. & Perry, D.J. A review of long-term prophylaxis in the rare inherited coagulation factor deficiencies. Haemophilia, 2010; 16: 569 - 583.
41. Uprichard, J. & Perry, D.J. Factor X deficiency. Blood Reviews, 2002; 16: 97 - 110.
42. van Veen J.J., Hampton, K.K., Maclean, R., Fairlie, F. & Makris, M. Blood product support for delivery in severe factor X deficiency: the use of thrombin generation to guide therapy. Blood Transfusion, 2007; 5: 204 - 209.
43. Viswabandya, A., Baidya, S., Nair, S.C., Abraham, A., George, B., Mathews, V., Chandy, M. & Srivastava, A. Correlating clinical manifestations with factor levels in rare bleeding disorders: a report from Southern India. Haemophilia, 2012; 18: e195 - e200.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Зозуля Надежда Ивановна, д.м.н., врач-гематолог, зав. отделом коагулопатий ФГБУ "НМИЦ гематологии" Минздрава России, национальное гематологическое общество, г. Москва.
2. Кумскова Мария Алексеевна, врач-гематолог отдела коагулопатий ФГБУ "НМИЦ гематологии" Минздрава России, национальное гематологическое общество, г. Москва.
3. Свирин Павел Вячеславович, врач-гематолог ГБУЗ Морозовской ДГКБ ДЗМ г. Москвы, ассистент кафедры онкологии и лучевой терапии педиатрического факультета ГБОУ ВПО РНИМУ им. Н.И. Пирогова, национальное общество детских гематологов и онкологов, г. Москва.
Конфликт интересов: нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория - врачи:
- Врачи-гематологи
- Врачи-педиатры
- Врачи-терапевты
- Врачи-хирурги
- Врачи-стоматологи
- Врачи-отоларингологи
- Врачи-ортопеды-травматологи
- Врачи-гинекологи
Методы, использованные для сбора/селекции доказательств:
- Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0,3.
- Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в базы данных PUBMED, MEDLINE, Кокрановской библиотеки. Поиск проводился на глубину более 20 лет.
Методы, использованные для анализа доказательств:
- Обзоры мета-анализов, рандомизированных проспективных контролируемых перекрестных клинических исследований.
- Обзоры опубликованных исследований случай-контроль или когортных исследований.
- Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств в соответствии с рейтинговой системой убедительности доказательств (приложение 1).
Методология разработки рекомендаций:
Описание методики анализа доказательств и разработки рекомендаций
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология должна быть изучена для того, чтобы убедиться в соответствии ее принципам доказательной медицины. Результат изучения влияет на уровень доказательности, присваиваемый публикации, что в свою очередь влияет на силу вытекающих из нее рекомендаций.
Методологическое изучение фокусируется на особенностях дизайна исследования, которые оказывали существенное влияние на качество результатов и выводов.
С целью исключения влияния субъективных факторов каждое исследование оценивается, как минимум, двумя независимыми членами авторского коллектива. Различия в оценке обсуждаются на совещаниях рабочей группы авторского коллектива данных рекомендаций.
На основании анализа доказательств разработаны разделы клинических рекомендаций с оценкой силы в соответствии с рейтинговой системой градаций доказательности рекомендаций (приложение 2).
Методы, использованные для формулирования рекомендаций:
- Консенсус экспертов.
- Оценка значимости рекомендаций в соответствии с рейтинговой системой градаций доказательности рекомендаций
Индикаторы доброкачественной клинической практики (Good Practice Points - GPPs): доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций:
Методы валидизации рекомендаций:
- Внешняя экспертная оценка.
- Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Рекомендации в предварительной версии рецензируются независимыми экспертами, которых просят прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также проводится экспертная оценка стиля изложения рекомендаций и их доступности для понимания.
Предварительные версии рекомендаций представляются для обсуждения на научных гематологических конференциях Национального гематологического общества и заседаниях Профильной комиссии по Гематологии, Рабочей группы по разработке клинических рекомендаций Гематологического научного центра, ведущими специалистами профильных Федеральных центров РФ и практическими врачами.
Изучаются комментарии со стороны врачей-гематологов амбулаторного и стационарного этапов в отношении доходчивости и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Замечания и комментарии, полученные от экспертов, тщательно систематизируются и обсуждаются авторским коллективом. При необходимости проводится внесение изменений и дополнений в текст рекомендаций.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации повторно анализируются членами авторского коллектива, для подтверждения того, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Окончательная редакция клинических рекомендаций рассматриваются и утверждаются на заседании Профильной комиссии по Гематологии, Рабочей группы по разработке клинических рекомендаций Гематологического научного центра, и в заключении, на конгрессе (съезде, пленуме) национального гематологического общества.
Приложение П1
УРОВНИ ДОКАЗАТЕЛЬНОСТИ РЕКОМЕНДАЦИЙ
(в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO)
|
Уровень доказательности
|
Тип доказательности
|
|
I
|
Доказательства получены в результате мета-анализа большого числа хорошо спланированных рандомизированных исследований. Рандомизированные исследования с низким уровнем ложнопозитивных и ложнонегативных ошибок.
|
|
II
|
Доказательства основаны на результатах не менее одного хорошо спланированного рандомизированного исследования. Рандомизированные исследования с высоким уровнем ложнопозитивных и ложнонегативных ошибок.
|
|
III
|
Доказательства основаны на результатах хорошо спланированных нерандомизированных исследований. Контролируемые исследования с одной группой больных, исследования с группой исторического контроля и т.д.
|
|
IV
|
Доказательства получены в результате нерандомизированных исследований. Непрямые сравнительные, описательно корреляционные исследования и исследования клинических случаев.
|
|
V
|
Доказательства основаны на клинических случаях и примерах.
|
Приложение П2
СТЕПЕНИ И ГРАДАЦИИ ДОКАЗАТЕЛЬНОСТИ РЕКОМЕНДАЦИЙ
(в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO)
|
Степень
|
Градация
|
|
A
|
Доказательство I уровня или устойчивые многочисленные данные II, III или IV уровня доказательности
|
|
B
|
Доказательства II, III или IV уровня, считающиеся в целом устойчивыми данными
|
|
C
|
Доказательства II, III, IV уровня, но данные в целом неустойчивые
|
|
D
|
Слабые или несистематические эмпирические доказательства
|
Несмотря на достигнутые успехи, клинические характеристики большинства РНСК остаются недостаточно документированными, принципы ведения пациентов разработаны на основе результатов открытых наблюдательных исследований. Ввиду редкости данной патологии во всем мире не проводилось ни одного рандомизированного контролируемого клинического исследования. Поэтому в соответствии с использованной доказательной базой большинство разработанных рекомендаций имеет не высокий уровень доказательности [16].
Данные клинические рекомендации были разработаны с целью обозначения основных направлений диагностики и ведения пациентов с дефицитом факторов свертывания крови II, VII и X в наиболее типичных сценариях. Тем не менее, необходимость персонифицированного подхода к лечению каждого пациента позволяет клиницисту модифицировать предложенные рекомендации с учетом индивидуального фенотипа заболевания и особенностей ответа пациента на проводимую терапию.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Нет
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
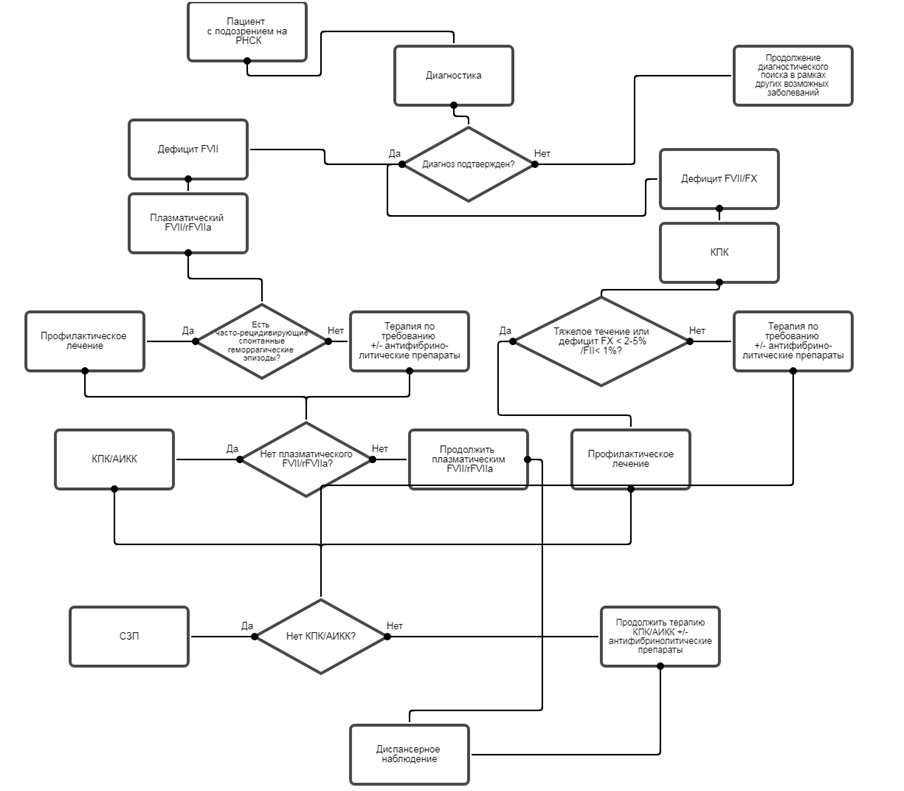
Алгоритм ведения пациента с РНСК (дефицит факторов свертывания крови II, VII, X)
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Памятка для пациентов с РНСК
1. В основе лечения пациентов с РНСК лежит специфическая заместительная терапия препаратами, содержащими дефицитный (сниженный или отсутствующий) фактор свертывания крови. Обеспечение этими препаратами и обучение их применению пациентов и членов семей пациентов с РНСК являются принципиально важными задачами в организации помощи пациентам с РНСК.
2. Для остановки кровотечений должна применяться заместительная терапия концентратами факторов свертывания крови. При проведении специфической заместительной терапии предпочтение должно отдаваться использованию рекомбинантных или высокоочищенных вирус-инактивированных плазматических концентратов факторов свертывания крови по отношению к СЗП.
3. В отношении пациентов с РНСК, тогда, когда возможно, должна проводиться стратегия домашнего лечения. Основными элементами стратегии являются: наличие у пациента гемостатических препаратов (препарат находится там же, где пациент), решение о применении гемостатического препарата принимает пациент или его родственники в соответствии с рекомендациями гематолога, пациент и (или) его родственники.
4. Необходимо сразу применять эффективные дозы концентратов факторов свертывания. Терапия недостаточными дозами не позволит остановить кровотечение, приведет к потере времени, нарастанию геморрагического синдрома и необоснованному расходу дорогостоящего препарата.
5. Гемостатическую терапию необходимо начинать как можно раньше (по возможности в течение первых 2-х часов после получения травмы, начала кровотечения или появления первых субъективных признаков кровоизлияния), поэтому основанием для начала терапии могут быть субъективные ощущения пациента или факт травмы. Желательно остановить кровотечение или кровоизлияние до развития значимых клинических проявлений.
6. Лечение легких и средних кровотечений должно проводиться на дому пациентом или его родственниками в соответствии с рекомендациями гематолога. При развитии жизнеугрожающего кровотечения терапия должна быть начата как можно раньше (на дому) и продолжена под наблюдением гематолога стационарно или амбулаторно.
7. Ключевым аспектом улучшения состояния здоровья и качества жизни при лечении РНСК является предотвращение кровотечений: гемартрозов, угрожающих жизни кровотечений и кровоизлияний (в центральную нервную систему (ЦНС), желудочно-кишечный тракт (ЖКТ), др.).
8. Все пациенты с РНСК должны быть зарегистрированы и наблюдаться в специализированном центре. У пациента или врачей, к которым он обращается, круглосуточно должна быть возможность контакта с гематологом, имеющим опыт лечения пациентовс нарушениями свертывания крови.
9. Наблюдение и лечение пациентов с РНСК должно проводиться группой специалистов различного профиля, включающей гематолога, педиатра, ортопеда, стоматолога, физиотерапевта, врача ЛФК, психолога, имеющих опыт работы с пациентами с нарушениями свертывания крови.
10. Осмотр пациентов гематологом и стоматологом должен проводиться не менее 1-го раза в год; остальными специалистами - по необходимости. Обычные осмотры стоматолога и чистка зубов могут проводиться без заместительной терапии факторами.
11. Для пациентов с РНСК важно соблюдение гигиены полости рта, что помогает предотвратить развитие пародонтоза и кариеса. Для чистки зубов необходимо использовать мягкую зубную щетку.
12. При стоматологических манипуляциях местная анестезия у пациентов с тяжелыми и среднетяжелыми формами дефицитов FII, FVII, FX должна проводиться только после введения специфического концентрата фактора свертывания.
13. При оказании стоматологической помощи важно тесное взаимодействие хирурга-стоматолога и врача-гематолога. Удаление зуба или хирургические процедуры должны выполняться под строгим контролем гемостаза и после консультации гематолога.
14. При проведении стоматологических процедур возможно применение транексамовой или других антифибринолитических препаратов с целью уменьшения необходимости в заместительной терапии концентратом фактора. Возможно использование местных гемостатических препаратов после удаления зубов.
15. При обширных стоматологических процедурах (наложение швов, множественная экстракция зубов) может понадобиться госпитализация пациента в стационар.
16. Пациентам с поражением элементов опорно-двигательного аппарата: необходимо долгосрочное лечение повреждений суставов и мышц, и функциональная реабилитация.
17. Обязательно выявление и лечение сопутствующих заболеваний, особенно заболеваний зубов, полости рта, ЖКТ, ЛОР-органов и др.
18. До начала любых инвазивных процедур необходимо введение концентрата фактора свертывания крови или применение неспецифических препаратов (ингибиторов фибринолиза) в зависимости от выраженности дефицита факторов свертывания крови.
19. Следует избегать внутримышечных инъекций и пункции артерий;
20. Следует поощрять регулярные занятия физическими упражнениями, способствующими развитию мускулатуры, защите суставов и улучшению физического состояния (например, лечебная гимнастика, плавание, терренкур).
21. Пациенты должны избегать ситуаций, связанных с высоким риском травм, в том числе занятия контактными видами единоборств, игр с тяжелым мячом, занятий на спортивных снарядах, и т.д. При решении вопроса о возможности занятия тем или иным видом физической деятельности необходимо учитывать тяжесть заболевания.
22. Пациентам следует воздержаться от применения НПВП, особенно ацетилсалициловой кислоты. С целью обезболивания возможно применение парацетамола/ацетаминофена/флупиртина.
Центры по лечению пациентов с РНСК:
1. ФГБУ "НМИЦ гематологии" Минздрава России, отдел коагулопатий. Новый Зыковский проезд, д. 4, г. Москва, 125167. Тел +7 (495) 612 29 12.
2. ГБУЗ Морозовская ДГКБ ДЗМ, г. Москва, гематологическое отделение. 4-ый Добрынинский пер., д. 1/9, г. Москва, 119049. Тел. +7 (499) 236 15 87.
3. Городской центр по лечению гемофилии СПб. ГБУЗ "Городская поликлиника N 37". Гороховая ул., д. 6, г. Санкт-Петербург, 191186. Тел. +7 (812) 315 48 71.
4. НИИ гематологии и трансфузиологии. 2-ая Советская ул., д. 16, г. Санкт-Петербург, 191186. Тел. +7 (812) 274 56 50.
5. ФГБУ Кировский научно-исследовательский институт гематологии и переливания крови. Красноармейская ул., д. 72, г. Киров, 610027. Тел. +7 (8332) 67 9197
6. Алтайский филиал ФГБУ "НМИЦ гематологии" Минздрава России. Краевой центр патологии гемостаза. Ляпидевского ул., д. 1, г. Барнаул, 656024. Тел. +7 (3852) 68 98 80.
Приложение Г
Нет